rhBMP-2对再生障碍性贫血小鼠骨髓造血恢复的促进作用
2016-10-27高巧艳邢万里刘昌胜华东理工大学材料科学与工程学院教育部医用生物材料工程研究中心上海200237
高巧艳, 王 靖, 邢万里, 戴 凯, 刘昌胜(华东理工大学材料科学与工程学院,教育部医用生物材料工程研究中心,上海 200237)
rhBMP-2对再生障碍性贫血小鼠骨髓造血恢复的促进作用
高巧艳, 王 靖, 邢万里, 戴 凯, 刘昌胜
(华东理工大学材料科学与工程学院,教育部医用生物材料工程研究中心,上海 200237)
探究了人重组骨形态发生蛋白-2(rhBMP-2)对再障小鼠的治疗作用。采用5-FU联合白消安建立小鼠再障模型,通过干预rhBMP-2进行治疗。考察了各实验组小鼠白细胞数、骨髓单核细胞数、体重、存活率、脾系数、粒系-巨系细胞集落(CFU-GM)数以及骨髓单核细胞中CD34+细胞比例,进行股骨、脾脏HE切片分析。结果表明,相较于再障对照组,rhBMP-2治疗组小鼠的白细胞数、存活率、CFU-GM集落数及骨髓单核细胞数显著提高,并且骨髓单核细胞中的CD34+细胞含量也提高,显著改善脾脏功能和缓解骨髓抑制,证实rhBMP-2能够促进再障小鼠造血损伤的修复。
重组人骨形态发生蛋白-2;再生障碍性贫血;造血损伤修复
再生障碍性贫血(Aplastic Anemia,AA)简称再障,是一种严重的血液病。它是由多种因素引发的造血障碍,导致造血组织减少,骨髓造血功能衰竭,以骨髓造血细胞增生减低和全血细胞减少为主要表现。再障可分为先天性再障和获得性再障。据统计国内的再障发病率为7.4×10-6,其中急性重型再障(SAA-I)发病率为1.4×10-6,慢性重型再障(SAA-Ⅱ)为6.0×10-6[1-2]。目前治疗再障的方法有造血干细胞移植、骨髓移植、免疫抑制治疗、免疫支持治疗、细胞因子治疗法等。但造血干细胞移植和骨髓移植来源有限,并且要考虑移植物抗宿主疾病,所以应用很有限。所以寻找对人体毒副作用小、治疗效果好的治疗再障药物具有重要的意义。
重组人骨形态发生蛋白-2(rh BMP-2)作为已被美国FDA批准用于脊柱融合和胫骨骨折临床治疗[3]的转化生长因子,因其具有优异的诱导间质细胞分化为骨和软骨细胞的特性[4]而备受关注。近年来的相关研究表明,BMP-2在机体造血发生过程中也有作用。田琼等[5-6]研究表明,rhBMP-2可减轻γ射线辐射及化疗药物CTX所致的急性造血损伤,具有治疗修复造血损伤的潜能;同时赵玮钦等[7]研究发现重组人骨形成蛋白成熟肽-4及重组人骨形成蛋白-4二连体对损伤造血系统修复有明显的促进作用。本文通过建立小鼠再障造血损伤模型,探究了rhBMP-2在再障造血损伤修复中的作用。
1 材料和方法
1.1主要试剂
rh BMP-2购自上海瑞邦生物材料有限公司;FITC Rat Anti-Mouse CD45、PE Rat Anti-Mouse CD34购自优宁维生物科技有限公司;小鼠单系集落甲基纤维素培养基购自北京安普生化科技有限公司;五氟尿嘧啶、白消安购自西安科创药业有限公司;红细胞裂解液(Tris-NH4Cl)购自碧云天生物科技有限公司;多聚甲醛购自上海凌峰化学试剂有限公司;溶血素、HB含酶清洗液购自南京普朗医用设备有限公司。
1.2主要仪器
FACs Calibur流式细胞仪购自美国BD公司;TE2000-U倒置显微镜购自日本Nikon公司;XFA 6130血细胞分析仪购自南京普朗医疗设备有限公司;5415R低温高速离心机购自德国Eppendorf公司;AB104-N电子分析天平购自梅特勒托仪器有限公司。
1.3实验方法
1.3.1再生障碍性贫血动物模型建立 Balb/C小鼠腹腔注射五氟尿嘧啶(5-FU)200μL(150 mg/kg),2 d后腹腔注射白消安200μL(15 mg/kg),每周1次,连续3周,建立小鼠再生障碍性贫血模型。1.3.2 实验动物及分组 SPF级Balb/C小鼠90只,雄性,18~20 g,鼠龄6~8周,购自上海中医药大学。所有动物适应性饲养观察3 d后随机分为3组,每组30只,正常饲养,自由摄食和饮水。其中A组(Normal):空白对照组,腹腔注射磷酸缓冲溶液(PBS);B组(BMP):rhBMP-2组,按1.3.1节的方法造模1周后,连续2周腹腔注射rhBMP-2(BMP),每只小鼠每天的剂量为50μg;C组(AA):再障对照组,按1.3.1节的方法造模1周后,连续2周腹腔注射PBS;各小鼠注射体积均为每天100μL。
各组小鼠在建模4周后全部处死检测。
1.3.3外周血白细胞(WBC)检测 造模前取1次血,造模后每周取1次血,检测白细胞数。方法如下:使用毛细玻璃管在小鼠右眼眼眶取血约50μL,采用质量分数3%的EDTA-K2溶液抗凝,然后用血细胞分析仪检测WBC数量。
1.3.4脾系数的检测 造模后第4周,检测脾系数。方法如下:处死前对小鼠先称重记录,处死后解剖取出脾脏并称重,脾系数=脾脏质量/体重。
1.3.5股骨骨髓单核细胞数(BMNC)检测 脱颈法处死小鼠,在体积分数为75%乙醇中浸泡5 min,在无菌环境下取出股骨,用5 m L的注射器吸取PBS,从股骨一端冲洗,冲洗液用4号针头过滤,再用400目(38μm)的无菌纱布过滤,离心去上清后加入Tris-NH4Cl,室温静止5 min,再次离心,弃上清,PBS重悬,过滤后调整浓度,显微镜下计数。
1.3.6粒系-巨系细胞集落(CFU-GM)形成测定
将1.3.5节中制备的骨髓单核细胞悬液在无菌环境下,离心加入100μL培基,制成细胞悬液。于1 m L甲基纤维素培养基中加入10μL细胞悬液,分散均匀后,转移至24孔板,于37℃、φ=5%CO2、培养箱中培养14 d后,显微镜下计数,超过50个细胞的细胞簇为一个集落。
1.3.7小鼠骨髓细胞中CD34+细胞比例变化分析
将1.3.5节中制备的骨髓单核细胞悬液调整浓度至2×106~5×106个/m L,离心去上清,加入CD34抗体10μL。4℃孵育30 min后,用PBS清洗一遍,抗体保存液固定,采用流式细胞仪检测。
1.3.8小鼠脾脏和股骨组织形态学观察 实验取出小鼠双侧股骨,用甲醛(w=10%)固定,脱钙,浸蜡包埋;脾脏,迅速用甲醛固定,浸蜡包埋,矢装面切片(3 μm),HE染色,观察骨髓细胞的变化。
2 统计学分析
应用Origin 8.0进行数据处理,两组间比较采用卡方检验,检测数据以均数±标准差(±s)表示,组间比较采用t检验。
3 实验结果
3.1rhBMP-2对再障小鼠体重、存活率和外周血WBC的影响
表1示出了各实验组造模后的体重、存活率、WBC变化情况。由表1可看出,造模后1周内,各组均未给予rhBMP-2,此时B组和C组WBC、体重、存活率都显著低于A组,且B组与C组相比没有显著差异,表明建模成功。B组从第2周干预rhBMP-2治疗后,WBC和体重都出现上升的趋势,至第4周时,B组WBC已恢复至正常组的50%左右,体重也达到正常的70%左右。相比较而言,C 组2~4周,体重并未增加,同时WBC不断下降,死亡率升高。至第4周时,B组的存活率接近C组的2倍。上述结果显示,rhBMP-2能够促进再障小鼠的WBC和体重的恢复,同时能提高小鼠的存活率。
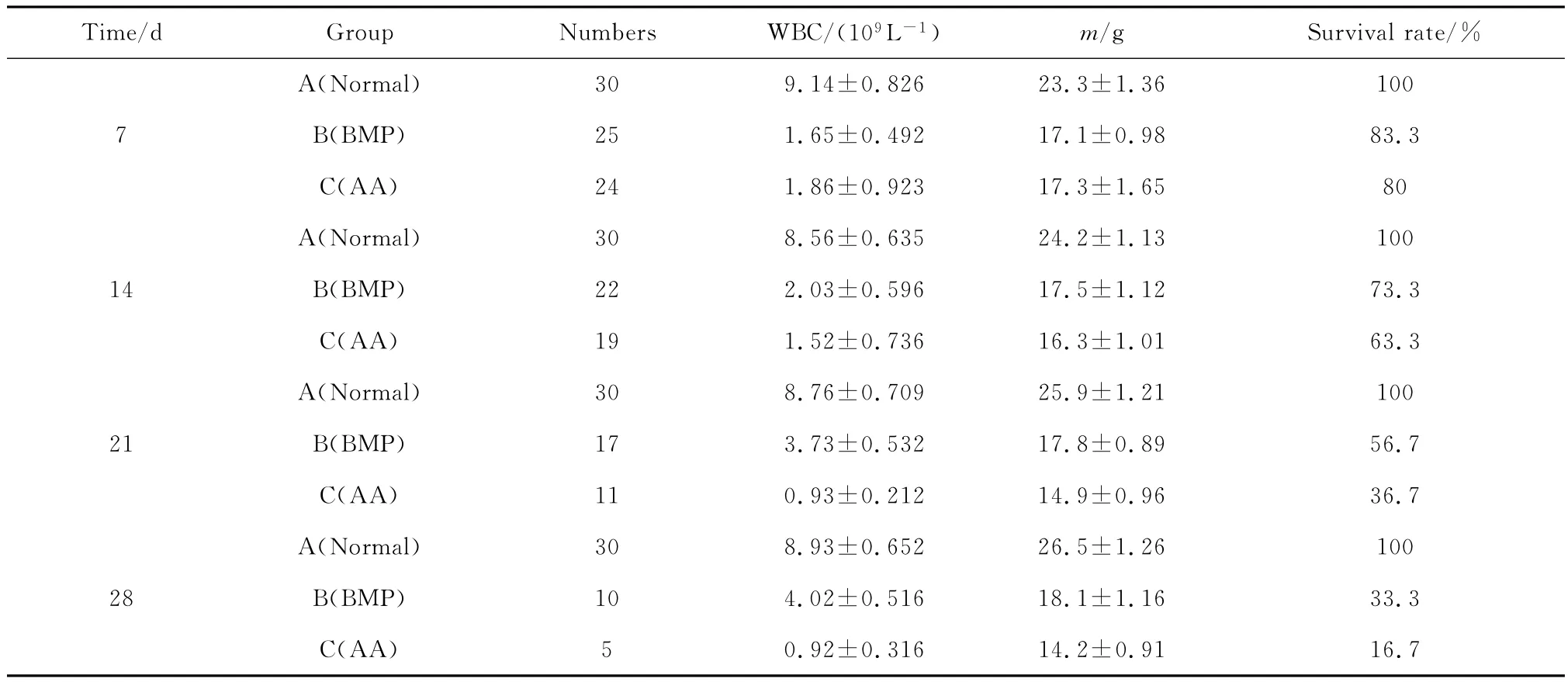
表1 各实验组造模后的体重、存活率和WBC变化Table 1 Weight,survival ratio and WBC change after modeling
3.2rhBMP-2对再障小鼠骨髓单核细胞数和CD34+细胞含量影响
造模4周各组小鼠骨髓单核细胞数如图1所示。由图1可以看出,C组小鼠的骨髓单核细胞数只有A组小鼠的20%左右,rhBMP-2干预治疗的B组已恢复到A组的50%左右,是C组的2倍左右,B和C两组间存在显著性差异(P<0.05)。同时,骨髓单核细胞中CD34+细胞的含量见图2。
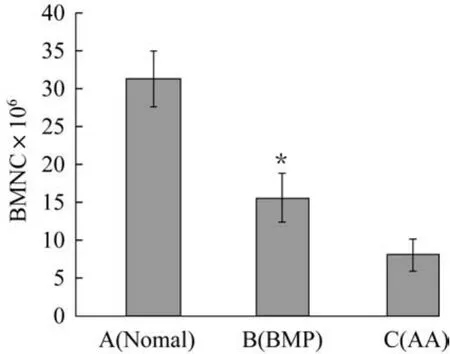
图1 造模4周各组小鼠骨髓单核细胞数(P<0.05)Fig.1 BMNC values on the fourth week after modeling(P<0.05)
造模4周后,C组中CD34+细胞数量只有A组的20%左右,而B组经rh BMP-2治疗后已恢复到A组的50%左右,是再障对照组的2.5倍,表明rhBMP-2不但能够促进再障小鼠的骨髓单核细胞数的提升,而且可以提高再障小鼠骨髓单核细胞中CD34+细胞的含量。

图2 造模4周各实验组的骨髓单核细胞中CD34+细胞含量(P<0.05)Fig.2 BMNCs CD34+ratio in each group on the fourth week after modeling(P<0.01)
3.3 rhBMP-2对再障小鼠骨髓CFU-GM形成的影响
造模4周骨髓CFU-GM集落计数如图3所示。由图3可以看出,注射rhBMP-2的B组小鼠骨髓细胞体外培养的CFU-GM集落数已恢复到A组的25%左右,而C组只有A组的14%左右,B组是C组的1.8倍,两者有明显差异(P<0.05)。同时图4示出了各组骨髓细胞体外培养CFU-GM的照片。可以看出正常组A组的集落形貌明显比B组和C组大,且细胞分散也比较集中。B组虽然比A组小,但是细胞分布仍比较集中。而C组的集落不仅小,细胞也较为分散。CFU-GM集落的数量和形貌反应了机体造血干/祖细胞的增殖分化能力。综合图3和图4表明,rhBMP-2能够促进造血干/祖细胞数量的提高和功能的恢复,促进再障小鼠的骨髓造血功能的改善和重建。
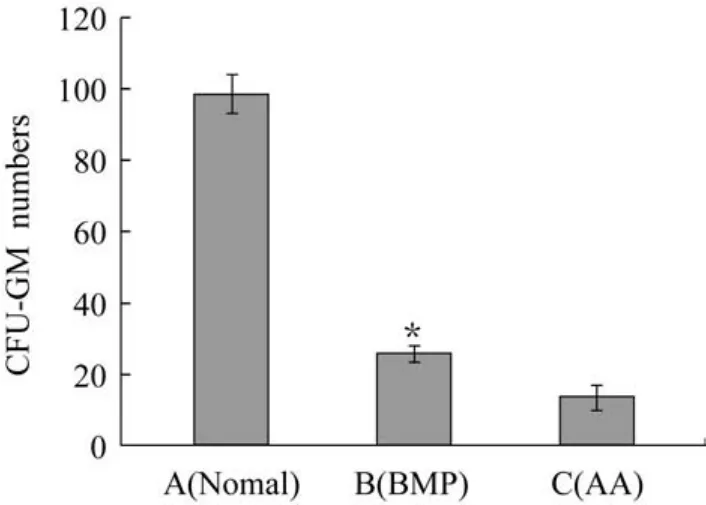
图3 造模4周骨髓CFU-GM集落计数(P<0.05)Fig.3 Number of CFU-GM BM on the fourth week after modeling(P<0.05)

图4 骨髓细胞体外培养CFU-GM的照片Fig.4 CFU-GM morphology of bone marrow cells
3.4rhBMP-2对再障小鼠脾系数的影响
各组小鼠造模4周脾系数变化如图5所示。B、C两组脾系数较A组均下降,B组为A组的53%,C组为A组的38%,表明小鼠脾脏出现损伤,处于萎缩状态。脾脏的萎缩直接影响小鼠的造血功能,同时还会导致小鼠的免疫力变差,容易感染,这与造模4周后小鼠的存活率变化情况一致。但同时可以发现,rhBMP-2治疗组的脾系数是再障对照组的1.4倍,两者有显著差别(P<0.05),说明rh BMP-2在一定程度上提高了再障小鼠的脾系数,促进改善脾脏功能恢复。
3.5组织形态学评价
造模4周后,小鼠股骨HE组织切片的染色结果见图6。图6(a)显示正常小鼠股骨HE染色,骨髓各系分布正常。当骨髓中出现大量脂肪泡时预示着骨髓受到抑制,功能在退化。图6(b)和(c)示出了B组和C组小鼠的骨髓生长都明显受到了抑制,骨髓的功能也在退化,但是B组脂肪泡明显少于C组,说明B组的骨髓抑制程度比C组轻。
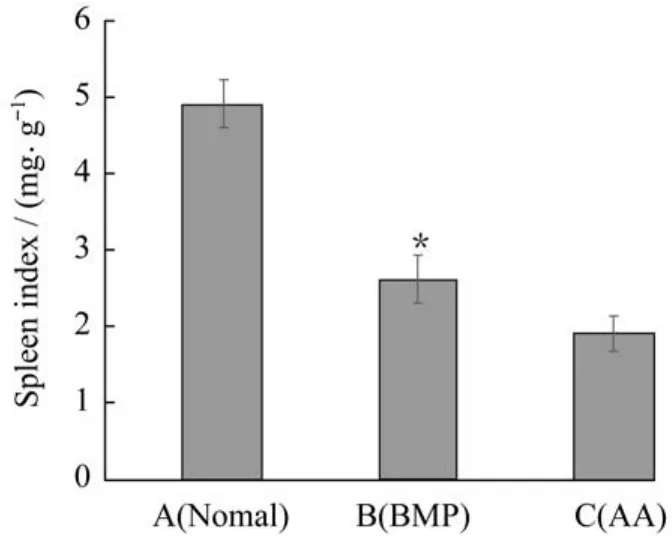
图5 造模4周脾系数值变化(P<0.05)Fig.5 Spleen coefficient values of each group on the fourth week after modeling(P<0.05)
图7示出了造模4周后各实验组小鼠的脾脏切片。图7(a)示出的是正常小鼠的脾脏HE切片,未见明显异常;图7(b)是注射rhBMP-2的小鼠的脾脏照片,从图中可以看出脾脏出现局灶性增生;图7 (c)是再障组的小鼠脾脏切片,可以看出脾脏不仅出现局灶性增生,而且脾脏淋巴组织还出现萎缩。脾脏是人体最大的周围淋巴样器官,由红髓和白髓两部分构成,发挥着造血和滤血的功能,更是重要的免疫应答、产生免疫效应分子的场所。

图6 小鼠股骨骨髓组织切片Fig.6 Femoral BM histological evaluation

图7 小鼠脾脏组织切片Fig.7 Spleen histological evaluation of each group
由组织切片检查结果可以发现,通过干预rhBMP-2治疗,能够缓解再障小鼠的骨髓抑制造血损伤和改善脾脏功能。
4 分析与讨论
距Ehrlich[8]1888年首次报道再障已有100多年的历史,目前的研究表明再障的发病机制涉及造血微环境异常、造血干/祖细胞缺陷和免疫功能紊乱[9],同时AA的发生、发展与T细胞功能亢进引起的造血组织损伤也密切相关[10]。目前对再障病因的研究主要集中在关于造血干细胞和造血微环境两方面[11]。
再障治疗一直是血液系统疾病中的难题。SAA的标准疗法为有移植治疗和联合免疫抑制治疗,首选与人类白细胞抗原(HLA)相合的同胞供体进行同种异体骨髓移植或造血干细胞移植。其中,造血干细胞移植仍是目前儿童和青年重型再生障碍性贫血的一线治疗选择,但存在供体来源有限、费用高等突出问题,且有约5%~15%的患者因为慢性移植物抗宿主病而影响疗效和生活质量。当SAA患者无合适供体或者自身不适合移植时主要采用联合抗人胸腺细胞免疫球蛋白(ATG/ALG)和环孢菌素A(Cs A)的免疫抑制治疗(IST)[1,12-13]。联合IST的强化治疗一方面能提高疗效,同时可减轻大剂量单一药物的毒副作用[12]。王方方等[14]研究了使用国产猪抗人淋巴细胞免疫球蛋白(p-ALG)联合Cs A治疗SAA的疗效,结果表明此方法作为初诊SAA的首次治疗方案,在治疗期间予以成分输血、干预细胞因子G-CSF、IL-11及抗感染等辅助支持治疗手段,疗效显著,且治疗费用较马或兔抗胸腺免疫球蛋白(ATG)联合Cs A的方案更为经济。此外,成分输血、干预雄性激素、细胞因子以及抗感染治疗等作为辅助支持治疗手段对再障的治疗也发挥着重要的作用,近年来在强化免疫抑制方案基础上加用造血细胞生长因子[HGFs,包括粒巨噬细胞集落刺激因子(GM-CSF)或粒细胞集落刺激因子(G-CSF)和红细胞生成素(EPO)]治疗SAA 28例,有效率达到85.7%[15]。可见目前的治疗方案以强化免疫并辅以细胞因子或其他手段的联合作用为主。但临床研究表明,大多数集落细胞因子使用后伴随发热、恶心、低血压、水肿、胸痛、骨痛等不良反应。目前尚未研发出安全有效并可长期应用于治疗再障的细胞生长因子[16]。
BMP-2作为TGF-β超家族成员,其在成骨领域的应用已经相当成熟。近年来研究表明BMP对造血的发生和调控也有重要作用[17],但鲜有将其用于再生障碍型贫血治疗的报道。因此,本文对rhBMP-2在再障造血损伤修复中的作用进行了探究。通过5-FU联合白消安用药建立小鼠再障造血损伤模型。治疗组在建模1周后连续2周腹腔注射rh BMP-2,剂量为50μg/d。本文研究对比了rhBMP-2治疗组和再障对照组在造血表征相关指标方面的差异和变化。结果表明,治疗4周后,rhBMP-2治疗组WBC相比再障对照组提高了3倍,存活率提高了2倍,同时治疗组骨髓单核细胞数是再障对照组的2倍,CD34+含量是对照组的2.5倍;集落培养的结果也显示rhBMP-2治疗组的CFU-GM集落计数结果是对照组的1.8倍,而且集落形态更好;4周后,rhBMP-2治疗组的脾系数是对照组的1.4倍,而且从脾脏的HE染色切片上可以观察到rh BMP-2治疗组的脾脏功能好于再障组。上述结果一致性地显示,通过干预rhBMP-2治疗,能够有效地降低再障小鼠的骨髓抑制程度,同时促进各项造血功能的恢复,具有促进再障造血损伤的修复作用,因而使得小鼠的存活率提高。尽管本文结果显示,采用rhBMP-2治疗的结果与正常水平仍存在差异,但在再障的治疗方案中,仍可作为一种辅助的治疗手段,发挥积极的作用。下一步的工作将更细致地研究BMP-2的不同剂量、给药方式等对于再障模型的治疗效果,以及与其他治疗手段的辅助作用。
[1] 中华医学会血液学分会红细胞疾病(贫血)学组.再生障碍性贫血诊断治疗专家共识[J].中华血液杂志,2010,31(11):790-792.
[2] 张之南,郝玉书,赵永强,等.血液病学[M].北京:人民卫生出版社,2011:933-938.
[3] LIN Chunyu,CHANG Yuhan,LIN Kunju,et al.The healing of critical-sized femoral segmental bone defects in rabbits using baculovirus-engineered mesenchymal stem cells[J]. Biomaterials,2010,31(12):3222-3230.
[4] 刘水冰,胡沛臻,侯颖,等.重组人骨形成蛋白-2在造血损伤治疗中作用机制的探讨[J].中华放射医学与防护杂志,2009,29(2):139-142.
[5] 田琼,张绍章,蒲勤.重组人骨形成蛋白-2成熟肽对小鼠辐射损伤的治疗作用及其机理的探讨[J].中华放射医学与防护杂志,1998,18(4):253-258.
[6] 田琼,张绍章,蒲勤,等.骨形成蛋白对小鼠造血型急性放射损伤治疗作用的研究[J].辐射研究与辐射工艺学报,2001,19 (3):199-204.
[7] 赵玮钦.重组人骨形成蛋白复性探讨及重组人骨形成蛋白-4二连体对辐射损伤小鼠造血系统的作用[D].西安:第四军医大学,2006.
[8] EHRLICH P.Ueber einem fall von anamie mit bemerkungen ober regenerative veranderungen des knochenmaers[J]. Charite-Annalen,1888,13:300-309.
[9] BRODSKY R A,JONES R J.Aplastic anemia[J].The Lancet,2005,365(9471):1647-1656.
[10] YOUNG N S,CALADO R T,SCHEINBERG P.Current concepts in the pathophysiology and treatment of aplastic anemia[J].Blood,2006,108(8):2509-2519.
[11] HAMERSCLAK N,MALUF E,PASQUINI R,et al. Incidence of aplastic anemia and agranulocytosis in Latin America:the LATIN study[J].Sao Paulo Medical Journal,2005,123(3):101-104.
[12] 何广胜,张翔,方宝枝.强化免疫抑制治疗重型再生障碍性贫血——还能再进一步吗?[J].内科理论与实践,2010,5(4):286-290.
[13] LOCASCIULLI A,BRYNO B,RAMBALDI A,et al. Treatment of severe aplastic anemia with antilymphocyte globulin,cyclosporine and two different granulocyte colonystimulating factor regiments:A GITMO prospective randomized study[J].Haematological,2004,89(9):1054-1061.
[14] 王方方,孙爱红,管俊.猪抗人淋巴细胞免疫球蛋白联合环孢菌素A治疗重型再障的临床疗效[J].成都医学院学报,2014,9(4):467-469.
[15] 储榆林.再生障碍性贫血的药物治疗[J].中华血液学杂志,1999,4(13):1-6.
[16] 谢晓恬.2009年版英国再生障碍性贫血诊断与治疗指南要点归纳[J].中华实用儿科临床杂志,2014,29(3):161-164.
[17] MAENO M,MEAD P,KELLEY C,et al.The role of BMP-4 and GATA-2 in the induction and differentiation of hematopoietic mesoderm in Xenopus laevis[J].Blood,1996,88(6):1965-1972.
Promoting Effects of rhBMP-2 on Aplastic Anemia Mice Bone Marrow Hematopoietic Recovery
GAO Qiao-yan, WANG Jing, XING Wan-li, DAI Kai, LIU Chang-sheng
(Engineering Research Center of Medical Biomaterials,Ministry of Education,School of Materials Science and Engineering,East China University of Science and Technology,Shanghai,200237,China)
Aiming to explore the promoting effects of rh BMP-2 on aplastic anemia mice bone marrow hematopoietic recovery,we built the hematopoietic injury model by 5-FU and busulfan with the interventional treatment of rhBMP-2.We analysed the number of mice peripheral white blood cells,bone marrow mononuclear cells,BM CD34+cells,weight index,survival rate,spleen coefficient,CFU-GM colony as well as the HE sections of femur and spleen tissue.The results showed that rh BMP-2 can improve the index of peripheral white blood cell amount,mice survival rates,CFU-GM colony number,the bone marrow mononuclear cells number and CD34+cells ratio;rh BMP-2 can also improve the function of the spleen and reduce bone marrow suppression compared with the AA control group.All results above confirmed that rh BMP-2 can effectively promote the restoration of hematopoietic injury in aplastic anemia mice.
human bone morphogenetic protein-2(rhBMP-2);aplastic anemia;hematopoietic damage repair
R318.08
A
1006-3080(2016)01-0042-06 DOI:10.14135/j.cnki.1006-3080.2016.01.007
2015-05-14
纳米研究重大科学研究计划(2012CB933600)
高巧艳(1989-),女,陕西延安人,硕士生,主要从事rhBMP-2与造血相关的研究。E-mail:roxygao@163.com
刘昌胜,E-mail:liucs@ecust.edu.cn
