桉树根际土壤解磷细菌的分离、筛选及其解磷效果
2016-10-26俞新玲林勇明吴承祯谢安强
徐 欢, 俞新玲, 林勇明, 吴承祯,3, 谢安强, 陈 灿, 李 键, 洪 滔
(1.福建农林大学林学院,福建 福州 350002;2.福建省高校森林生态系统经营与过程重点实验室,福建 福州 350002;3.武夷学院生态与资源工程学院,福建 南平 354300)
桉树根际土壤解磷细菌的分离、筛选及其解磷效果
徐欢1,2, 俞新玲1,2, 林勇明1,2, 吴承祯1,2,3, 谢安强1,2, 陈灿1,2, 李键1,2, 洪滔1,2
(1.福建农林大学林学院,福建 福州 350002;2.福建省高校森林生态系统经营与过程重点实验室,福建 福州 350002;3.武夷学院生态与资源工程学院,福建 南平 354300)
采用选择性培养基对柳桉、邓恩桉和尾巨桉3种桉树林地根际土壤解磷细菌进行分离和筛选,并对其解磷能力进行测定.结果表明:(1)3种林分根际土壤中均存在大量的解磷细菌,其中的解有机磷细菌数量为(2.23~4.17)×104cfu·g-1,溶无机磷细菌数量为(2.05~4.00)×104cfu·g-1,解有机磷细菌数量多于溶无机磷细菌数量.不同林分根际土壤解磷细菌数量分布有差异,其数量大小为:柳桉>尾巨桉>邓恩桉.(2)筛选到12株溶无机磷细菌和14株解有机磷细菌,且不同解磷细菌的解磷能力存在显著差异(P<0.05).12株溶无机磷细菌在无机磷培养液中的有效磷含量为55.854~367.169 μg·mL-1,最大为P7菌株;14株解有机磷细菌在有机磷培养液中的有效磷含量为11.374~30.330 μg·mL-1,最大为YP菌株.溶无机磷细菌溶解的无机磷含量与蒙金娜无机磷培养基的pH之间存在极显著负相关性(P<0.01),解有机磷细菌分解的有机磷含量与卵黄培养基的pH之间无显著相关性(P>0.05).综上所述,26株解磷细菌中,P7菌株溶解无机磷的能力最强,YP8菌株分解有机磷的能力最强,这两个菌株可作为下一步研制桉树微生物肥料的重点菌种.
桉树; 解磷细菌; 溶磷能力; 有效磷
磷元素是植物生长过程中必需的三大营养元素之一,其含量的高低与植物的生长发育和新陈代谢密切相关.然而,我国75%的耕地土壤缺磷,且土壤中95%的磷以无效磷的形式存在,不能直接被植物吸收利用[1].在农业生产上往往采用施加大量磷肥来补给土壤中磷元素的缺失,但磷肥极易与土壤中的Ca2+、Al3+、Fe2+和Fe3+螯合形成难溶性磷酸盐,无法被植物吸收利用,且化肥的过度使用会破坏土壤结构,污染环境[2-3].可见,研究土壤中被固定的无效态磷的分解和释放,对于提高土壤中的可溶性磷含量、调节土壤肥力及科学合理施肥具有重要意义.
植物根际土壤中存在大量具有不同解磷能力的微生物,这类微生物可以通过自身代谢产物或与其他生物协同溶解土壤中的难溶性无机磷,增加土壤中的有效磷含量,从而提高土壤磷含量[4-5].Sperber[6]发现,植物根际土壤的解磷细菌不仅可提高根际土壤的磷含量,对植物根系的生理代谢过程也有促进作用;Zhao et al[7]从杨树根际土壤中分离出大量的溶磷菌株,发现DZ-18菌株的解磷效果最好;马文文等[8]从7种禾草根际土壤中分离筛选得到2株具有高效解磷能力的菌株PCRP5和MCMRS4;王浩等[9]从豆科植物根际土壤中分离得到47株对溶液中磷酸三钙均有很好溶解效果的溶磷菌;Hussain et al[10]从玉米根际土壤中分离筛选的PS-01菌株不仅有较强的解磷能力,还对玉米的生长具有促进作用.以上研究表明,从植物根际土壤中筛选得到具有高效解磷能力的菌株可缓解土壤磷素缺乏的问题.但目前我国学者关于植物根际解磷细菌的研究主要针对农田和草地两种生态系统,而对人工林生态系统植物解磷细菌的研究较少.
桉树自引进中国以来,种植规模不断扩大,因其速生、高产及短期可采伐的优点,现已成为我国南方人工林造林的主要建树树种之一[11].桉树的速生特性对土壤中的磷元素消耗大,长期种植桉树后林地的土壤肥力严重衰退,导致产量下降[12-13].为解决这一问题,开展桉树根际土壤解磷微生物的分离和筛选工作势在必行.因此,本试验以邓恩桉(Eucalyptusdunnii)、柳桉(E.saligna)和尾巨桉(E.urophglla×E.grandis)3种桉树林地为研究对象,研究桉树根际土壤解磷微生物的解磷能力,以期筛选出优良的解磷菌株,为提高桉树人工林的产量及研制微生物复合肥提供理论依据.
1 材料与方法
1.1材料
1.1.1研究区概况研究区位于福建省永安国有林场(N25°56′27″、E117°23′18″).该林场属典型的亚热带季风山地气候,年平均气温19.1 ℃,平均降雨量1 688 mm.林地土壤质地以红壤为主,其次为黄壤.林场种植大面积的人工植被,如杉木(Cunninghamialanceolata)、毛竹(Phyllostachysedulis)、尾巨桉和马尾松(PinusmassomianaLamb.)等.
1.1.2土样采集采集永安国有林场柳桉、尾巨桉和邓恩桉3种桉树林地的根际土壤,试验区林地的基本特征如表1所示.采取5点取样法对3块标准地采样,去除表土,取10~20 cm深度的根际土壤500 g,装袋并记录采集地点、日期和土样号,取回实验室置冰箱(4 ℃)中保存.

表1 试验区林地的基本特征Table 1 Basic characteristics of experiment sites
1.1.3培养基采用蒙金娜无机磷培养基分离溶无机磷细菌,采用卵黄培养基分离解有机磷细菌,采用牛肉膏蛋白胨培养基保存和活化菌株.各培养基组成和配方见文献[14-16].
1.2解磷细菌的分离与纯化
准确称取5 g土壤样品到装有95 mL无菌水的250 mL三角瓶中,于25 ℃摇床振荡30 min,静置20~30 s,取上清液按十倍稀释法制成10-4、10-5、10-6一系列稀释菌液.各取3种稀释浓度样品0.1 mL涂布于卵黄平板培养基和蒙金娜无机磷平板培养基上,每个浓度重复3次.解有机磷细菌于28 ℃的恒温培养箱中培养3 d,溶无机磷细菌培养7 d,同时记录具有透明圈的菌落个数.培养结束后,用接种环挑取有明显透明圈的菌落,采用划线法纯化5次以上,将纯化后的单菌落转至斜面培养基上,保存于冰箱(4 ℃)中备用.
1.3解磷能力的测定
1.3.1定性分析将分离纯化后的菌株分别点植于蒙金娜无机磷培养基和卵黄培养基上,置于培养箱(28 ℃)中,溶无机磷细菌培养7 d,解有机磷细菌培养2 d,观察并测定溶磷圈直径(D)、菌落直径(d),计算D与d的比值.
1.3.2定量分析分别在150 mL三角瓶中加入蒙金娜无机磷液体培养基和卵黄液体培养基,每瓶30 mL,高温灭菌20 min(121 ℃、1.01 Pa)后备用.提取已在牛肉膏蛋白胨培养基上活化24 h的菌液,在蒙金娜无机磷液体培养基和卵黄液体培养基中各加1 mL,以加1 mL无菌水为对照,每个处理重复3次,摇床培养(28 ℃、160 r·min-1)5 d.培养完毕后,发酵液于4 ℃、10 000 r·min-1离心20 min,取上清液定容至50 mL,于37 ℃水浴1 h,再于4 ℃、10 000 r·min-1离心20 min,取上清液定容至50 mL,采用钼锑抗比色法[9]测定两次离心后上清液的磷含量.第1次上清液的测定结果表示培养液中的有效磷含量,第2次上清液的测定结果表示菌体所吸收的磷含量.培养基的pH用酸度计测定.
1.4数据分析
试验数据以平均值±标准差表示,采用Excel和SPSS 19.0软件对数据进行处理,利用邓肯氏新复极差法进行方差分析,菌株溶磷能力与pH之间的相关性采用Pearson软件分析.
2 结果与分析
2.1不同桉树根际土壤解磷细菌的数量
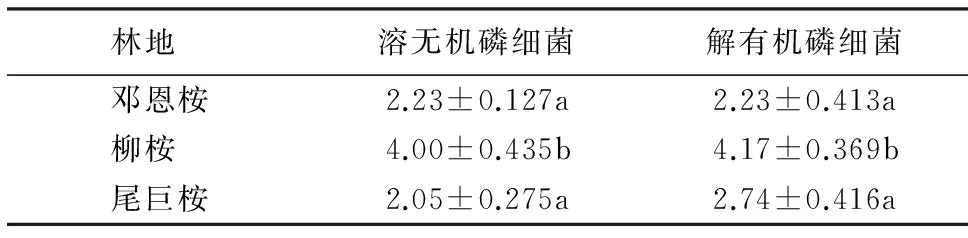
表2 不同桉树根际土壤解磷细菌的数量1)Table 2 Quantity of phosphate solubilizing bacteria in different Eucalyptus forest soil 104 cfu·g-1
1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
邓恩桉、柳桉和尾巨桉3种林分类型的根际土壤中均存在大量解有机磷细菌和溶无机磷细菌,以柳桉林磷细菌的总量最多,其他依次为尾巨桉林和邓恩桉林,柳桉林的溶无机磷细菌和解有机磷细菌数量均与其他两种林型存在显著差异(表2).在3种林分类型的根际土壤中,除邓恩桉林解有机磷细菌的数量大致与溶无机磷细菌数量相等外,其他两种林型均为解有机磷细菌数量大于溶无机磷细菌数量.
2.2固体培养基上解磷细菌的解磷能力
D/d可作为初步判断解磷细菌相对解磷能力的一个指标.根据D/d的大小,从蒙金娜无机磷平板培养基和卵黄平板培养基上各筛选出D/d大于1.0的溶无机磷细菌和解有机磷细菌各30株,并进行编号,溶无机磷细菌编号为P1~P30,解有机磷细菌编号为YP1~YP30.结果(表3)表明:30株溶无机磷细菌的解磷能力存在显著差异(P<0.05).解磷能力较强的(D/d>2)有7株,占总数的20.33%;解磷能力强的(2.0 2.3液体培养基上解磷细菌的解磷能力 对初步筛选获得的60株解磷细菌进行液体培养,部分解磷细菌在多次纯化和复筛过程中失去了解磷能力,最终筛选得到26株解磷能力稳定的菌株,其中,溶无机磷细菌12株,解有机磷细菌14株. 2.3.1溶解无机磷的能力表4表明,12株溶无机磷细菌在液体摇瓶中均表现出较强的解磷能力.从菌体自身所吸收的磷含量来看,在12株溶无机磷细菌中,P7菌株在培养液中吸收的可溶性磷含量最大,达29.162 μg·mL-1;其次是P5、P26和P28菌株,分别为17.887、17.572和10.252 μg·mL-1;其余菌株自身吸收的磷含量均在10.00 μg·mL-1以下. 从菌株溶解有效磷的含量来看,所有接种处理培养液中的有效磷含量均高于CK,表明各菌株对磷酸三钙均有一定的溶解作用.12株溶无机磷细菌接种处理培养液中的有效磷含量为55.854~367.169 μg·mL-1,增幅是CK的10.190~66.989倍,各菌株间溶磷效果的差异极显著(P<0.01).其中,P7菌株的解磷能力最强,该菌株接种处理的培养液中有效磷含量达367.169 μg·mL-1,其次是P8和P19菌株,分别为265.397 和235.614 μg·mL-1,这3个菌株在固体培养基上也表现出较强的解磷能力.而在固体培养基上有较高D/d的P29和P30菌株在液体培养基中的解磷能力仅分别为77.145和55.854 μg·mL-1. 表3 解磷细菌在固体培养基上的解磷能力1)Table 3 Capacities of different phoshporus-solubilizing bacteria cultivated on solid nutrient medium 1)同列数据后附不同小写字母者表示差异显著(P<0.05). 表4 溶无机磷细菌在液体培养基上的溶磷能力1)Table 4 Capacities of different inorganic phoshporus-solubilizing bacteria cultivated in liquid medium 1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05). 相对于未接种的培养液(pH 6.73),12株溶无机磷细菌接种处理的培养液pH均有不同程度的下降,各处理液的pH为4.26~5.03,降幅为1.70~2.47.其中,P7菌株接种处理的培养液pH最低,为4.26,但该菌株的溶磷量最高;P29和P30菌株接种处理的培养液pH分别为5.03和4.98,两个菌株的溶磷量较低.利用相关性回归方程进一步分析菌株溶磷量与pH的相关性发现,12株溶无机磷细菌的溶磷量与pH之间存在极显著相关性(P<0.01),线性回归方程为:y=-277.650x+1 445.900,R2=0.647 4. 2.3.2分解有机磷的能力表5表明,14株解有机磷细菌在液体摇瓶中也表现出一定的解磷能力.从菌体自身吸收的磷含量来看,在14株解有机磷细菌中,只有5株自身吸收的磷含量超过1.00 μg·mL-1,其中,YP25菌株最高,达1.398 μg·mL-1,其余菌株自身吸收的磷含量均在1.00 μg·mL-1以下,各菌株吸收的磷含量之间存在极显著差异(P<0.01). 从菌株分解有效磷的含量来看,14株解有机磷细菌虽也表现出一定的解磷能力,但其解磷能力远不及溶无机磷细菌.12株解有机磷细菌接种处理的培养液中有效磷含量为11.374~30.330 μg·mL-1,增幅是CK的2.130~5.680倍,各菌株间的解磷能力差异极显著(P<0.01).其中,YP8菌株的解磷能力最强,与其他菌株的差异达到显著水平(P<0.05),而YP24菌株的解磷能力最弱.结合平板培养基试验结果,YP8菌株在两种不同的培养方式中均表现出很好的解磷能力. 表5 解有机磷细菌在液体培养基上的解磷能力1)Table 5 Capacities of different organic phoshporus-solubilizing bacteria cultivated in liquid medium 1)同列数据后附不同小写字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05). 14株解有机磷细菌接种处理的培养液pH为7.92~8.25,与未接种的培养液pH无明显差异.利用相关性回归方程进一步分析菌株溶磷量与pH的相关性发现,14株解有机磷细菌的解磷量与pH之间无显著相关性(P>0.05),线性回归方程为:y=-27.325x+238.980,R2=0.242 1. 本试验通过溶磷圈法和钼锑抗比色法对3种桉树林根际土壤解磷细菌进行筛选,并对其解磷能力进行测定,得到26株具有稳定解磷能力的菌株,但各菌株对磷酸三钙和卵磷脂的溶解能力差异较大.12株溶无机磷细菌溶解磷酸三钙的量为55.854~367.169 μg·mL-1,解磷能力最强的是P7菌株;14株解有机磷细菌分解卵磷脂的量为11.374~30.330 μg·mL-1,解磷能力最强的是YP8菌株.P7和YP8菌株可作为研制微生物肥料的重点菌株.溶无机磷细菌溶解的无机磷含量与培养液pH之间存在显著负相关性,解有机磷细菌分解的有机磷含量与培养液pH之间无显著相关性.目前只是初步探讨P7和YP8菌株的解磷效果和解磷机制,以后有望进一步开展两个菌株对桉树的长期接种效应及其促生机制的研究. 植物根际土壤解磷微生物不仅可将土壤中的难溶性磷转化为可溶性磷以供植物吸收利用,还可通过分泌生长调节物质和提高植物对其他营养元素的吸收利用能力等方面促进植物生长.植物根际土壤解磷微生物的数量与植物所处区域的植被类型、水热状况和土壤肥力密切相关[8].就植被类型对植物根际土壤解磷微生物的影响而言,有研究发现植物根系可向生长环境中分泌有机物以供磷细菌生长,根系分泌物数量会直接影响磷细菌的数量.由于不同类型植物的根系分泌物数量不同,导致不同植被类型其根际土壤微生物数量的差异[17].臧威等[18]研究大豆、玉米、小麦和水稻4种农作物根际土壤磷细菌数量发现,玉米根际土壤磷细菌数量最多,水稻最少,但各作物根际土壤磷细菌数量分布差异未达到显著水平(P>0.05).本试验结果表明,3种桉树林地根际土壤中均存在大量的磷细菌,磷细菌数量分布大小为:柳桉>尾巨桉>邓恩桉,这与臧威等的研究结果[18]相似.产生这种差异的原因可能是由于不同品种桉树的根系分泌物数量存在差异所致.3种桉树林地根际土壤中磷细菌的数量、分布均为解有机磷细菌多于溶无机磷细菌,这可能是由于林地土壤有较厚的枯枝落叶层,丰富的有机物为解有机磷细菌的生长提供更有利的营养环境. 目前,测定解磷细菌的解磷能力一般是通过测量固体培养基上菌落周围溶磷圈的大小来判断菌株解磷能力的强弱,但许多研究表明,溶磷圈大小与菌株解磷能力呈弱相关关系[19].部分解磷细菌在固体培养基上无溶磷圈产生,但经过液体培养,也能表现出一定的解磷能力.因此,固体培养基上解磷细菌溶磷圈的大小以及D/d只能定性地反应菌株的解磷能力,要精确地了解解磷细菌解磷能力的强弱,需采用液体培养法对菌株的解磷能力进行定量分析.本试验中,12株溶无机磷细菌和14株解有机磷细菌在固体培养基上测定的D/d与液体培养上测定的解磷能力不成正比,即在固体培养基上D/d较小的菌株,在液体培养阶段却有较强的解磷能力,而在固体培养基上有较大D/d的菌株,在液体培养阶段解磷能力减弱,溶液中有效磷含量也显著低于其他菌株,这与前人对玉米[20]和马尾松[21]解磷能力的研究结果相似.产生这种结果的原因,一方面可能是由于在配置平板培养基的过程中无法保证每个培养皿中含有相同体积的磷酸三钙或卵磷脂,因此各菌株所分解磷酸三钙或卵磷脂的量不同,导致各菌株在固体平板培养基上产生的溶磷圈大小也不一样[22];另一方面可能是由两种培养方式所致,部分解磷细菌在液体培养方式下的生长繁殖速度比固体培养方式更快,菌株在液体培养方式的解磷能力也更强[20]. 解磷细菌在多次纯化的过程中,部分菌株的解磷能力随着纯化次数的增加而呈下降趋势,甚至消失.Kucey[23]发现解磷细菌在纯化的过程中有50%的菌株失去解磷能力;柯春亮等[24]筛选的8株溶无机磷细菌在纯化后,仅3株仍表现出稳定的解磷能力.研究表明,解磷细菌解磷能力的发挥受土壤中其他大量微生物(如固氮菌)的影响,这种影响表现为解磷细菌与其他微生物的协同作用[25].如磷细菌与固氮菌同时存在时,磷细菌通过提高土壤中的磷含量为固氮菌的生长繁殖提供磷源,固氮菌可通过自身分泌生理活性物质加速解磷细菌芽孢的萌发速度[26].本试验中,60株解磷细菌在纯化后,仅12株溶无机磷细菌和14株解有机磷细菌仍具有一定的解磷能力,与Kucey[23]和柯春亮等[24]的研究结果一致.产生这种现象的原因可能是,部分菌株通过与其他菌株形成类似共生的关系来表现出一定的解磷能力,而菌株之间这种相互促进的关系在纯化的过程中逐渐消失,从而导致部分菌株的解磷能力下降甚至丧失. 解磷细菌在生长繁殖的过程中,不仅能分解环境中的难溶性磷,而且可将分解出来的磷同化后贮存在自身细胞中.赵小蓉等[27]研究发现,菌株本身会吸收培养液中溶解的磷用于自身的生长繁殖,忽视菌体吸收利用的有效磷含量,会低估某些菌株的实际解磷能力.陈阳等[28]利用溶菌酶对26株解磷芽孢杆菌的细胞进行破碎后发现培养液中的有效磷含量增加,表明各菌株在分解溶液中磷酸三钙的同时,自身也吸收同化部分溶液中分解的磷.因此,不能因为解磷细菌在液体培养基上测定的有效磷增量为负值而认为该菌株没有解磷能力,应该考虑菌体自身对分解的磷吸收同化的量,这样才能对菌株的解磷能力做出更准确的判断.本试验中,26株解磷细菌在液体培养过程中均吸收部分溶液中分解的磷贮存于菌体细胞中,这表明各菌株实际溶解磷酸三钙和卵磷脂的量多于溶液中测得的有效磷含量,这一结果证实了赵小蓉等[27]的结论.但不同菌株自身吸收同化的磷含量存在差异,出现这种差异的原因可能是由于不同菌株自身生长繁殖对养分需求不同. 关于溶磷量与培养介质pH之间的关系,李蓉等[29]研究表明两者并没有显著的相关性,而乔志伟等[30]研究证明两者存在极显著负相关性,即培养介质的pH越低,培养液中的溶磷量越大,表明培养介质的酸度对溶磷量有很大影响.本试验结果表明,蒙金娜无机磷培养基的pH与溶无机磷细菌培养液中有效磷含量之间呈极显著负相关,卵黄培养基的pH与解有机磷细菌培养液中有效磷含量无显著相关性.这可能与不同类型解磷细菌的溶磷机制不同有关:溶无机磷细菌通过在生长过程中分泌出有机酸,或与NH4+同化作用释放H+,产生的酸既能溶解培养液中的难溶性磷,又能降低培养介质的pH[31];而解有机磷细菌是通过分泌胞外磷酸酶等非有机酸类物质来分解有机磷脂,释放有机磷,其代谢产物对培养液的pH无显著影响[29]. [1] 魏伟,吴小芹,乔欢.马尾松根际高效解磷真菌的筛选鉴定及其促生效应[J].林业科学,2014,50(9):82-88. [2] BHATTACHARYYA P N, JHA D K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture [J]. World Journal of Microbiol and Biotechnology, 2012,28(4):1 327-1 350. [4] 崔邢,张亮,林勇明,等.不同土壤条件下解磷菌处理对巨尾桉土壤有效磷含量的影响[J].应用与环境生物学报,2015,21(4):740-746. [5] AHEMAD M, KIBRET M. Mechanisms and applications of plant growth promoting rhizobacteria: Current perspective [J]. Journal of King Saud University-Science, 2014,26(1):1-20. [6] SPERBER J I. The incidence of apatite-solubilizing organisms in the rhizosphere and soil [J]. Crop and Pasture Science, 1958,9(6):778-781. [7] ZHAO L, WU X Q, YE J R, et al. Isolation and characterization of a mycorrhiza helper bacterium from rhizosphere soils of poplar stands [J]. Biology and Fertility of Soils, 2014,50(4):593-601. [8] 马文文,姚拓,蒲小鹏,等.东祁连山7种禾草根际溶磷菌筛选及其溶磷特性[J].草业科学,2015,32(4):515-523. [9] 王浩,姜妍,刘伟,等.大豆根际高效溶磷菌株的分离及溶磷能力分析[J].大豆科学,2014,33(3):404-407. [10] HUSSAIN M I, ASGHAR H N, AKHTAR M J, et al. Impact of phosphate solubilizing bacteria on growth and yield of maize [J]. Soil & Environment, 2013,32(1):71-78. [11] 杨尚东,吴俊,谭宏伟,等.红壤区桉树人工林炼山后土壤肥力变化及其生态评价[J].生态学报,2013,33(24):7 788-7 797. [12] 谭宏伟,杨尚东,吴俊,等.红壤区桉树人工林与不同林分土壤微生物活性及细菌多样性的比较[J].土壤学报,2014,51(3):575-584. [13] 王劲松,吕成群,覃林海,等.两个桉树无性系接种固氮菌造林试验效果初探[J].中南林业科技大学学报(自然科学版),2010,30(12):50-55. [14] 潘虹,曹翠玲,林雁冰,等.石灰性土壤解磷细菌的鉴定及其对土壤无机磷形态的影响[J].西北农林科技大学学报(自然科学版),2015,43(10):114-122. [15] 朱培淼,杨兴明,徐阳春,等.高效溶磷细菌的筛选及其对玉米苗期生长的促进作用[J].应用生态学报,2007,18(1):107-112. [16] 刘聪,林维,孙珑,等.黑土区林地土壤高效解磷细菌的分离、筛选及其解磷效果[J].东北林业大学学报,2013,41(11):83-85. [17] 于翠,吕德国,秦嗣军,等.甜樱桃砧木根际和非根际解磷细菌研究初报[J].沈阳农业大学学报,2006,37(5):769-771. [18] 臧威,孙剑秋,王鹏,等.东北地区四种农作物根际磷细菌的分布[J].中国生态农业学报,2009,17(6):1 206-1 210. [19] 叶震,陈秀蓉,杨淑君.东祁连山高寒植被土壤解磷菌筛选及其解磷能力的初步研究[J].草原与草坪,2010 30(5):6-10. [20] 白文娟,胡蓉蓉,章家恩,等.玉米根际溶磷细菌的分离、筛选及溶磷能力研究[J].华南农业大学学报,2013,34(2):167-176. [21] 黄鹏飞,刘君昂,靳爱仙,等.马尾松根际土壤溶磷菌分离筛选、鉴定及其溶磷效果研究[J].中国农学通报,2012,28(19):12-16. [22] CHEN Y P, REKHA P D, ARUN A B, et al. Phosphate solubilizing bacteria from subtropical soil and their tricalcium phosphate solubilizing abilities [J]. Applied Soil Ecology, 2006,34(1):33-41. [23] KUCEY R M N. Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils [J]. Canadian Journal of Soil Science, 1983,63(4):671-678. [24] 柯春亮,陈宇丰,周登博,等.香蕉根际土壤解磷细菌的筛选、鉴定及解磷能力[J].微生物学通报,2015,42(6):1 032-1 042. [25] 覃丽金,王真辉,陈秋波.根际解磷微生物研究进展[J].华南热带农业大学学报,2006,12(2):44-49. [26] 王富民,张彦,吴皓琼,等.解磷固氮菌剂的研制及其对小麦的增产效应[J].生物技术,1994,4(4):15-18. [27] 赵小蓉,孙焱鑫.细菌解磷能力测定方法的研究[J].微生物学通报,2001,28(1):1-4. [28] 陈阳,朱天辉,朴春根,等.解磷芽孢杆菌的筛选及其解磷能力的测定[J].贵州林业科技,2008,36(2):17-24. [29] 李蓉,周德明,吴毅,等.杉木根际溶磷菌筛选及其部分特性的初步研究[J].中南林业科技大学学报,2012,32(4):95-99. [30] 乔志伟,洪坚平,谢英荷,等.石灰性土壤拉恩式溶磷细菌的筛选鉴定及溶磷特性[J].应用生态学报,2013,24(8):2 294-2 300. [31] 贺梦醒,高毅,胡正雪,等.解磷菌株B25的筛选、 鉴定及其解磷能力[J].应用生态学报,2012,23(1):235-239. (责任编辑:施晓棠) Isolation, screening of phosphate solubilizing capacity of phosphate solubilizing bacteria inEucalyptusspecies XU Huan1,2, YU Xinling1,2, LIN Yongming1,2, WU Chengzhen1,2,3,XIE Anqiang1,2, CHEN Can1,2, LI Jian1,2, HONG Tao1,2 (1.College of Forestry, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2.Key Lab for Forest Ecosystem Processes and Management in Fujian Province, Fuzhou, Fujian 350002, China; 3.College of Ecology and Resources Engineering, Wuyi Universiy, Nanping, Fujian 354300, China) To develop microbial compound fertilizer forEucalyptusplantation, rhizosphere phosphorus (P) bacteria were separated and selected from the soil ofEucalyptussalignai,E.DunniiandE.urophglla×grandisby selective medium. Then strains with most stable solubilizing capacity were further screened. Results showed that there existed about 2.23×104~4.17×104cfu·g-1organic phosphate-solubilizing bacteria and 2.05×104~4.00×104cfu·g-1inorganic phosphate -solubilizing bacteria in 3 kinds of forest soils. The quantity of bacteria from different stands in a descending order wasEucalyptussaligna,E.urophglla×E.grandisandE.Dunnii. Phosphate solubilizing capacities varied significantly among 12 strains of organic phosphate-solubilizing bacteria and 14 strains of inorganic phosphate-solubilizing bacteria (P<0.05), with available P absorbed by inorganic phosphate-solubilizing bacteria ranging from 55.854 to 367.169g·mL-1, and available P dissolved by organic phosphate-solubilizing bacteria ranging from 11.374 to 30.330g·mL-1. There was significantly negative relationship between pH of culture solution and the content of inorganic P solubilized by inorganic phosphate-solubilizing bacteria, though pH was not correlated with the content of organic P dissolved by organic phosphate-solubilizing bacteria. Among 26 strains, strain P7 demonstrated the highest capacity in solubilizing inorganic P and strain YP8 was the most efficient in dissolving organic P, which were recommended as microbial fertilizer forEucalyptusspecies. Eucalyptus; phosphate solubilizing bacteria; phosphate solubilizing capacity; available phosphorous 2016-03-08 2016-04-18 福建省科技厅重大专项项目(2012NZ01);教育部博士点学科专项基金资助项目(20123515110011). 徐欢(1992-),女,硕士研究生.研究方向:森林生态.Email:a357766714@qq.com.通讯作者吴承祯(1970-),男,教授.研究方向:森林经营和森林生态.Email:fjwcz@126.com. S718.81 A 1671-5470(2016)05-0529-07 10.13323/j.cnki.j.fafu(nat.sci.).2016.05.009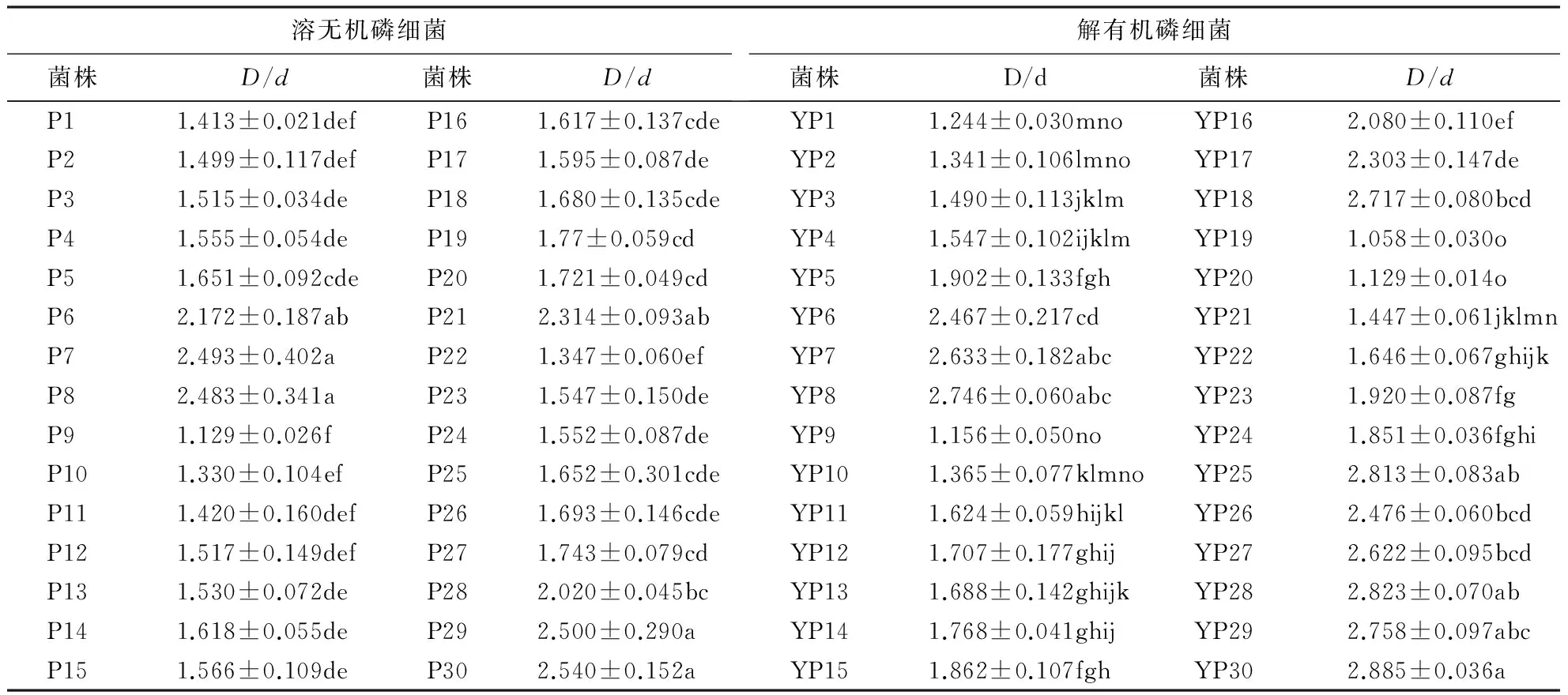


3 小结
4 讨论
