空间尺度对水生细菌群落生产力与生物多样性关系的影响
2016-10-26苏凯文沈立新王秋华
苏凯文 沈立新 王秋华 李 伟
(1. 西南林业大学生态旅游学院,云南 昆明 650224;2. 西南林业大学亚太森林组织昆明培训中心,云南 昆明 650224;3. 西南林业大学土木工程学院,云南 昆明 650224;4. 西南林业大学生物多样性研究院,云南 昆明 650224)
空间尺度对水生细菌群落生产力与生物多样性关系的影响
苏凯文1沈立新2王秋华3李伟4
(1. 西南林业大学生态旅游学院,云南 昆明650224;2. 西南林业大学亚太森林组织昆明培训中心,云南 昆明650224;3. 西南林业大学土木工程学院,云南 昆明650224;4. 西南林业大学生物多样性研究院,云南 昆明650224)
通过构建水体细菌微宇宙系统和采用末端限制性片段长度多态性技术,分析了不同空间尺度下生产力与水体细菌群落多样性之间的关系。结果表明:在较小的空间尺度 (单个培养锥形瓶) 下,生产力与水体细菌群落多样性之间呈现U格局,而在较大的空间尺度 (每3个具有相同生产力水平的培养锥形瓶) 下,生产力与水体细菌群落多样性之间呈现正相关格局。因此,生产力与水体细菌群落多样性之间的关系取决于研究空间尺度。未来的研究应采用高通量测序技术,克服多数微生物无法在实验室条件下进行培养的技术限制,从而深入探索自然生态系统中的细菌群落多样性、分布特征及其在生态系统中的功能和作用。
生产力;生物多样性;空间尺度;水体细菌;群落
生产力对生物多样性的影响作用是群落生态学研究的一个核心问题[1-7]。不少研究结果显示,生物多样性随着生产力的增加可能升高 (正相关格局)、降低 (负相关格局)、先增加后减少 (单峰或倒U格局),或者先减少后增加 (U格局);也有可能两者间相互独立,即生物多样性不会随着生产力的改变而发生变化 (缺失格局)。生态学家就生产力对生物多样性的影响作用是否存在普遍性规律的问题展开了激烈的争论[1,3-4,8-9],然而,生物多样性对生产力的不同响应的相关研究进展缓慢,最终生态学家不得不承认两者之间并不存在一种较为普遍的单一格局[8,10]。
生产力对生物多样性的调控作用还受到诸如环境条件、气候状况、物种间作用、群落装配历史、以及研究空间尺度等多种因素的影响[6-7,10-15],特别是生产力-生物多样性关系可能随研究空间尺度的改变而发生变化[12-13,15-16]。如一个基于湖泊生态系统的观测性研究显示,在较小的研究尺度下 (以单个湖泊为研究对象) 生产力对生物多样性的影响作用关系呈现单峰格局,而在较大的研究尺度下 (以多个湖泊为研究对象) 两者之间则呈现正相关格局[13]。然而,由于自然生态系统有着极显著的复杂性,该观测性研究难以进一步探究哪些因素对湖泊生态系统的生产力-生物多样性关系有着决定性的影响作用。例如,不同湖泊的物理化学条件可能有所迥异,相关群落的装配历史也有可能不尽相同,故而基于观测数据的研究很难阐明究竟是环境条件、群落装配历史还是研究空间尺度对生产力-生物多样性关系有着最重要的影响作用。此外,现有的生产力-生物多样性关系研究存在着一个明显的局限性,即它们多以动植物为研究对象,这就不可避免地造成了研究偏倚性,而以微生物为研究对象,特别是探讨空间尺度如何影响生产力-微生物多样性关系的研究还十分有限[17-18]。
本研究通过建立细菌微宇宙生态系统,通过试验控制手段确保了各水生细菌群落具有相同的群落装配历史,并重点探讨研究空间尺度的改变是否会影响细菌微宇宙系统中生产力对生物多样性的影响作用,旨在为进一步探索生产力-生物多样性的关系,特别是为研究空间尺度的依赖性等重要生态问题提供科学依据。
1 材料与方法
1.1材料来源
研究水质样品选自美国俄亥俄州牛津城附近的Dogwood Pond (39°30′ N, 84°43′ W)、Hueston Pond (39°29′ N, 84°44′ W) 及Bachelor Pond (39°44′ N, 84°10′ W) 3个湖泊。在每个湖泊中随机设10个采样点,在每个点均采用灭菌消毒的量杯收集20 mL表层水水样。混合所有收集的水样,用于研究微宇宙系统中的细菌多样性。
1.2研究方法
按照水体细菌培养的试验方法[14]配置培养液,其中综合养分片购自Carolina Biological Supply,因为在实验室条件下该养分片能有效支持多种水体细菌的生长[14,19]。培养原液是将一片综合养分片充分溶解在1 L的去离子水中,再通过系列稀释的方法,建立养分浓度为培养原液浓度的1/1、1/2、1/4、1/8、1/16、1/32和1/64共7种生产力梯度水平,且在每种生产力条件下进行3次重复试验。
考虑到群落的不同装配历史可能会对生产力-生物多样性关系有一定的影响作用,从混合均匀的水质样品中取出5 mL并添加到盛有50 mL培养液的总容积为125 mL的锥形瓶中进行培养,使各个锥形瓶中的细菌种类、数量及细菌群落的装配历史都较为接近。所有试验锥形瓶均置于光照培养箱中,保持温度为20 ℃,光照为2 500 lx,光暗比为12 h∶12 h,光照生长期内每日隔2 h人工摇动锥形瓶1次,以减少细菌群落结构空间异质性的形成。
为了方便与Chase和Leibold的观测性研究结果[13]相比较,试验过程中把每一个锥形瓶视作较小的研究尺度,而该尺度下的多样性就是每个锥形瓶中水体细菌的多样性程度。由于每种生产力条件下有3个平行样,这3个生产力水平相同的锥形瓶在整体上被视作较大的研究尺度,而该尺度下的多样性就是每3个生产力水平相同的锥形瓶中水体细菌的多样性程度。在细菌群落装配完毕后,每周从培养液中移走5.5 mL并加入新鲜的等量培养液,以补充系统养分资源和减少有害代谢产物的积累。在试验开展的第6周 (相对稳定期) 进行取样,取样前匀速摇动锥形瓶,从中取出1 mL含细菌群落的培养液,并储存于1.5 mL经灭菌处理过的离心管中,然后放置于-80 ℃的超低温冰箱里,对细菌多样性水平进行测定分析时再取出。
由于细菌个体间较为频繁的基因片段转移和交换,对于细菌进行所谓 “种” 的水平定义与分类尚存在着很大的困难与挑战[20-21]。在该试验中采用细菌的可操作分类单元 (bacteria operational taxonomic units; OTUs) 作为细菌群落多样性的指标,而该分类单元是通过分析和比较细菌16SrDNA保守基因系列末端的限制性片段长度 (TRF) 来界定[22-24]。通过采用MO BIO的强力土壤DNA提取试剂盒 (PowerSoil®DNA Isolation Kit),对每个样品 (500 μL) 中的细菌总DNA进行提取,然后采用TaKaRa PCR kits (TaKaRa Bio Inc.) 对细菌的16SrDNA进行扩增,并采用一个具有荧光染色的正向引物 (fl8f-Hex 5′-AGAGTTTGATCCTGGCTCAG-3′) 和另外一个没有荧光标记的反向引物 (926r-Tet 5′-CCGTCAATTCCTTTRAGTTT-3′) (Integrated DNA Technologies Inc.),所有的16SrDNA片段扩充过程在PTC-0200 Peltier热循环仪中进行 (MJ Research Inc.)。扩增产物经纯化后采用限制性内切酶HhaI进行酶切,并通过装有GeneScan 3.1.2的ABI3100 automatic sequencer来测量酶切片段大小。根据有效限制性片段长度的标准[22-24],大小为50~1 000 bp的片段 (TRF) 才能用于细菌群落多样性的分析与比较,且不同的限制性片段长度 (TRF) 代表不同的细菌 (片段长度间的差异性应大于0.5 bp)。
1.3数据分析
在数据分析过程中,当研究尺度较小时,由于生产力与细菌TRF数量之间呈现非线性关系,故采用广义线性模型来检验生产力对细菌TRF数量的影响作用。由于样本中存在过度离散现象,参数family设置为quasibinomial,连接函数link设置为logit,并且模型中包括了自变量的一次项和二次项;当研究尺度较大时,由于生产力与细菌TRF数量之间呈现典型线性关系,故采用一般线性模型来检验生产力对细菌TRF数目的影响作用。所有的统计分析和制图均通过使用R软件来完成 (ver. 3.1.3, R Development Core Team 2015)。
2 结果与分析
2.1较小研究尺度下生产力-多样性之间的关系
较小尺度下生产力与水生细菌TRF数目之间的关系见图1。
在该研究尺度下,细菌TRF数量与生产力梯度之间呈现1个U格局,即沿着生产力梯度细菌TRF数量先减少后增加 (y=0.92x2+0.28x+3.38;P=0.02)。
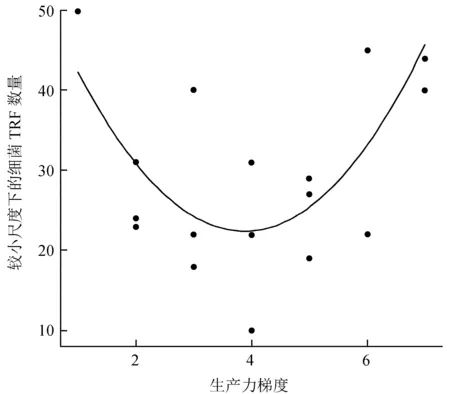
图1较小尺度下生产力与水生细菌TRF数目之间的关系
Fig.1The relationship between productivity and TRF numbers of aquatic bacterial communities at the local scale
Chase和Leibold[13]所开展的基于动植物群落的观测研究发现,在较小的尺度上生产力与动植物之间的关系呈现一个单峰格局,这与我们的发现正好相反,对于这些格局的差异性有2种解释。1) 研究对象不同:Chase和Leibold主要研究的是水生动物和植物群落,而我们的研究对象是水生细菌群落。事实上,一些生态学家已经提出了生产力与生物多样性的关系格局可能取决于研究对象的观点[3-4,18]。如基于动物和植物的不少研究都发现,在较小尺度上生产力与生物多样性之间普遍呈现单峰格局,而以细菌为研究对象的一些非常有限的研究则发现,不同的细菌类型可展示出迥异的生产力与多样性关系,其中拟杆菌属的细菌呈现出单峰格局,而α-变形菌属的细菌则呈现出U格局[18]。事实上,生产力与生物多样性关系的U格局并不仅限于细菌群落。如一个整合数据研究显示,在171篇已发表的文献中,所报道的生产力与生物多样性关系中出现U格局的比例可达到36%[4]。2) 群落装配历史不同:相关研究发现,具有不同装配历史的生态群落可展现出包括正相关、单峰和U格局在内的不同的生产力与生物多样性关系[14]。在Chase和Leibold的研究中,由于群落的装配历史不明,他们无法对该假说进行检验。在该项研究中,为了减少群落装配历史对生产力与生物多样性关系的影响作用,在每一个群落中同时引入了所有的水生细菌 (即所有的群落具有相同的装配历史),而这种同时引入所有建群种的手段其实也是群落装配的一种方式,并且可能会促成某种特定的生产力与生物多样性关系 (如U格局)。
2.2较大研究尺度下生产力-多样性之间的关系
较大尺度下生产力与水生细菌TRF数量之间的关系见图2。

图2较大尺度下生产力与水生细菌TRF数量之间的关系
Fig.2The relationship between productivity and TRF numbers of aquatic bacterial communities at the regional scale
在该研究尺度下,细菌TRF数量与生产力梯度之间呈现1个正相关格局,即沿着生产力梯度细菌TRF数量不断增加 (y=43.4+4.25x;P<0.01)。该生产力与多样性关系格局与不少以动植物为观测对象的区域性研究结果相一致。目前对这种较大尺度上的正相关关系有1种较为普遍的解释,即在该尺度下环境因素对生产力与生物多样性关系有决定性的影响作用 (即生产力假说)。随着生产力的不断增加,1个区域所能支持的生物种群规模也会逐渐增大,于是更多的个体能够共存,从而提高了该区域的生物多样性整体水平[24-25]。
3 结论与讨论
研究结果显示,随着研究空间尺度的改变,水生细菌微宇宙系统中的生产力与多样性之间的关系发生了变化。其中在较小的空间尺度下两者之间呈现U格局,而在较大的空间尺度下两者之间呈现正相关格局,这就为生产力-生物多样性关系依赖于空间尺度的假说提供了一个直接依据。
虽然研究结果能为探讨生产力与细菌多样性之间关系的研究提供一些新的科学依据,但是在研究中还存在以下的局限性:1) 所开展的研究是对水体细菌进行试验室条件下的培养,而这种途径无法反映出 (或者说远远低估了) 水体环境中细菌群落多样性的真实水平,因为不到1%的从自然生态系统中收集的微生物可以在试验室条件下进行培养[27-28];2) 通过使用16SrDNA基因序列的相似性来定义细菌的分类单元存在着很大的弊端,而未来的研究应更多的使用高通量测序技术,这样一方面可以对难以培养的稀有细菌进行直接检测和准确分类,另外一方面也可以全面准确地了解自然生态系统中的细菌群落多样性、分布特征及其在生态系统中的功能和作用[29]。在研究中,通过对细菌16SrDNA基因序列的相似性进行分析来定义其分类单元,但是却无法知道各水体细菌的所属类型。如观测到的U格局可能是因为细菌群落中的α-变形菌细菌所占比例较高所致,而目前的试验手段难以对这个问题做出解答。因此,未来研究应加强关于生产力与细菌多样性关系是否会随不同的细菌功能群而发生变化方面的探索。然而采用微宇宙生态系统的目的,并不是对自然生态系统进行一种人工模拟,而是通过对研究系统的简化来着重分析和探讨某些因子的影响作用。可是,这种手段会不可避免地忽略一些可能对生态过程有重要影响作用的因素[17]。如试验中的各锥形瓶之间是相互独立的,而天然湖泊之间的物种扩散是一种很常见的现象[30],并且物种的交流程度很可能影响生产力与生物多样性的关系,特别是空间尺度对两者关系的影响作用[15,30]。因此,未来的模拟研究中也应该充分考虑物种扩散的生态意义。总之,全面分析微生物群落的生产力与多样性关系,特别是该关系对研究空间尺度的依赖性,以及深入探索内在机理机制是未来群落生态学研究的一个重要内容,会对理论分析、试验设计和方法技术等方面提出更高的要求,也势必会对微生物生态学的发展起到巨大的推动作用。
[1]Abrams P A. Monotonic or unimodal diversity-productivity gradients: what does competition theory predict[J]. Ecology, 1995, 76(7): 2019-2027.
[2]Rosenzweig M L. Species diversity in space and time[M]. Cambridge: Cambridge University Press, 1995.
[3]Waide R B, Willing M R, Steiner C F, et al. The relationship between productivity and species richness[J]. Annual Review of Ecology and Systematics, 1999, 30(1): 257-300.
[4]Mittelbach G G, Steiner C F, Scheiner S M, et al. What is the observed relationship between species richness and productivity[J]. Ecology, 2001, 82(9): 2381-2396.
[5]Willig M R. Biodiversity and productivity[J]. Science, 2011, 333(6050): 1709-1710.
[6]彭少麟, 黄忠良. 生产力与生物多样性之间的相互关系研究概述[J]. 生态科学, 2000, 19(1): 1-9.
[7]邱波, 王刚. 生产力与生物多样性关系研究进展[J]. 生态科学, 2003, 22(3): 265-270.
[8]Adler P B, Seabloom E W, Borer E T, et al. Productivity is a poor predictor of plant species richness[J]. Science, 2011, 333(6050): 1750-1753.
[9]Fraser L H, Pither J, Jentsch A, et al. Worldwide evidence of a unimodal relationship between productivity and plant species richness[J]. Science, 2015, 349(6245): 302-305.
[10]Grace J B, Anderson T M, Seabloom E W, et al. Integrative modelling reveals mechanisms linking productivity and plant species richness[J]. Nature, 2016, 529(7586): 390-393.
[11]Drake J A. Community assembly mechanics and the structure of an experimental species ensemble[J]. American Naturalist, 1991, 137(1): 1-26.
[12]Gross K L, Willig M R, Gough L, et al. Patterns of species density and productivity at different spatial scales in herbaceous plant communities[J]. Oikos, 2000, 89(3): 417-427.
[13]Chase J M, Leibold M A. Spatial scale dictates the productivity-biodiversity relationship[J]. Nature, 2002, 416(6879): 427-430.
[14]Fukami T, Morin P J. Productivity-biodiversity relationships depend on the history of community assembly[J]. Nature, 2003, 424(6947): 423-426.
[15]Chalcraft D R, Williams J W, Smith M D, et al. Scale dependence in the species-richness-productivity relationship: the role of species turnover[J]. Ecology, 2004, 85(10): 2701-2708.
[16]Scheiner S M, Jones S. Diversity, productivity and scale in Wisconsin vegetation[J]. Evolutionary ecology research, 2002, 4(8): 1097-1117.
[17]Lawler S P. Ecology in a bottle: using microcosms to test theory. Experimental ecology: issues and perspectives[M]. Oxford: Oxford University Press, 1998.
[18]Horner-Devine M C, Leibold M A, Smith V H, et al. Bacterial diversity patterns along a gradient of primary productivity[J]. Ecology letters, 2003, 6(7): 613-
622.
[19]Kaunzinger C M K, Morin P J. Productivity controls food-chain properties in microbial communities[J]. Nature, 1998, 395(6701): 495-497.
[20]Gevers D, Cohan F M, Lawrence J G, et al. Re-evaluating prokaryotic species[J]. Nature Reviews Microbiology, 2005, 3(9): 733-739.
[21]Staley J T. The bacterial species dilemma and the genomic-phylogenetic species concept[J]. Philos Trans R Soc Lond B Biol Sci., 2006, 361(1475): 1899-
1909.
[22]Marsh T L. Terminal restriction fragment length polymorphism (T-RFLP): an emerging method for characterizing diversity among homologous populations of amplification products[J]. Current Opinion in Microbiology, 1999, 2(3): 323-327.
[23]Liu W, Marsh T L, Cheng H, et al. Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S ribosomal DNA[J]. Applied Environmental Microbiology, 1997, 63(11): 4516-4522.
[24]Clement B G, Kehl L E, DeBord K L, et al. Terminal restriction fragment patterns (TRFPs), a rapid, PCR-based method for the comparison of complex bacterial communities[J]. Journal of Microbiological Methods, 1998, 31(3): 135-142.
[25]Brown J H. Two decades of homage to Santa Rosalia: Toward a general theory of diversity[J]. American Zoology, 1981, 21(4): 877-888.
[26]Srivastava D S, Lawton J H. Why more productive sites have more species: an experimental test of theory using tree-hole communities[J]. American Naturalist, 1998, 152(4): 510-529.
[27]Amann R I, Ludwig W, Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews, 1995, 59(59): 143-169.
[28]Hugenholtz P. Exploring prokaryotic diversity in the genomic era[J]. Genome Biology, 2002, 3(3): 1-8.
[29]任丽娟, 何聃, 邢鹏, 等. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21(4): 421-432.
[30]Cadotte M W, Fukami T. Dispersal, spatial scale, and species diversity in a hierarchically structured experimental landscape[J]. Ecology Letters, 2005, 8(5): 548-557.
(责任编辑韩明跃)
The Impact of Spatial Scale on the Productivity-diversity Relationship of Aquatic Bacterial Community
Su Kaiwen1, Shen Lixin2, Wang Qiuhua3, Li Wei4
(1. College of Ecotourism, Southwest Forestry University, Kunming Yunnan 650224, China; 2. APFNet Kunming Training Center, Southwest Forestry University, Kunming Yunnan 650224, China; 3. College of Civil Engineering, Kunming Yunnan 650224, China; 4. Yunnan Academy of Biodiversity, Southwest Forestry University, Kunming Yunnan 650224, China)
The current study established laboratory microcosms consisting of aquatic bacterial community, and bacteria operational taxonomic units (OTUs) were identified by unique terminal restriction fragment lengths. The results showed that at a local scale (i. e., a single culture flask), a U-shape pattern was found between productivity and bacterial TRF. However, a positive relationship was revealed at a regional scale (i. e., a set of three replicated flasks). Therefore, the current study demonstrated that productivity-richness relationship was scale-dependent. Future studies should apply high-throughput sequencing methods to solve the technical problem that the majority of microorganisms are uncultivable under laboratory conditions, and to better understand the diversity and distribution patterns of microbial communities, as well as important ecosystem functions and services they provide.
productivity, biodiversity, spatial scale, aquatic bacterial, community

10. 11929/j. issn. 2095-1914. 2016. 05. 016
2016-01-18
教育部归国留学人员科研启动基金 (214201);西南林业大学科研启动基金 (111403)。
李伟 (1978—),男,副研究员,博士。研究方向:生物多样性-生态系统功能研究。Email: ww0592@gmail.com。
Q939.1
A
2095-1914(2016)05-0095-05
第1作者:苏凯文 (1993—),男,硕士生。研究方向:生物地理分布格局研究。Email: 54430368@qq.com。
