葡萄籽原花青素对食源性铅诱导的大鼠肾氧化应激的保护作用及机制
2016-10-26陈雁张胜来姜婧张海莉谭敩杨大千张志刚
陈雁,张胜来,姜婧,张海莉,谭敩,杨大千,张志刚*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.大庆市肇源县畜牧兽医局,黑龙江大庆166599)
葡萄籽原花青素对食源性铅诱导的大鼠肾氧化应激的保护作用及机制
陈雁1,张胜来2,姜婧1,张海莉1,谭敩1,杨大千1,张志刚1*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.大庆市肇源县畜牧兽医局,黑龙江大庆166599)
为研究转录因子NF-E2相关因子2(Nrf2)对铅(Pb)所致肾脏氧化应激的作用及葡萄籽原花青素(GSPE)对其的影响,40只Wistar大鼠随机分成4组,分别为对照组、醋酸铅组、GSPE干预组、GSPE组,处理30 d后,检测肾脏中超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)和谷胱甘肽s转移酶(GST)含量,并测定大鼠肾组织的Pb含量、肾脏病理变化。Nrf2的表达等。结果表明,与醋酸铅组相比,GSPE干预组肾脏中Nrf2的表达明显升高,肾组织中SOD含量升高37%,GSH和GST含量分别升高34%和40%,MDA的含量降低35%。综上所述,GSPE可以通过提高Nrf2蛋白的表达,减缓食源性Pb中毒引起的大鼠肾脏氧化损伤。
葡萄籽原花青素;醋酸铅;大鼠;肾脏;氧化损伤;Nrf2
铅(Pb)是饲料中主要的重金属污染物之一,饲料是畜禽体内Pb的主要来源,常以有机和无机形式存在于饲料中,对神经系统、生殖系统和泌尿系统等多种脏器造成损伤(Pilsner等,2009;袁建敏等,2003)。Pb主要蓄积在肾脏中,进入畜禽体内的Pb大部分经肾脏代谢(Osterloh等,1989)。Pb的肾毒性作用主要是肾小管的损伤及萎缩、肾小球的滤过障碍,以及引起肾脏的炎症损伤(李丽和刘琳,2013;Liu等,2012)。Wang等(2009)研究认为Pb导致肾损伤的机制与自由基的产生高度相关。
转录因子NF-E2相关因子2(Nrf2)是一种内源性的抗氧化应激调节因子,Nrf2的活化可以促进抗氧化基因的表达,诱导Ⅱ相解毒酶的生成(Zhang等,2015;Zhu等,2015)。Rothe等(2015)认为Nrf2在机体对抗氧化、亲电子以及外源性毒物损伤过程中起到决定性作用。Nrf2可以由许多方式激活,如化学物质以及食品多酚(Niture等,2014;Scapagnini等,2011)。贺淼等(2015)研究指出黄酮类物质可以抑制活性氧的产生,清除自由基。葡萄籽原花青素(GSPE)是从葡萄籽中提取的类黄酮化合物,具有清除自由基、抗氧化和抗炎等功能,能够降低氧化应激带来的损伤(Li等,2015;Chen等,2015)。GSPE的半数致死量高达4000 mg/kg,过量服用不会出现不良反应(国植和徐莉,1996)。GSPE对食源性Pb引起的肾脏氧化应激的保护作用及作用机制鲜见报道。
本试验旨在研究GSPE对醋酸铅诱导的大鼠慢性肾损伤的保护作用,及其抗氧化应激的作用机制,为将GSPE应用到动物饲料添加剂中以降低食源性Pb引起的肾损伤提供理论依据和实践基础。
1 材料与方法
1.1试验材料
1.1.1主要试剂GSPE,购自长沙纽蓝生物制品有限公司;醋酸铅,购自天津基准化学试剂有限公司;总蛋白(马斯亮蓝法)、超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)和谷胱甘肽s转移酶(GST)测定试剂盒,购自南京建成生物工程研究所;Nrf2抗体,购自Abcam。
1.1.2主要仪器全自动生化分析仪(CX4 Pro贝克曼库尔特)、低温离心机(Sigmal)、连续波长酶标仪(Bio-Tek Epoch)、恒温水槽(上海精宏实验设备有限公司)、荧光显微镜(Nikon Elipose Ti-s)、T6新世纪分光光度计(北京普析通用仪器有限责任公司)、原子吸收分光光度计(日本岛津AA-6300)。
1.1.3试验动物健康雄性wistar大鼠40只,6~8周龄,体重(110.0±20.0)g。分笼饲养于标准化试验舍内,室内温度(23±2)℃,相对湿度45%~55%,大鼠自由饮水和采食,动物在试验前适应性饲养7 d。
1.2试验方法
1.2.1试验分组与处理将40只wistar大鼠随机分为4组(每组10只),分别为对照组、醋酸铅组、GSPE干预组和GSPE组。其中对照组和GSPE组自由饮水,醋酸铅组与GSPE干预组0.25%醋酸铅溶液自由饮用;GSPE干预组和GSPE组每日GSPE溶液(200 mg/kg体重)灌胃,对照组和醋酸铅组每日相同剂量蒸馏水灌胃。试验持续30 d后,称重,麻醉处死。剖开腹腔,腹主动脉采血,取出两侧肾脏称重,部分肾脏置入10%中性甲醛中固定,用于组织切片的制作和免疫组化的测定;部分肾脏,称重,剪碎,匀浆,用于抗氧化指标的测定。
1.2.2脏器指数的测定脏器指数计算公式如下:

1.2.3肾功能的检测血清肌酐(SCr)的检测方法:碱性苦味酸法;尿素氮(BUN)的检测方法:尿素酶法。
1.2.4Pb含量的测定称取适量样品,炭化后,置于马弗炉中,灰化数小时,冷却后加适量盐酸,直至干燥,冷却,加2%硝酸煮沸,定容,混匀,测定Pb含量。测定前采用Pb单元素标准溶液制作标准曲线。
1.2.5组织病理学检测常规制备石蜡切片(5μm),HE染色,应用光镜观察肾脏组织结构形态。
1.2.6抗氧化指标的检测SOD活性测定:黄嘌呤氧化酶法;GSH活性测定:改良DTNB直接法;MDA含量:硫代巴比妥法;GST活性测定:GSH与1-氯-2,4-二硝基苯结合产物间接测定;总蛋白含量的测定:考马斯亮蓝法;操作严格按照试剂盒说明书操作。
1.2.7免疫组化试验10%甲醛固定组织,制成切片。切片常规脱蜡,经0.01 mol/L枸橼酸盐缓冲液(pH 6.0)处理,5%BSA,37℃孵育20 min。加Nrf2一抗(1∶400),4℃过夜。漂洗后滴加二抗(1∶1000)。漂洗,DAB显色,苏木素复染。DAB染色呈棕褐色,根据染色的范围和强度进行半定量评分。
1.2.8统计学分析采用“平均数±标准差”方法对结果进行表述,利用SPSS 17.0中的方差分析法比较组间差异。
2 结果与分析
2.1GSPE拮抗Pb引起的脏器指数升高由图1可知,醋酸铅组与对照组相比,脏器指数升高约1倍(P<0.05);和醋酸铅组比较,GSPE干预组肾脏的脏器指数降低21%(P<0.05)。
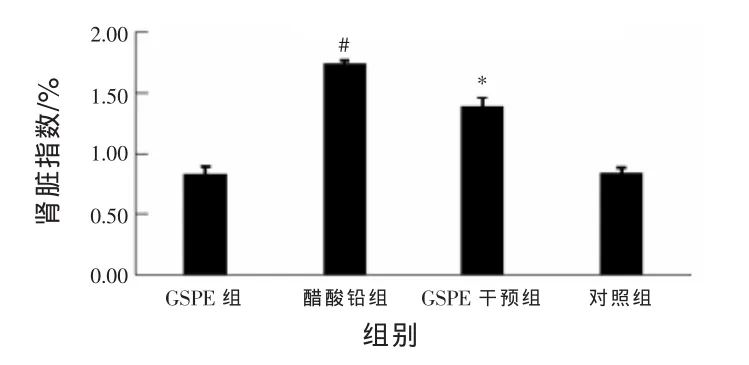
图1 大鼠肾脏指数比较
2.2GSPE可修复肾脏功能并降低Pb在肾脏中的蓄积由表1可知,与对照组相比,醋酸铅组SCr和BUN水平分别提高18.15%和140.85%(P<0.05);与醋酸铅组比较,GSPE干预组SCr和BUN水平分别降低9.07%和31.36%(P<0.05);醋酸铅组肾脏Pb含量较对照组提高314.64%(P<0.05),GSPE干预组肾脏中Pb蓄积量与醋酸铅组相比降低32.92%(P<0.05)。

表1 大鼠SCr和BUN水平及肾脏中Pb含量的比较(n=10)
2.3GSPE改善Pb诱导的病理损伤对照组和GSPE组小鼠肾脏组织结构清晰,肾小球及肾小管结构无异常;醋酸铅组与对照组相比,肾脏充血,部分肾小球出现萎缩,近曲小管浊肿、管腔狭窄,空泡变性,肾小管管形崩解,可见炎性细胞浸润严重;GSPE干预组部分肾小管上皮细胞排列较紊乱,肾小球萎缩,间质充血不明显,但与醋酸铅组比较,病变明显减轻。
2.4GSPE缓解肾脏氧化应激由表2可知,醋酸铅组MDA含量明显高于其他三组(P<0.05),与醋酸铅组相比,GSPE干预组MDA水平降低35%(P<0.05)。醋酸铅组SOD水平低于其他三组,GSPE干预组SOD水平与醋酸铅组相比升高37%(P<0.05)。醋酸铅组GSH和GST水平略高于对照组(P>0.05),但与醋酸铅组相比,GSPE组GSH和GST水平分别升高34%和40%(P<0.05)。
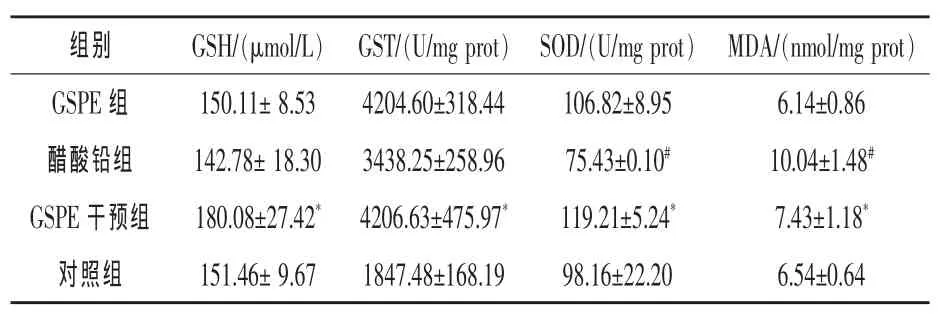
表2 各组大鼠肾脏抗氧化指标的比较(n=10)
2.5GSPE上调Nrf2的表达通过肾脏组织Nrf2免疫组化结果可知,GSPE组肾脏Nrf2的表达量比对照组高,GSPE干预组肾脏中Nrf2的表达量明显比醋酸铅组高。
3 讨论
肾脏是Pb毒性的主要靶器官。肾脏损伤时,其排泄功能降低,SCr和BUN则在体内蓄积,从而引起SCr和BUN水平升高(Beier等,2011)。本研究结果显示,与醋酸铅组相比,GSPE干预组SCr和BUN水平明显降低,此外,组织病理学结果显示,较之醋酸铅组,GSPE干预组的肾小球和肾小管的损伤程度明显降低,表明GSPE可降低醋酸铅诱导的肾脏损伤。Ahmed等(2011)的研究中发现,Pb可以在肾脏中蓄积,并使肾脏脏器指数升高。在本试验中,GSPE干预组肾脏脏器指数和肾脏中Pb的含量明显低于醋酸铅组,表明GSPE可以降低肾脏中Pb的蓄积。
Pb进入组织后可诱导自由基产生,进而引起脂质过氧化的发生(Ruas等,2008)。SOD和MDA是抗氧化的重要指标,其中SOD的产生标志着机体抵御自由基损害和保护细胞氧化损伤,MDA含量可体现脂质过氧化损伤的程度(Wang和Wang,2011)。Wahab等(2015)研究认为Pb暴露可造成组织器官中SOD水平的降低和MDA水平的升高。Adonaylo和Oteiza(1999)试验指出,与对照组动物相比较,慢性Pb中毒的试验动物,GSH和GST活性略有升高。在本研究结果中,大鼠经口染Pb后与对照组相比,肾脏中GSH和GST的活性略有升高,这可能与机体受到低剂量Pb刺激后,抗氧化能力表现为暂时性的代偿性增强有关系,也可能是Pb抑制了GSH向蛋白质转化(Patra等,2001)。但Pb中毒大鼠肾组织SOD活性显著降低,并且MDA的含量显著升高,说明食源性Pb已经引起机体的氧化应激。
本试验结果表明,与醋酸铅组相比,GSPE干预组肾脏中Nrf2的表达量明显提高。Nrf2是重要的抗氧化转录因子,其活化后可进入细胞核,激活SOD、GSH和GST等Ⅱ相解毒酶的表达,参与调节组织细胞抗氧化反应和氧化还原的调节,促进抗氧化基因的表达(Kobayashi和Yamamoto,2014)。Thomas等(2007)提出Keap1-Nrf2-ARE通路在细胞生存中起到重要作用。Nrf2的激活可以通过多种方式,Niture等(2014)发现,口服GSPE可以激活Nrf2-ARE通路。综上所述,GSPE改善Pb中毒导致的肾氧化损伤的机理包括:(1)GSPE可以修复肾功能和组织损伤,促进肾脏的排泄功能的修复。(2)GSPE能促进Pb在体内的代谢。(3)GSPE是很强的生物抗氧化剂,具有清除氧自由基的能力,促进肾脏中Nrf2蛋白的表达,提高肾组织中GSH、GST和SOD的含量,降低MDA的含量,达到抵抗Pb诱导的氧化损伤的目的。
4 结论
本研究结果表明,口服GSPE对大鼠食源性Pb中毒具有拮抗作用,可以降低Pb对肾脏的损伤。因此,在畜禽饲料中添加适当剂量的GSPE可降低食源性Pb的肾毒性作用,以保障动物源性食品安全。
[1]国植,徐莉.原花青素:具有广阔发展前景的植物药[J].国外医药:植物药分册,1996,11(5):196.
[2]贺淼,黄鑫,李彪,等.自由基清除物质的研究进展[J].中国饲料,2015,1:41~44.
[3]李丽,刘琳.慢性铅中毒致间质性肾炎1例报告[J].吉林医学,2013,34(17):3515~3518.
[4]袁建敏,呙于明,聂伟,等.饲料中铅的测定改进[J].中国饲料,2003,19:29~32.
[5]Adonaylo V N,Oteiza P I.Lead intoxication:antioxidant defenses and oxidative damage in rat brain[J].Toxicology,1999,135:77~85.
[6]Ahmed E,Abdel M,Mohamed A,et al.The protective effect of flaxseed oil on lead acetate-induced renal toxicity in rats[J].J Hazard Mater,2011,194,250~255.
[7]Beier K,Eppanapally S,Bazick H S,et al.Elevation of blood urea nitrogen is predictive of long-term mortality in critically ill patients independent of“normal”creatinine[J].Crit Care Med,2011,39(2):305~313.
[8]Chen S Z,Zhu Y F,Liu Z F,et al.Grape seed proanthocyanidin extract ameliorates diabetic bladder dysfunction via the activation of the Nrf2 pathway[J].Plos One,2015,10(5):1~16.
[9]Kobayashi M,Yamamoto M.Molecular mechanisms activating the Nrf2-Keap1 pathway of antioxidant gene regulation[J].Antioxid Redox Signal,2005,7:385~394.
[10]Li S G,Ding Y S,Niu Q,et al.Grape seed proanthocyanidin extract alleviates arsenic-induced oxidative reproductive toxicity in male mice[J].Biomed Environ Sci,2015,28(4):272~280.
[11]Liu C M,Ma J Q,Sun Y Z.Puerarin protects rat kidney from lead-induced apoptosis by modulating the PI3K/Akt/eNOS pathway[J].Toxicol Appl Pharmacol,2012,258(3):330~342.
[12]Niture S K,Khatri R,Jaiswal A K.Regulation of Nrf2-an update[J].Free Radic Biol Med,2014,66:36~44.
[13]Niture S K,Khatri R,Jaiswal A K.Regulation of Nrf2-an update[J].Free Radic Biol Med,2014,66:36~44.
[14]Osterloh J D,Selby J V,Bernard B P,et al.Body burdens of lead in hypertensive nephropathy[J].Arch Environ Health,1989,44(5):304~310.
[15]Patra R C,Swarup D,Dwivedi S K.Antioxidant effects of α tocopherol,ascorbic acid and l-methionine on lead induced oxidative stress to the liver,kidney and brain in rats[J].Toxicology,2001,162(2):81~88.
[16]Pilsner J R,Hu H,Ettinger A,et al.Influence of prenatal lead exposure on genomic methylation of cord blood DNA[J].Environmental Health Perspectives,2009,117(9):1466~1471.
[17]Rothe T,Gruber F,Uderhardt S,et al.12/15-lipoxygenase-mediated enzymatic lipid oxidation regulates DC maturation and function[J].Journal of Clinical Investigation,2015,125(5):1944~1954.[18]Ruas C B,Carvalho C D,De Araujo H S,et al.Oxidative stress biomarkers of exposure in the blood of cichlid species from a metal-contaminated river[J].Ecotoxicology and Environmental Safety,2008,71(1):86~93.
[19]Scapagnini G,Vasto S,Abraham N G,et al.Modulation of Nrf2/ARE pathway by food polyphenols:a nutritional neuroprotective strategy for cognitive and neurodegenerative disorders[J].Neurobiol,2011,44:192~201.
[20]Thomas W,Kensler N W,Shyam B.Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway[J].Cell,2007,47:89~116.
[21]Wahab I A,Habeeb B S,Maymunah O Z.Honey prevents neurobehavioural deficit and oxidative stress induced by lead acetate exposure in male wistar rats-a preliminary study[J].Metabolic Brain Disease.2015,5:1~8.
[22]Wang L,Wang H,Hu M,et al.Oxidative stress and apoptotic changes in primary cultures of rat proximal tubular cells exposed to lead[J].Arch Toxicol,2009,83(5):417~427.
[23]Wang Y,Wang S Q.Effects of lead exposure on histological structure and antioxidant capacity in the cerebellum of 30-day-old mice[J].Neural regeneration,2011,14(6):1077~1081.
[24]Zhang X S,Ha S,Wang X L,et al.Tanshinone IIA protects dopaminergic neurons against 6-OHDA induced neurotoxicity through miR-153/Nrf2/ ARE signaling pathway[J].Neuroscience,2015,303:489~502.
[25]Zhu C,Wang S,Wang B,et al.17β-Estradiol Up-Regulates Nrf2 via Pi3k/Akt and Estrogen Receptor Signaling Pathways to Suppress Light-Induced Degeneration in Rat Retina[J].Neuroscience,2015,304:328~339.
招聘
坤达包装始创于2003年,是一家多元化的现代企业。公司现拥有浙江坤达、江西坤达等四家分公司,员工800多人,年产值创5亿元,公司引进国内先进的塑编、印刷高新设备,专注产品质量和技术,提高供应链运转效率,形成了研发、设计、拉丝、编织、彩印、复合、盖光、制袋、检测高标准的生产体系。公司拥有白色、黄色、红色、绿色、蓝色等主导编织产品,广泛应用于饲料、化工、粮油、食品等农牧行业。公司实施塑编行业ERP模式创新,完善产供销一体化的经营模式,产品直接面向终端客户。坤达致力于打造一个具有品牌价值的企业。
片区总经理
1、有较强的事业心,富有业务开拓能力;
2、具有组织、沟通、策划、整合资源能力,执行力强;
3、能够独立开发大客户、领导所辖团队
4、组建销售队伍,培训销售人员
5、制定销售业绩,建设销售团队。
区域经理
1、具有规划意识、分析能力,思维敏捷,有较高协调能力和语言表达能力;
2、收集市场信息及需求,能够在上级的协助下开发大客户
3、较强的自我学习能力;
4、对工作有激情,办事讲原则,为人勤快,有上进心
浙江事业部
电话:0577-58107986传真:0577-63572951
邮箱:196328979@qq.com联系人:林丽力
江西事业部
电话:0796-8400258传真:0796-8400658
邮箱:1962364732@qq.com联系人:王灵卿
To study the effects of NF-E2-related factor 2(Nrf2)on the oxidative injury of kidney in rats exposed to lead and to observe the effects of grape seed proanthocyanidin extract(GSPE)on nephrotoxicity of lead,forty Wistar rats were divided randomly into four groups:control group,lead acetate group,GSPE intervention group and GSPE group.After 30 days,GSPE effects on superoxide dismutase(SOD),methane dicarboxylic aldehyde(MDA),glutathione(GSH)and glutathione s-transferase(GST)content in the kidney were detected,and lead concentrations,expression of Nrf2,pathologic changes of kidney tissue were determined.The results showed that:compared with lead acetate group,GSPE intervention group showed a significantly expression increase of Nrf2 in kidney,the level of SOD was increased by 37%,the levels of GSH and GST were increased by 34%and 40%respectively,the level of MDA was decreased by 35%.In conclusion,GSPE could alleviate oxidative stress damage in rat kidney by expression increase of Nrf2.
grape seed proanthocyanidin extract;lead acetate;rat;kidney;oxidative injury;Nrf2
S816.7
A
1004-3314(2016)04-0019-04
10.15906/j.cnki.cn11-2975/s.20160405
国家自然科学基金青年项目(31101868);中国博士后科学基金特别资助(2010T50302);黑龙江省普通高等学校新世纪优秀人才计划项目(1253-NCET-007)
