西兰花中黄酮提取工艺优化
2016-10-25杨静思
陆 英,张 盛,李 海,杨静思
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.长沙三福生物科技有限公司,湖南 长沙 410100)
西兰花中黄酮提取工艺优化
陆 英1,张 盛1,李 海2,杨静思1
(1.湖南农业大学园艺园林学院,湖南 长沙 410128;2.长沙三福生物科技有限公司,湖南 长沙 410100)
以市售西兰花为材料,先对西兰花不同部位的黄酮含量进行了测定;然后以花为原料,考察了乙醇浓度、料液比、提取时间和提取温度4个单因素对黄酮提取效果的影响,在单因素基础上进行正交试验以期获得西兰花总黄酮最优提取工艺。结果表明:西兰花各部位黄酮含量由高到低依次为:花>茎>叶;正交试验的极差分析表明,各因素对西兰花总黄酮提取效果影响程度从大到小依次为:料液比>乙醇浓度>提取时间>提取温度;方差分析表明,料液比和乙醇浓度具有显著性影响;最佳提取工艺条件为:乙醇浓度70%,提取温度85 ℃,料液比1∶3,提取时间 1.5 h,在此条件下黄酮提取量为18~20 mg/g,提取物干物中黄酮含量达10%以上。
西兰花;黄酮;提取;工艺优化
西兰花又名绿菜花、青花菜,它不仅含有多种营养物质,还含有硫代葡萄糖苷的酶解产物或衍生物以及丰富的抗坏血酸和黄酮类物质[1-3],具有多种药用价值。硫代葡萄糖苷的酶解产物萝卜硫素或衍生物被认为具抗癌作用[4-6],抗坏血酸具有很强的抗氧化能力,同时也能增强肝脏解毒功能;黄酮类化合物也是天然的抗氧化剂,不仅能减少心血管疾病的发生,而且对高血压、心脏病有调节和预防作用[7]。因此,西兰花具有广阔的开发利用前景。
关于西兰花中总黄酮的提取方法及工艺已有相关报道,多采用超声提取方法[8-9]或高浓度乙醇提取[10],均不适用于工业化应用。同时,大部分研究都没有对原料含量进行筛选,产品含量不明确。因此,试验首先对西兰花不同部位的黄酮含量进行定性定量分析,在此基础上优化了工业化提取西兰花总黄酮的工艺条件,旨在为进一步开发利用西兰花奠定基础。
1 材料与方法
1.1 供试材料与试验试剂
供试西兰花2015年11月购于湖南农业大学农贸市场。
主要试验试剂有芦丁标准品(纯度95%,中国药品生物制品检定所);硝酸铝、亚硝酸钠、氢氧化钠(国产分析纯);95%食用乙醇、色谱甲醇(国药集团化学试剂公司);
主要试验仪器有LC-20AT高效液相色谱仪(日本岛津公司);Cl8色谱柱(250 mm×4.6 mm,5 μm,WondasilTM); UV-2100型紫外可见分光光度计(北京莱伯泰科仪器有限公司);微型植物粉碎机(天津市泰斯特仪器有限公司);HH数显恒温水浴锅(金坛市金城国胜实验仪器厂)。
1.2 试验方法
1.2.1 原料处理 西兰花按叶、茎、花分离(顶端细茎2~3 cm及花按花处理,主要膨大部分为茎),各部位在60℃低温干燥后用粉碎机粉碎,保存待用。
1.2.2 西兰花提取液高效液相色谱(HPLC)分析
采用C18 色谱柱,A泵进水(0.5%冰醋酸),B泵进甲醇,按下列方式梯度洗脱:0 min(A:88%,B:12%)→15 min(A:75%,B:25%)→35 m in(A:65%,B:35%),流速1 mL/m in;输出波长330 nm,柱温35℃。提取色谱峰的紫外光谱,分析化合物类型。1.2.3 西兰花中总黄酮的检测 精密称取芦丁标准品10.55 mg置于10 m L容量瓶中,用70%乙醇溶解定容,摇匀。精密吸取该芦丁标准溶液0.10、0.20、0.30、0.40、0.50、0.60 mL分别置于10 mL容量瓶中,加入70 %乙醇补充至2.0 m L;加入0.4 m L 5 %的NaNO2溶液,摇匀放置6 min;加入0.4 mL 10 % Al(NO3)3溶液,摇匀后再放置6 m in;加入4 mL 5% NaOH溶液,最后用70 %乙醇定容,摇匀后放置10 min,以样品空白调零,在510 nm波长下测定吸光值,每个浓度平行测定2次。以芦丁浓度为横坐标,吸光值为纵坐标绘制标准曲线。
1.2.4 西兰花不同部位总黄酮提取效果考察 准确称取西兰花不同部位材料2.0 g,用20倍甲醇70 ℃回流提取1 h,按标准曲线方法测定并计算提取液中黄酮含量,考察西兰花不同部位总黄酮提取效果,为后续试验材料选择提供依据。
1.2.5 西兰花总黄酮提取工艺单因素试验 准确称取2.0 g西兰花花部粉末若干份,依次进行乙醇浓度(设40、50、60、70、80% 5个梯度,固定溶剂用量为40 m L,温度80℃,时间2.0 h)、溶剂用量(设溶剂用量(m L)为原料质量(g)的5、10、20、30、40倍 5个梯度,固定乙醇浓度60%,温度80℃,时间2.0 h)、提取温度(设50、60、70、80、90℃ 5个梯度,固定乙醇浓度60%,溶剂用量60 mL,时间 2.0 h)、提取时间(设0.5、1.0、1.5、2.0、2.5 h 5个梯度,固定乙醇浓度60%,溶剂用量60 mL,温度85℃)的单因素试验,测定提取液中的黄酮量,确定单因素提取参数。1.2.6 正交试验优化提取条件 将上述确定的4个单因素值左右各设1个水平,然后用正交表L9(34)安排4因素3水平试验,以提取量为指标,通过极差分析和方差分析确定各因素对提取效果的影响程度,获得最优提取工艺条件。
1.3 最优工艺验证
取样品20.0 g 2份,按确定的最优工艺条件进行提取,测定提取液中黄酮提取量及干物率,计算干粉质量及黄酮含量。
2 结果与分析
2.1 西兰花提取液HPLC分析
西兰花甲醇提取液HPLC见图1,由图1可知,西兰花中化学成分组成复杂,PDA检测器显示色谱图中保留时间在14~28 m in内的化合物的紫外吸收光谱在300~400 nm和240~280 nm 有较大吸收峰,见图2,符合黄酮类化合物的紫外吸收特征,主要为简单黄酮和黄酮醇类[11]。
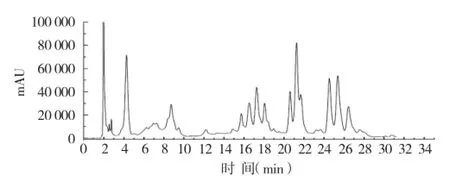
图1 西兰花提取液HPLC图谱
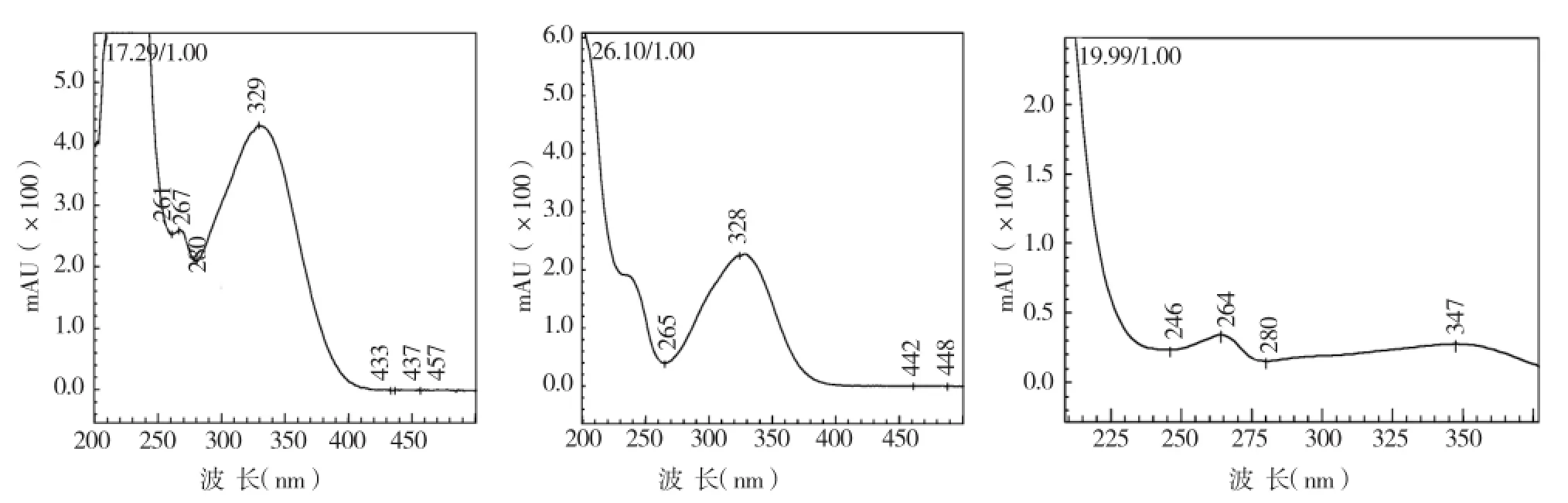
图2 西兰花组分的UV图谱
2.2 标准曲线的绘制
芦丁质量浓度x与吸光值y的标准典线见图3,从图3中可以看出,回归方程为:у=12.193x-0.014, R2=0.995 9,线性关系良好。
2.3 西兰花不同部位中黄酮的提取效果
从图4中可以看出,西兰花不同部位的黄酮含量差异较大,总的来讲,各部位黄酮含量由高到低排列依次为花>叶>茎,为提高提取物中的黄酮含量,以西兰花的花为提取原料较好。
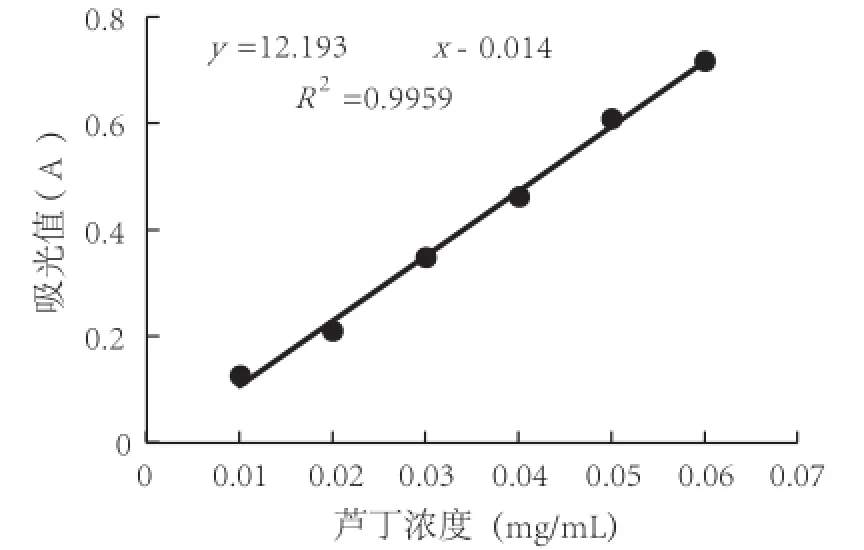
图3 芦丁标准曲线
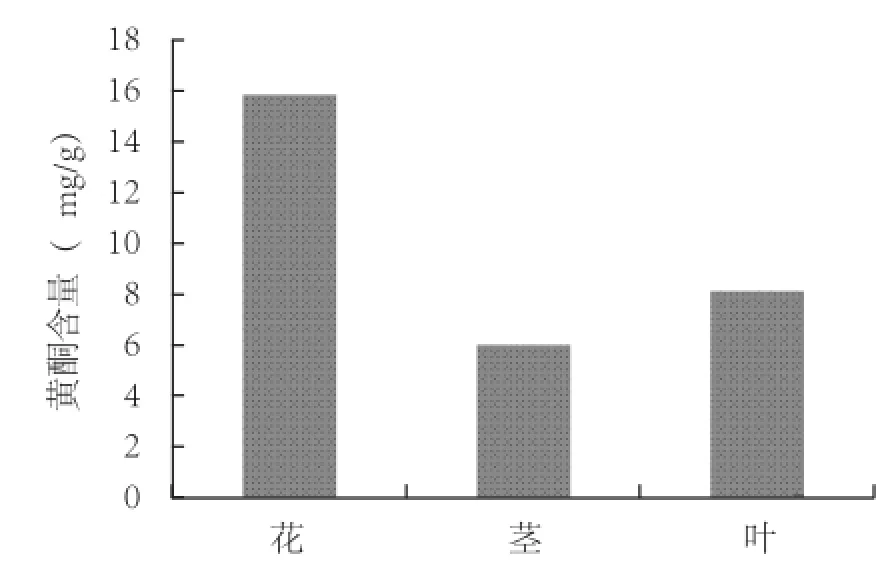
图4 西兰花不同部位黄酮含量
2.4 提取单因素试验
2.4.1 乙醇浓度对西兰花黄酮提取的影响 从图5可以看出,随着乙醇浓度的增大,西兰花总黄酮提取量随之升高。当浓度大于60%后,黄酮提取量不在继续升高,因此确定乙醇浓度为60%。
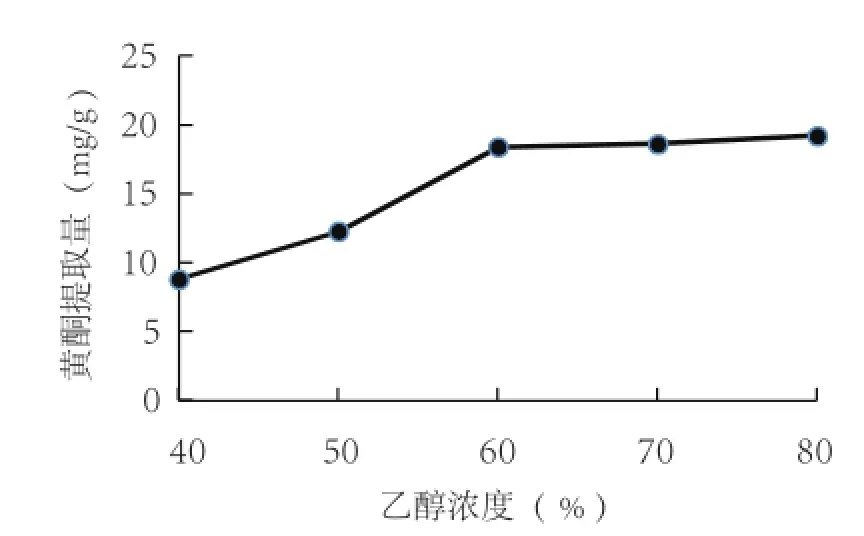
图5 乙醇浓度对西兰花黄酮提取的影响
2.4.2 溶剂用量对西兰花黄酮提取的影响 由图6可知,随着溶剂用量的增大,黄酮提取量也随之升高;当溶剂用量大于30倍以后,提取量趋于平缓,因此溶剂用量(m L)为原料质量(g)的30倍较为合适。
2.4.3 提取温度对西兰花黄酮提取的影响 从图7可见,随着温度的升高,西兰花黄酮提取量也是逐渐升高,当温度超过80℃后升高趋势变缓,这是因为温度过高将导致乙醇损失较大,因此选择85℃作为最适提取温度。
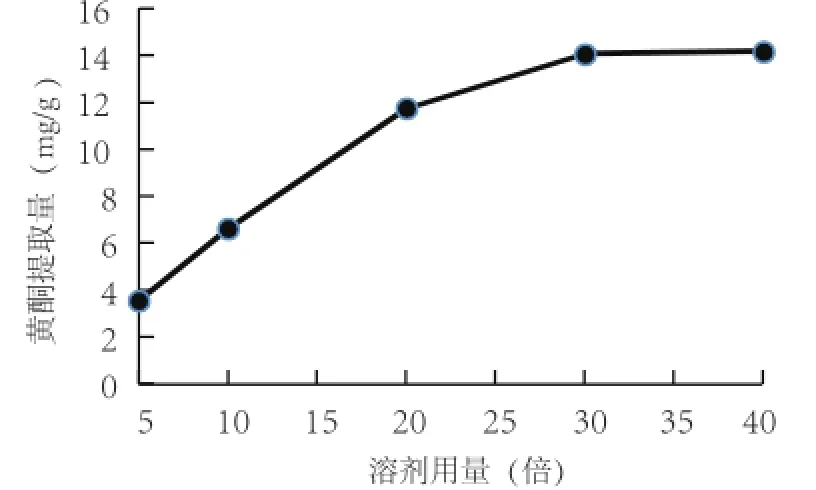
图6 料液比对西兰花黄酮提取效果的影响
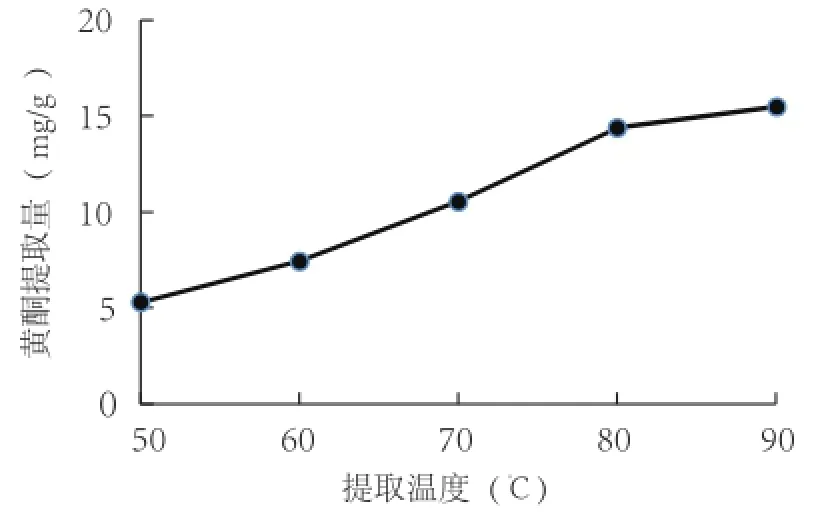
图7 温度对西兰花黄酮提取效果的影响
2.4.4 提取时间对西兰花黄酮提取的影响 从图8可见,随着提取时间的延长,西兰花黄酮提取量持续上升,提取2 h后上升趋势变缓,由于提取时间过长不利于提高生产效率,因此选择2 h为最佳提取时间。
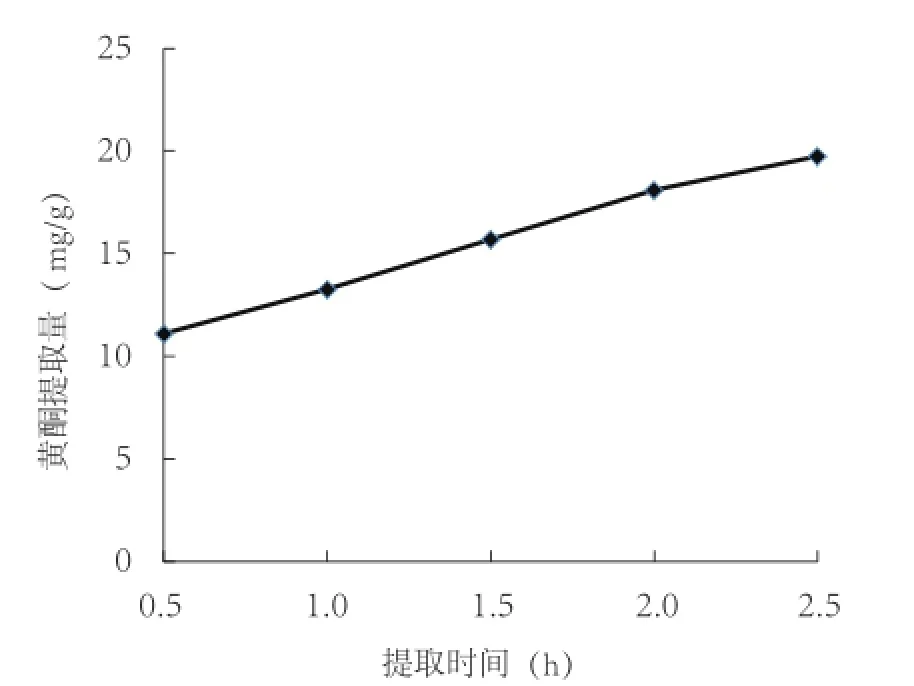
图8 提取时间对西兰花黄酮提取的影响
2.5 正交实验优化提取条件
根据单因素确定的条件设计正交实验因素水平面见表1。从表2可以看出,各因素对西兰花黄酮化合物提取影响程度大小依次为:料液比>乙醇浓度>提取时间>提取温度,最佳提取工艺条件为:A2B1C2D3,即提取温度85 ℃,提取时间1.5 h,料液比1∶30,乙醇浓度70%。同时从表3可知,料液比和乙醇浓度在试验条件下对西兰花黄酮提取具有显著性影响,时间和温度不具显著性影响。
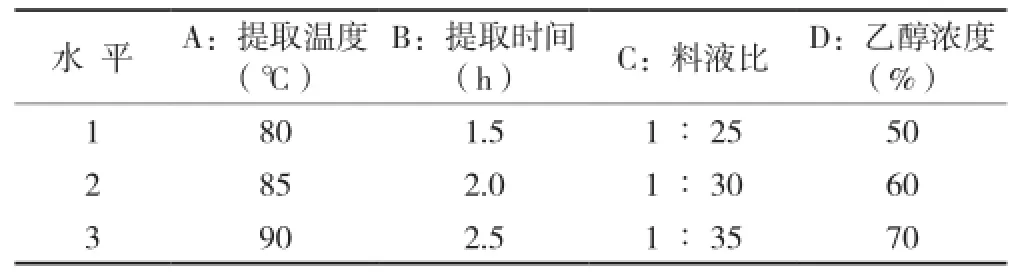
表1 因素水平设计表
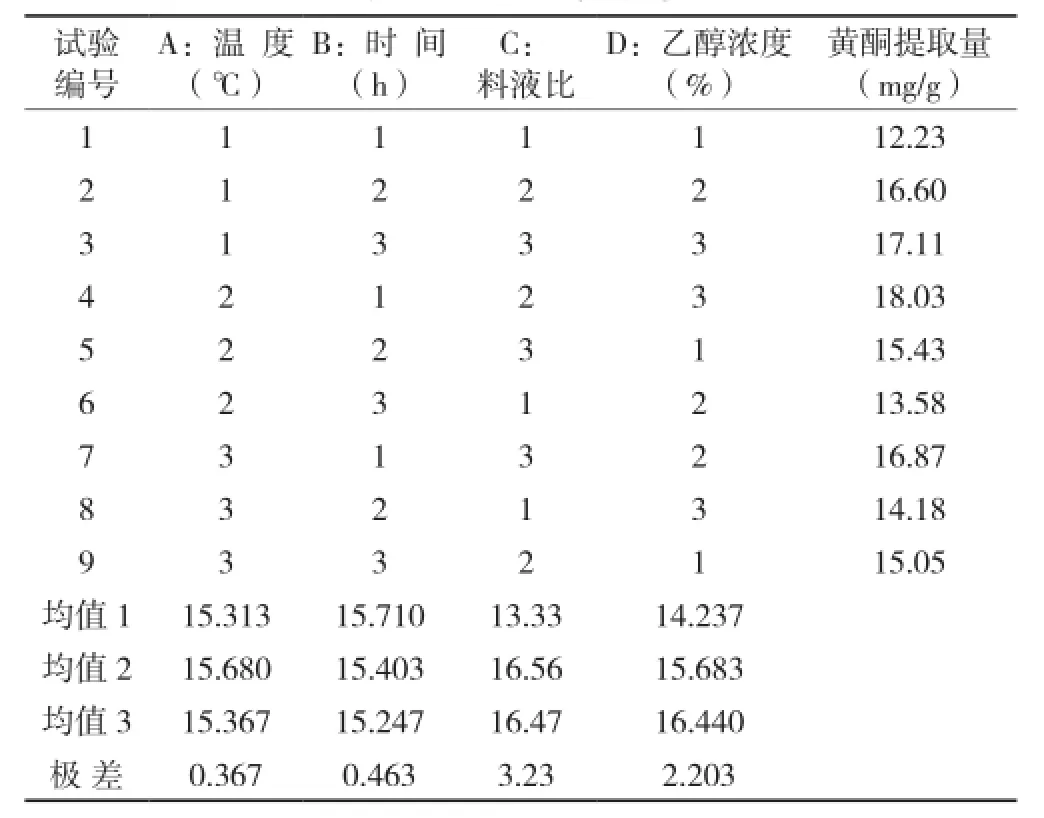
表2 正交试验结果

表3 正交试验结果方差分析
2.6 最优工艺验证试验结果2份20 g样品按上述确定的最优工艺条件提取,测得黄酮提取量分别为19.92、18.53 mg/g,均优于正交试验组合,说明该工艺方案可行,重现性好;干物质质量分别为3.85、3.69 g,黄酮含量为10.34%、
10.05 %。
3 结论与讨论
文献报导西兰花中含有黄酮类化合物,但其化学组成却并未见报导。试验对西兰花甲醇提取液进行HPLC分析,发现其中含有多个化学成分,通过UV光谱特征分析,发现这些化学成分在300~400 nm 和240~280 nm间有较大吸收峰,可推测为黄酮类化合物,其化学结构有待进一步分离纯化后进行结构鉴定。
对西兰花不同部位的黄酮含量提取结果表明,黄酮类化合物在西兰花茎、叶、花中含量差异较大,可能与黄酮类化合物的合成、运输、积累有关,黄酮类化合物的形成以光合作用为基础,而花中的光合作用最强,故这一部位的黄酮类化合物含量最高。因此,以花为提取原料能获得较高的黄酮含量。
正交试验结果表明,料液比和乙醇浓度对西兰花黄酮提取具有显著性影响。因此,在实践中需严格控制料液比和乙醇浓度,方能得到最佳试验结果。工艺验证试验结果表明,在提取温度85 ℃、提取时间1.5 h、料液比1∶30、乙醇浓度70%的工艺条件下,西兰花中黄酮的提取量为18~20 mg/g,明显高于其他工艺条件,提取物中黄酮含量达10%以上,为西兰花资源的深加工以及西兰花功能性食品、保健品的开发提供了依据。
[1] Bertelli D,Plessi M,Braghiroli D,et al. Separation by solid phase extraction and quantification by reverse phase HPLC of sulforaphane in broccoli[J]. Food Chemistry,1998,63(3):417-421.
[2] Munyaka A W,Oey I,Loey A V,et al. Application of thermal inactivation of enzymes during vitamin C analysis to study the influence of acidification,crushing and blanching on vitam in C stability in broccoli(Brassicaoleracea var. Italica)[J]. Food Chemistry,2010,120(2):591-598.
[3] GliszczyńskaŚw igło A,Ciska E,Paw lakLemańska K. Changes in the content of health-promoting compounds and antioxidant activity of broccoli after domestic processing[J]. International Journal of Molecular Sciences,2006,23(11):7481-7494.
[4] Fahey J W,Zhang Y S,Talalay P. Broccoli sprouts:An exceptionally rich source of inducers of enzymes that protect against chemical carcinoge ns[J]. Proceedings of the National Academy of Sciences,1997,94(19):10367-10372.
[5] M atusheski N V,Juvik J A,Jeffery E H. Heating decreases epithiospecifier protein activity and increases sulforaphane formation in broccoli[J]. Phytochemistry,2004,65(9):1273-1281.
[6] Cover C M,Hsieh S J,Tran S H,et al. Indole-3-carbinol inhibits the expression of cyclin-dependent kinase-6 and induces a G1 cell cycle arrest of human breast cancer cells in dependent of estrogen receptor signaling[J]. Journal of Biological Chemistry,1998,273:3838-3847.
[7] 丁云花,简元才. 具有保健作用的营养蔬菜——青花菜[J]. 中国食物与营养,2003,(9):47-49.
[8] 方秀兵,黄颖丽,徐国英,等. 西兰花总黄酮的制备及体外抗肿瘤活性研究[J]. 江西医药,2013,48(5):397-399.
[9] 陈建福,施伟梅. 响应面法优化纤维素酶辅助提取西兰花总黄酮[J].四川农业大学学报,2014, 32(3):298-304.
[10] 周向军,高义霞,汪之波,等. 响应面法优化西兰花总黄酮提取工艺的研究[J]. 资源开发与市场,2010,(6):488-489.
[11] 陈业高. 植物化学成分[M]. 北京:化学工业出版社,2004.
(责任编辑:成 平)
Optim ized Extraction Technology of flavonoids in Broccoli
LU Ying1,ZHANG Sheng1,LI Hai2,YANG Jing-shi1
(1. College of Horticulture and Landscape, Hunan Agricultural University, Changsha 410128, PRC;2. Changsha Sanfu Bio-tech Co., Ltd , Changsha 410100, PRC)
Taking commercial broccoli as materials, the f rst favonoid content in different parts of broccoli were determ ined; and then took the part of the flower as raw material, the effects of ethanol concentration, material liquid ratio, extraction time and extraction temperature on the extraction result of Flavonoids were investigated, in order to obtain the optimal extraction technology of total favonoids of broccoli were studied by orthogonal test on the basis of single factor. The results showed that the f avonoids content in different parts of broccoli from high to low: fower > stem >leaf; the range analysis of orthogonal test showed that, the effect of factors infuence from high to low: material liquid ratio> ethanol concentration> extraction time> extraction temperature; variance analysis showed that material liquid ratio and ethanol concentration had signif cant inf uence; the best extraction conditions were: ethanol concentration 70%, extraction temperature 85 ℃, material liquid ratio of 1: 30, extraction time 1.5 hour, under the conditions of favonoids extraction amount was 18~20 mg/g, the extract of favonoids content of dry matter was more than 10%.
broccoli; favonoids; extraction; technology optim ization
TS202.3
A
1006-060X(2016)09-0077-04
10.16498/j.cnki.hnnykx.2016.09.022
2016-07-14
湖南省科技厅项目(2015NK3004 )
陆 英(1970-),女,湖南古丈县人,副教授,主要从事植物功能成分分离纯化研究。
张 盛
