西伯利亚红松林下凋落物及土壤真菌组成研究*
2016-10-25晁开瑞任洪婷朱丹璐刘雪峰曹俊平
晁开瑞,任洪婷,朱丹璐,刘雪峰,曹俊平
(1.东北林业大学,黑龙江 哈尔滨150040;2.内蒙古乌审旗林业局森防站,内蒙古 鄂尔多斯017300)
西伯利亚红松林下凋落物及土壤真菌组成研究*
晁开瑞1,任洪婷1,朱丹璐1,刘雪峰1,曹俊平2
(1.东北林业大学,黑龙江哈尔滨150040;2.内蒙古乌审旗林业局森防站,内蒙古鄂尔多斯017300)
从西伯利亚红松土壤、凋落物、根和根际分离到21属真菌,基本反映了西伯利亚红松土壤真菌的种类、组成和优势种群,为西伯利亚红松资源的开发和利用以及西伯利亚红松引种栽培提供了基础资料。
土壤真菌;凋落物;根;根际
西伯利亚红松〔Pinussibirica(Loud.)Mayr〕天然分布于中国新疆的阿尔泰山西北部,面积较小,与西伯利亚落叶松(LarixsibiricaLedeb.)混交,或散生于西伯利亚云杉(PiceaobovataLedeb.)林内。1989年发现大兴安岭有自然分布的西伯利亚红松。自1992年开始,大兴安岭地区从前苏联大规模引种,进行育苗、造林和无性种子园建设等方面的工作,为丰富大兴安岭植物种类、用材林培育和食用松籽栽培等储备了技术[1~2]。经过20多年经营管理,西伯利亚红松人工林林分结构趋于稳定,树龄逐渐增大,对凋落物层、土壤层以及根、根际土壤真菌群落的影响都会比较大。在该地区,对落叶松〔Larixgmelinii(Rupr.) Kuzen〕林、樟子松(Pinussylvestrisvar.mongolicaLitv.)林、白桦(BetulaplatyphyllaSuk.)林等土壤微生物及真菌群落组成等方面研究报道较多[3~4],而对西伯利亚红松林土壤真菌的研究还鲜有报道。在微生物的作用下,凋落物逐渐分解,把养分逐步归还给土壤,可直接影响到森林土壤肥力和土壤理化性质和森林生态系统生产力。西伯利亚红松成林后,林下凋落物层的组成发生了重要改变,凋落物层中混有西伯利亚红松的针叶、球果、树皮等,随之可以降解凋落物层的真菌种类和数量都会发生较大的改变。因此,研究凋落物层和土壤层以及根、根际真菌组成,可对了解西伯利亚红松种植后土壤养分循环、土壤肥力波动和西伯利亚红松人工林生态系统生产力变化提供参考。
1 材料和方法
1.1试验地西伯利亚红松林概况
1990年塔河县林业局引进西伯利亚红松种子育苗,1992年在塔丰经营所107林班造林试验,经过20多年培育长势良好。目前,林分组成除了西伯利亚红松外,还混有天然更新的落叶松、白桦等乡土树种。
1.2土壤和凋落物标本采集方法
样地选在塔河县塔丰林场107林班,在夏初采集凋落物层、腐殖质层和根际土壤标本。在林地随机选3株树,在树的营养根分布区域采集凋落物及土壤标本。
凋落物采集方法凋落物层划分方法参考潘学仁等[5]的方法,将凋落物层分为未分解层(L层)和半分解层(F层)。L层主要特征为叶形完整无缺,质地坚硬,从外表看不出有分解的痕迹(代号DB)。F层主要特征为腐叶层(YC)。所采集标本包在锡纸中,再放到自封袋内,编号。
A0(EC)腐殖质层土壤标本采集方法土壤标本采集参考林先贵[6]方法。除去地面植被和枯枝落叶,并铲除表面1cm左右的表土,避免地面微生物与土样混杂,先取下层,再取中层,放到无菌塑料袋,编号,每袋取50g土壤。
根(G)和根际(GJ)标本采集方法在树冠投影附近,扒开凋落物层,去掉表层土壤,找到植物根系,用消过毒的小铁铲切断植物根系,轻轻抖落根系上的土壤后,放到无菌塑料袋内,编号。
将上述所采集的标本带回实验室,保存于4℃的冰箱内,备用。
1.3土壤和凋落物层真菌分离方法
培养基真菌分离使用加双抗的PDA培养基。
凋落物层样品处理方法将凋落物层中的L层标本和腐叶层F层内的针叶(编号Z)、阔叶(编号K)分开。
土壤样品处理方法由于A0腐殖质层土壤不易区分出植物叶的形状,直接取大约0.5×0.5×0.5cm3土壤小样,参考方中达[7]平板分离土壤真菌的方法。
根和根际样品处理方法当年生的细根,用1︰14漂白粉上清液消毒1min用无菌水反复冲洗3次,然后剪取长大约0.5cm长根段,用无菌吸水纸吸干水分备用。在超净工作台上,根际土壤样品采用抖动方法,抖落西伯利亚红松根上附着的土壤于无菌培养皿中,取大约0.5×0.5×0.5cm3土壤小样。
接种方法将上述处理后的样品接种到PDA培养基上,每皿接种5个接种点,25℃恒温培养箱内倒置培养。
在塔河县塔丰经营所采集的样品分别记录为DBZ、DBK、YCZ、YCK、EC、G、GJ共21样品,分离63个培养皿,共315个分离点。接种后,将培养皿用封口膜密封,在恒温箱中25℃培养。定期观察真菌生长情况。
真菌纯化方法在接种3-5d以后,待菌落长出,在解剖镜下用针尖挑取不同的菌落,接种到PDA培养基中,25℃培养,光照为0级。待长出纯的菌落,保存到斜面中,如不纯再转接到新的平板中继续纯化。
1.4土壤真菌鉴定方法
经过2-3周培养后,平板上纯化的真菌在散射光刺激和室温变温条件作用下,陆续产生有性或无性孢子,这时挑取少许菌落,放在载玻片上,制成水载片,在光学显微镜下观察,测量子实体大小及孢子大小等分类特征,参考相关文献[8~11]将真菌鉴定到属。
1.5土壤真菌统计
统计西伯利亚红松土壤真菌的种类及在不同培养皿中出现的菌落数,并选择出现分离率最高的种类作为优势种群。
分离率=该属真菌出现次数/分离点数×100%,出现率=该属真菌出现的皿数/总皿数×100%。
2 结果与分析
2.1塔河西伯利亚红松林凋落物和土壤真菌群落组成
从塔河西伯利亚红松林下凋落物、土壤和根及根际真菌共分离到子囊菌1属,半知菌18属,接合菌2属,共计21属,分属5目5科,见表1。

表1 塔河西伯利亚红松林凋落物、土壤和根及根际真菌的群落组成
从塔河西伯利亚红松人工林凋落物、土壤和根及根际真菌分离中,一共选取3个样株进行取样,每个样地群都取其根际土壤和非根际土壤及凋落物等各7个样品,每个样品都重复3个培养皿,每个培养皿中共5个分离点,共63个培养皿,315个分离点。分离鉴定出真菌21个属。其中,青霉属(Pencillium)、木霉属(Trichoderma)、拟青霉属(Paecilomyces)、曲霉属(Aspergillus)、无枝孢属(Acladium)、枝顶孢属(Acremoniums)、Calcarisporiella、端二毛孢属(Discosia)、基细隔孢属(Ulocladium) 、节丛孢属(Arthrobotrys)、孔球孢属(Gilmaniella)、轮枝霉属(Veticillium)、小新月孢属(Harposporella)、粘帚霉属(Gliocladium)、指孢属(Dactylaria)、镰刀菌属(Fusarium)、周刺座霉 属(Volutella)、丝核菌属(Rhizoctonia)属于丝孢纲(Hyphomycetes)中的丝孢目(Hyphomycetales)、瘤座孢目(Tuberculariales)和无孢目(Agonomycetales ),而毛霉属(Mucor)、犁头霉属(Absidia)2个属属于接合菌纲(Zygomycetes)的毛霉目(Mucorales),棒囊壳属(Corynascus)属于子囊菌中的核菌纲(Pyrenomycetes)炭角菌目(Xylariales)。说明西伯利亚红松土壤真菌中大多数的种类都集中在丝孢菌纲里,其次是接合菌纲,最少的则是子囊菌核菌纲。
在PDA培养基上,从塔河西伯利亚红松土壤及凋落物中分离出来的菌落数量最多的是木霉属,菌落数是183个菌落,分离率为58.09%,按平板为单位的出现率为95.24%,是绝对的优势种;其次是枝顶孢属,分离到33个菌落,分离率为10.48%,按平板为单位的出现率为22.22%;第三位是棒囊壳属,菌落数是25个菌落,分离率为7.94%,按平板为单位的出现率为11.11%;分离出来最少的菌落则是曲霉属、小新月孢属、丝核菌属和周刺座霉属4个属,菌落数都为1个,数量百分比都为0.32%。结果见表2。
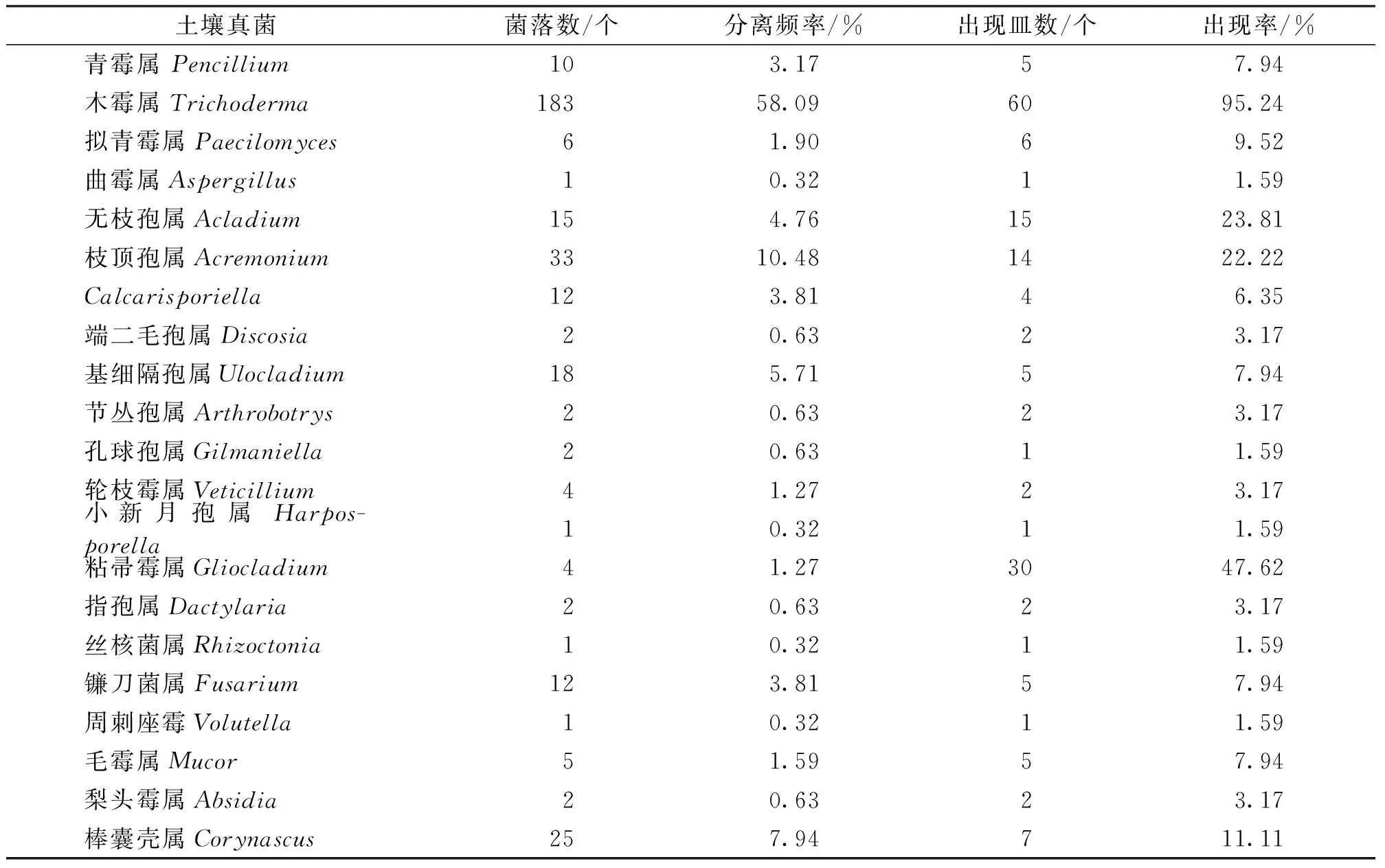
表2 西伯利亚红松凋落物和土壤真菌分离结果
2.2塔河西伯利亚红松凋落物层真菌群落组成
由表3可知,从凋落物L层阔叶落叶上分离到的真菌较丰富,共分离到13个属的真菌,其中,丝孢菌纲中的丝孢目10个属,瘤座菌目1个属和无孢目1个属,毛霉属是属于接合菌纲的毛霉目的真菌。从凋落物L层针叶落叶上共分离到11个属,其中,丝孢菌纲中的丝孢目8个属,瘤座菌目1个属,接合菌纲的毛霉目的真菌2个属。西伯利亚红松凋落物L层中真菌总共有14属,共有属 10个属,说明在属的水平上凋落物L层针叶和阔叶真菌组成差异不大。

表3 凋落物L层真菌分离结果
由表4可知,从凋落物F层阔叶落叶上分离到10个属的真菌,其中,丝孢菌纲中的丝孢目8个属,瘤座菌目1个属和接合菌纲的毛霉目1个属。从凋落物F层阔叶针叶上分离到8个属的真菌,其中,丝孢菌纲中的丝孢目7个属,瘤座菌目1个属,接合菌和子囊菌没有分离到。F层共分离到真菌12属,共有属6个,凋落物F层中的真菌中大多数的种类都集中在丝孢菌纲里,其次是接合菌纲的毛霉属,没分离到子囊菌种类。
从凋落物F层共分离到12个属的真菌(表4),比L层少1个属。但是L层与F层在真菌组成上有较大的不同,这两层共有属6属。主要由各层的所含有的物质差异引起的,L层为当年落地的针叶、阔叶组成,而F层已经被微生物初步分解过部分物质,植物叶的形态结构还没有完全被破坏,这些材料上的营养可以被新的一类真菌所利用。
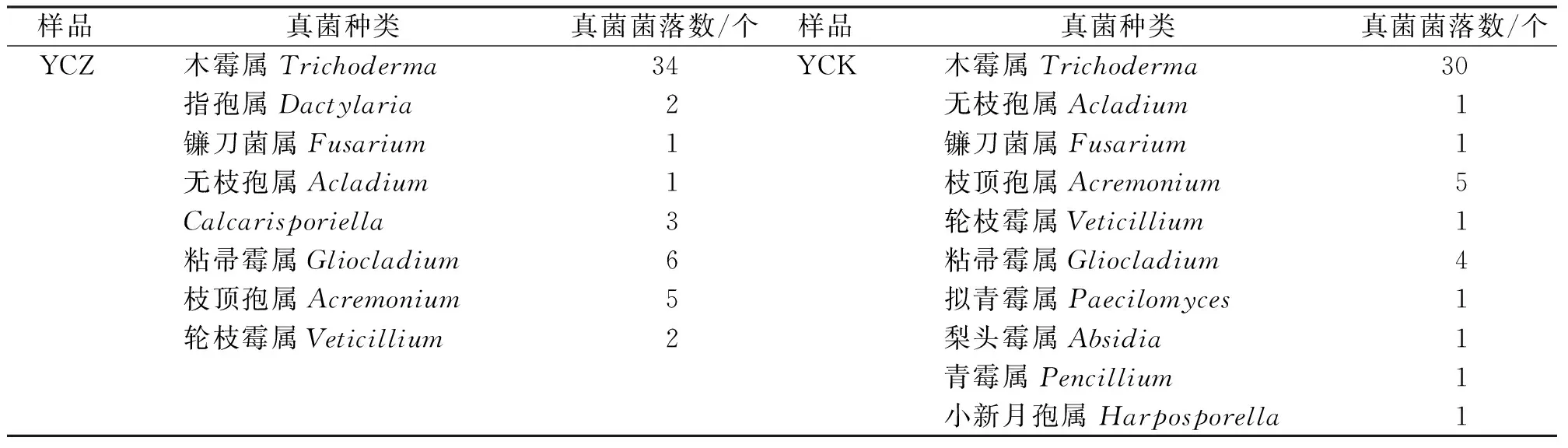
表4 凋落物F层真菌分离结果
2.3塔河西伯利亚红松A0层土壤真菌组成
由表5可知,从塔河西伯利亚红松A0层土壤中分离到真菌5属,种类比凋落物层分离到的真菌显著减少,其中,丝孢菌4属,子囊菌1属,接合菌没有分离到。A0层土壤真菌分离到的数量较凋落物L层、F层都少,初步认为可能与分离的样品数量少有关,还与分离采用的培养基单一和培养条件不十分适宜其他真菌的生长发育有关。
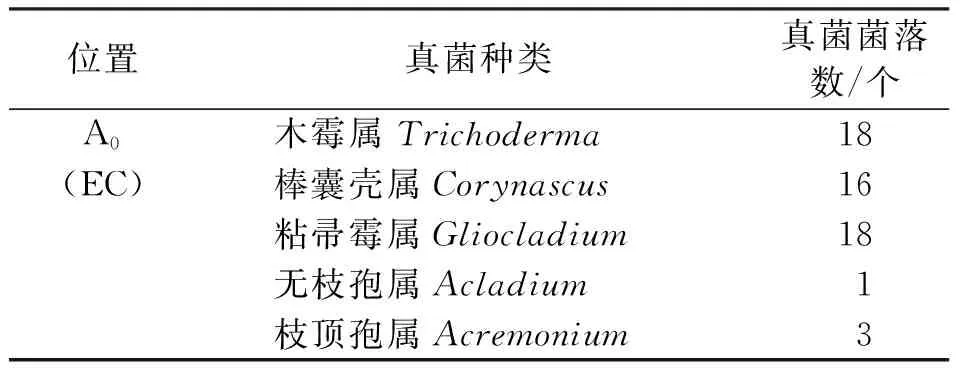
表5 A0层真菌分离结果
2.4塔河西伯利亚红松根和根际真菌群落组成
由表6可知,从西伯利亚红松根际分离到真菌9属,较土壤A0层中真菌丰富。其中,丝孢菌纲中的丝孢目6个属,毛霉属和犁头霉属于接合菌纲的毛霉目的真菌,棒囊壳属为子囊菌。根部真菌组成以丝孢菌为主。
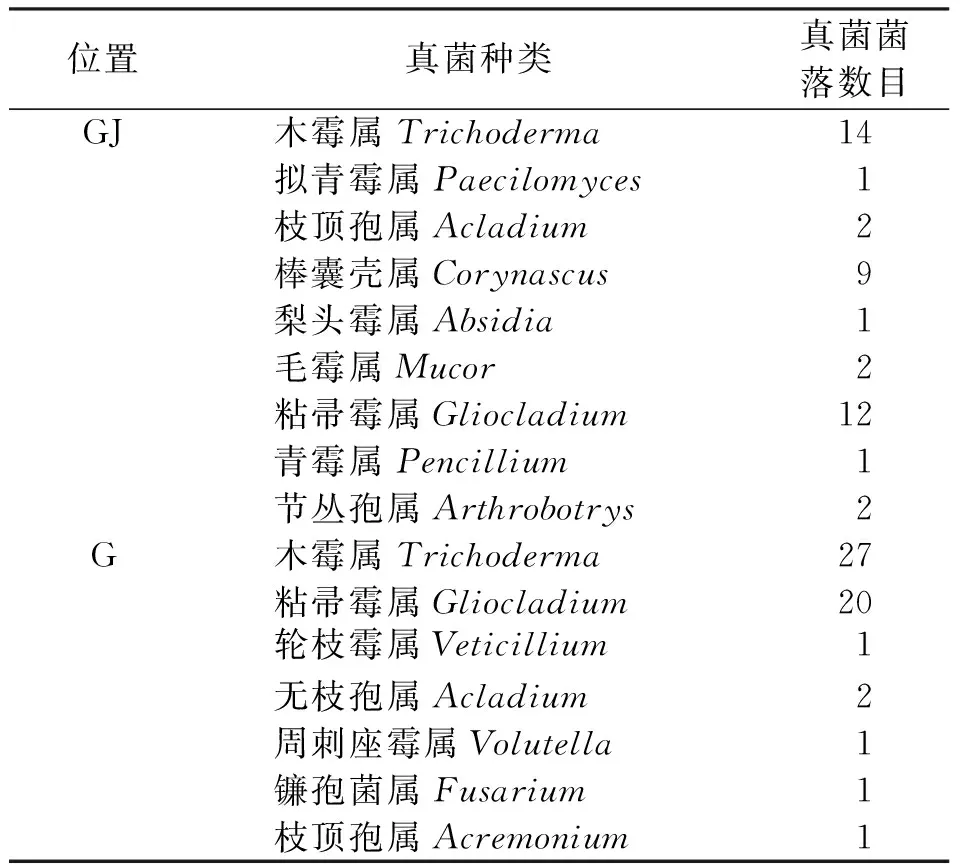
表6 根和根际真菌分离结果
从西伯利亚红松根部分离到真菌7属,较土壤根际真菌减少2属。都是丝孢菌纲种类,丝孢目5个属,瘤座菌目2个属。接合菌和子囊菌种类没分离到。根际与根部真菌相比较差异还是较大的,共有属有3个,为木霉属、枝顶孢属和粘帚霉。根际真菌相对根部真菌略多,但组成差异较大。由于植物根在生长发育过程中向根际分泌多种酶、有机酸等化学物质,这些物质可以促进根对土壤中营养的分解和利用,与此同时,根际土壤中的微生物种类和数量也会大幅度增加。因此,西伯利亚红松的根部真菌类群的组成与根际真菌组成上的差异是必然。
3 结论与讨论
3.1结论
采集塔河县塔丰林场西伯利亚红松土壤、凋落物和根标本,经室内分离培养,根据形态特征鉴定,结合相关资料整理,对西伯利亚红松土壤真菌进行了初步研究,得出如下结论。
从塔河西伯利亚红松林下凋落物、土壤和根及根际真菌共分离到21属。其中,子囊菌1属,半知菌18属,接合菌2属。初步反映了塔河西伯利亚红松土壤真菌的组成,为深入研究西伯利亚红松在中国东北地区大面积人工造林和森林生态建设等提供了参考。
西伯利亚红松林下凋落物层、土壤层和根及根际真菌优势种不同,按分离统计结果来划分,排在第一位的优势属都为木霉属,排在第二位的优势属在各层中有所不同。在L层阔叶中优势真菌排第二位的为枝顶孢属,针叶中的为毛霉属;F层针叶排第二位的为粘帚霉属,阔叶的为枝顶孢属;A0层优势种为木霉属和粘帚霉属,排第二的是棒囊壳属;根和根际真菌排第二位的是粘帚霉属。A0层、根和根际真菌优势种的组成是相同的。凋落物层真菌最丰富、数量最多,A0层真菌数量最少,只有5属。
3.2讨论
西伯利亚红松人工林中混生白桦、杨树(Populusspp.)等阔叶树,在凋落物新鲜L层(代号DB)和腐叶层F层(YC)针叶中混有阔叶。由于阔叶和针叶的组织结构和化学成份不同,因此,以这些阔叶和针叶为营养和能量来源的真菌自然不会相同,可以降解这些阔叶和针叶真菌在种类和数量上必然会存在较大的差异。落地的针叶自然降解速度慢,落地的阔叶自然降解速度快,针叶、阔叶被降解后能提供给植物的营养物质也有较大的差别。
从西伯利亚红松土壤、根和根际及其凋落物中分离到的真菌中,有的是潜在病原菌,有些种类曾经被记载为重要的植物病原菌。如引起多种植物枯萎病的镰刀菌属、轮枝霉属等。对这些真菌应该引起高度重视,及时发现和避免它们造成大的经济损失。西伯利亚红松凋落物层分离到较多镰刀菌属,主要是因为它们可以产生果胶酶和纤维酶等物质,将凋落物层的纤维素分解掉,利于其他微生物的利用;有些镰刀菌还可以产生赤霉素,赤霉素是一种可以使农作物增产的植物激素,还有些种类产生毒素。因此,这些镰刀菌对西伯利亚红松生长发育及土壤肥力的有怎么样的影响,还需要做进一步的研究。还有些种类可用于开发植物病害生物防治制剂。如木霉属现在已经开发出了可以防治植物根部、枝干病害的生物农药。节丛孢属真菌主要以捕食的方式寄生在线虫体上。在根结线虫、蘑菇线虫的生物防治方面开发出了系列产品。
本次试验样本量偏低,采用的培养基种类也少,所以得到的研究结果不能完全反映出西伯利亚红松林凋落物和土壤真菌的组成,建议扩大采集标本采集的范围,注意采集不同林龄、立地条件、季节和造林密度的标本,更全面地体现出该人工林下的真菌种群的组成。
[1]刘桂丰,杨传平,赵光仪.珍贵树种西伯利亚红松引进的可行性[J].应用生态学报,2002,13(11):1483- 1486.
[2]王成.西伯利亚红松引种与种源试验研究[D].哈尔滨:东北林业大学,2011.
[3]徐文煦,王继华,张雪萍,等.大兴安岭森林土壤微生物生态分布研究[J].哈尔滨师范大学学报(自然科学版):2009,25(1):67-70.
[4]姜海燕,闫伟,李晓彤,等.大兴安岭不同落叶松林植被土壤微生物多样性[J].微生物学通报,2010,37(2):186-190.
[5]潘学仁,黄永青,刘传照.枫桦红松林凋落物分解真菌生态群的研究[J].东北林业大学学报,1991,19(1):75-82.
[6]林先贵.土壤微生物研究原理与方法[M].北京:高等教育出版社,2010:31.
[7]方中达.植病研究法(第三版)[M].北京:中国农业出版社,1998:133.
[8]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[9]巴尼特.亨特.半知菌属图解[M].北京:科学出版社,1977.
[10]Kiffer E,and Morelet M.The deuteromycetes mitosporic fungi:classification and generic keys[M].Science Publisher Inc.,2000.
[11]KH Domsch,W Gams & TH Anderson.Compendium of soil Fungi[M].Lundon:Academic Press,1980.
Fungal Community and Litter Composition in Pinus sibirica Forest
CHAO Kai-rui1,REN Hong-ting1,ZHU Dan-lu1,LIU Xue-feng1,Cao Jun-ping2
(1.Northeast Forestry University,Harbin Heilongjiang 150040,P.R.China;2.Forest Pest Management and Quarantine Station of Wushen Country,Ordos Inner Mongolia 017300,P.R.China)
21 genus fungus from the soil,litter,root and rhizosphere inPinussibiricaforest were isolated in this study.This provides basic data for the exploiting and sustainable use of natural resources,and
for the introduction and cultivation ofPinussibirica.
soil fungi;litter;root;rhizosphere
10.16473/j.cnki.xblykx1972.2016.03.012
2015-12-28
晁开瑞(1987-),男,硕士研究生,主要从事森林病理研究。E-mail:980246668@qq.com
简介:刘雪峰(1963-),男,研究员,硕士生导师,主要从事森林病理研究。E-mail:liuxue feng63@sina.com
S 763
A
1672-8246(2016)03-0069-06
