环境温度和繁殖经历对黑线仓鼠哺乳期能量收支的影响
2016-10-24王桂英赵志军
曹 静,王桂英,赵志军,*
1 温州大学生命与环境科学学院,温州 325035 2 聊城大学农学院,聊城 252059
环境温度和繁殖经历对黑线仓鼠哺乳期能量收支的影响
曹静1,王桂英2,赵志军1,*
1 温州大学生命与环境科学学院,温州325035 2 聊城大学农学院,聊城252059
为探讨环境温度和繁殖经历对黑线仓鼠哺乳期能量收支的影响,将连续3次繁殖的黑线仓鼠暴露于温度梯度降低的条件下(30—0℃,1℃/4d),使初次、第2和3次繁殖的动物分别暴露于30—20℃、20—10℃、10—0C℃,测定了哺乳期能量收支。与初次繁殖的动物相比,第3次繁殖组动物的摄食量显著增加,静止代谢率、非颤抖性产热、褐色脂肪组织细胞色素c氧化酶(COX)活性和血清T3水平显著增加,而断乳时胎仔重显著降低。结果表明:(1)低温下繁殖的黑线仓鼠处于负能量平衡,在自身维持和哺育后代的能量分配之间存在权衡,低温下产热增加,繁殖输出减少;(2)黑线仓鼠可能感知环境温度的变化,在连续降低温度的条件下降低繁殖投资,符合“季节性投资假说”的预测。
能量收支;繁殖;季节性投资;黑线仓鼠;产热
小型哺乳动物的生存和繁殖受环境温度的影响[1-4]。温度降低会使动物的能量需求增加,低温下繁殖的动物,能量需求会进一步增加,母体在满足后代生长发育能量需求的同时,还需额外的能量支出用于产热,以维持恒定体温[4-6]。
然而,环境温度与繁殖之间的关系并非如此简单。许多季节性繁殖的动物往往会选择温度较低的早春启动繁殖,在气温较高的盛夏停止繁殖[7]。原因在于,在春天出生的后代在冬季来临之前有足够的时间发育成熟,并能生产下一代,因此繁殖价值(reproductive value)较高。相反秋季出生的后代可能没有足够的时间在冬季来临之前达到性成熟,因而繁殖价值降低[7- 8]。野生小型哺乳动物也许能够感受其繁殖价值的季节性变化,从而表现出选择性的繁殖投资,即“季节性投资假说(the seasonal investment hypothesis)[7- 9]。动物如何感受环境条件的季节性变化,进而决定其“季节性投资”,尚不清楚。环境温度具有季节性变化的特点。有研究报道,温度与动物的繁殖投资存在负相关关系,比如温暖条件下(30℃)布氏田鼠(Lasiopodomysbrandtii)[4,10]和MF1小鼠 (Musmusculus)[2-3]繁殖输出低于寒冷条件下(5℃、8℃)繁殖的动物。但动物是否能够感知环境温度的变化,进而决定其选择性的繁殖投资,尚不明确。
黑线仓鼠(Cricetulusbarabensis)广泛分布于我国北方和中原地区,是主要的农田和草原啮齿类物种之一。栖息地环境温度具有显著的季节性变化,以2009—2010年河北石家庄地区农田为例,年平均温度13.4℃,夏季气温较高(7月日均最高温为33.3℃),冬季寒冷(1月日均最低温为-6.5℃)(2009—2010年河北省气象局发布数据)。黑线仓鼠的繁殖具有季节性,每年3—4月份开始繁殖,一年可产3—5胎[11]。该鼠种群数量呈现季节性波动,一般有两次高峰,前峰在3—6月,后峰在10—11月。各季节的气候因子,如气温、降水、食物等变化对种群数量的波动具有重要影响,繁殖与种群数量动态存在极为密切的关系[11]。室温条件下该鼠的繁殖和生长发育特征已有研究[12-15]。环境温度是影响繁殖期能量收支的重要因子,与室温条件下繁殖的动物相比,低温驯化(5℃)使产热增加,但使哺乳末期幼体重量显著降低[16]。故此,研究环境温度的变化与黑线仓鼠繁殖投资的关系将有助于深入理解小型哺乳动物的繁殖策略,检验“季节性投资假说”。本研究将连续3次繁殖的黑线仓鼠暴露于连续降低的温度条件下(30—0℃),测定哺乳高峰期能量摄入、产热和繁殖输出。我们预测随着环境温度的降低,黑线仓鼠的能量摄入增加,产热增加,胎仔数和胎仔重降低。该鼠可能通过感受环境温度的变化,决定其选择性的“繁殖投资”。
1 材料和方法
1.1实验动物
黑线仓鼠于2008年捕于河北省深泽县农田(东经115°13′,北纬38°12′),饲养于聊城大学实验动物房,温度为(21 ± 1)℃,光照为12L∶12D,喂以标准鼠饲料(北京科奥协力饲料有限公司生产),可自由饮水。用于实验的动物来自室内繁殖的后代。取2.5 — 3.5月龄健康雌性黑线仓鼠135只(均为处女鼠),30℃ 条件下适应4周,然后放入成年雄鼠,妊娠雌鼠分娩前分离雄鼠,共有62只雌鼠妊娠、分娩和哺乳,随机选取12只测定能量收支等参数,作为初次繁殖组(Lac 1,n=12),在放入雄鼠交配之日起,逐渐降低环境温度(1℃/4d),使初次繁殖的母体及后代暴露于30—20℃。其余50只在断乳2周后再与雄鼠配对,39只雌鼠妊娠、分娩和哺乳,选取11只测定能量收支,作为二次繁殖组(Lac 2,n=11);逐渐降低环境温度(1℃/4d),使第2次繁殖暴露于20—10℃。其余28只在断乳2周后再与雄鼠配对,12只雌鼠妊娠、分娩和哺乳,再选取6只作为第3次繁殖组(Lac 3,n=6),第3次繁殖暴露于10—0℃。所有繁殖组幼体均在哺乳期第17天断乳。
1.2体重和摄食量
哺乳期第7天至断乳,每日测定母体体重、窝胎仔数和胎仔重量。以添加饲料块重量扣除次日剩余量和饲养笼内残渣量计算每日摄食量。哺乳期第15—17天摄食量的平均值作为哺乳期最大持续摄食量。
1.3静止代谢率(RMR)和非颤抖性产热(NST)
断乳后,以封闭式流体压力呼吸计测定动物的RMR[17]。RMR测定温度为(29±1)℃(热中性区温度为27.5 —32.9℃)[18],水浴控温(± 1℃)。测定前动物饥饿3 h,在呼吸室内适应1 h,待动物稳定后,每隔5 min记录1次,连续测定60 min。选取2个连续稳定的最低值计算RMR(mL O2/h)。NST采用皮下注射去甲肾上腺素(NE)诱导,根据NE(mg/kg)=6.6×Mb-0.458(g)[19]计算NE剂量,测定温度为(25±1)℃[20],注射NE后连续测定60min,每隔5 min记录1次,选取2个连续稳定的最高值计算NST。RMR和NST均校正到标准状态下(101.325kPa (1个大气压),0℃)。
1.4褐色脂肪组织(BAT)细胞色素 c 氧化酶(COX)活性
处死动物后,快速分离肩胛部BAT置于液氮中,然后转移至超低温冰箱中贮存备用。待所有样品收完毕,提取BAT线粒体蛋白[21]。用分光光度计测定线粒体蛋白浓度,以牛血清蛋白作为标准蛋白。COX活性采用氧电极法(Oxytherm Electrode System,Hansatech公司)测定。反应杯温度30℃,反应液体积2mL,其中包括20μL样品、20μL细胞色素c和1.96mL基质液[21]。
1.5甲状腺激素(T3、T4)和催乳素
NST测定次日(9:00—11:00),断颈处死动物,取血,自然凝集2 h,离心(3500r/min)10min,吸血清于离心管中,保存于冰箱中(-20℃)备用。待所有样品收完毕,用放射性免疫试剂盒测定血清T3、T4和催乳素含量(北京北方生物技术研究所),批内和批间测定的变异系数分别小于10%。
1.6身体脂肪
去除内脏各器官和消化道后记录动物胴体鲜重,然后置于烘箱中,60℃烘至恒重,记录胴体干重(精确至0.001g)。以索式抽提法测定烘干胴体的体脂含量,表示为体脂重量占胴体干重的百分比[22]。
1.7统计分析
数据处理采用SPSS 13.0软件包。哺乳期体重、摄食量、胎仔数和胎仔重的变化采用重复测量方差分析法(RM-ANOVA)进行分析;初次、第2和3次繁殖组的体重、摄食量、T3、T4和催乳素、BAT COX活性、脂肪含量的组间差异以单因素方差分析法(one way-ANOVA)进行分析。RMR和NST以协方差分析法(ANCONA)进行分析(以体重为协变量)。摄食量、RMR、NST、胎子数、胎仔重之间的关系以偏相关分析法进行统计分析(去除体重或胎仔数的影响)。数据全部表示为平均值±标准误(Mean ± SE);P≤0.05表示差异显著(双尾检验),P≤0.01表示差异极显著。
2 结果
2.1体重
初次、第2和3次繁殖的哺乳初期母体体重分别为(29.5±0.4)g、(30.8±0.4)g和(28.6±0.6)g,第3次繁殖组比第2次繁殖组低7.1%,组间差异显著(第7天,F2,114=3.47,P<0.05,图1)。哺乳期体重显著降低,初次、第2和3次繁殖组断乳时体重与哺乳初期相比分别降低了12.4%、12.3%和13.5%。断乳时组间差异显著,第3次繁殖组体重显著低于第2次繁殖组(第17天,Lac 1, (25.9±0.4)g; Lac 2, (27.0±0.4)g; Lac 3, (24.8±0.6)g;F2,114=3.43,P<0.05,图1)。

图1 连续降温和繁殖经历对黑线仓鼠体重、摄食量、胎仔数和胎仔重的影响Fig.1 Body mass, food intake, litter size and litter mass in striped hamsters throughout three bouts of lactation after being exposed to the decreases in temperatureLac 1、2和3为初次繁殖、第2和3次繁殖;柱上不同字母表示差异显著(P<0.05);**哺乳初期和末期差异极显著(P<0.01)
2.2摄食量
哺乳初期,初次、第2和3次繁殖组的摄食量组间差异显著,第3次繁殖组显著高于初次和第2繁殖组(第7天,F2,114=30.80,P<0.01,Post hoc,P<0.05,图1)。哺乳期摄食量显著增加,初次、第2和3次繁殖组哺乳末期较初期分别增加了73.4%、59.9%和55.2%,组间差异显著(第17天,F2,114=3.63,P<0.05)。哺乳高峰期最大持续摄食量分别为(12.9±0.2)g、(13.8±0.2)g和(14.9±0.4) g/d,第3次繁殖组比初次、第2次繁殖组分别高7.0%和14.0%,组间差异显著(F2,114=9.35,P<0.01)。
2.3胎仔数和胎仔重
初次、第2和3次繁殖组的哺乳初期胎仔数分别为4.4±0.1、4.4±0.2和4.3±0.4,组间差异不显著(第7天,F2,114=0.06,P>0.05,图1)。哺乳期间胎仔数未出现显著变化,断乳时胎仔数间差异未达到显著水平(第17天,F2,114=0.98,P>0.05)。哺乳初期胎仔重组间差异显著,第3次繁殖组比初次、第2次繁殖组分别低15.1%和18.2%(第7天,F2,114=3.90,P<0.05,图1)。哺乳期间胎仔重显著增加,初次、第2和3次繁殖组哺乳末期胎仔重比哺乳初期分别增加了141.4%、115.6%和114.7%(第7—17天,Lac 1,F10,610=892.94,P<0.01; Lac 2,F10,420=417.09,P<0.01; Lac 3,F10,110=152.13,P<0.01)。断乳时,胎仔重分别为(41.8±1.0)g、(38.8±1.3)g和(31.6±2.2)g,第3次繁殖组比初次、第2次繁殖组分别低24.5%和18.6%,组间差异显著(第17天,F2,114=8.09,P<0.01)。哺乳高峰期摄食量与断乳时胎仔数(R2=0.16,P<0.01,图2)和胎仔重(R2=0.11,P<0.05,图2)显著正相关。
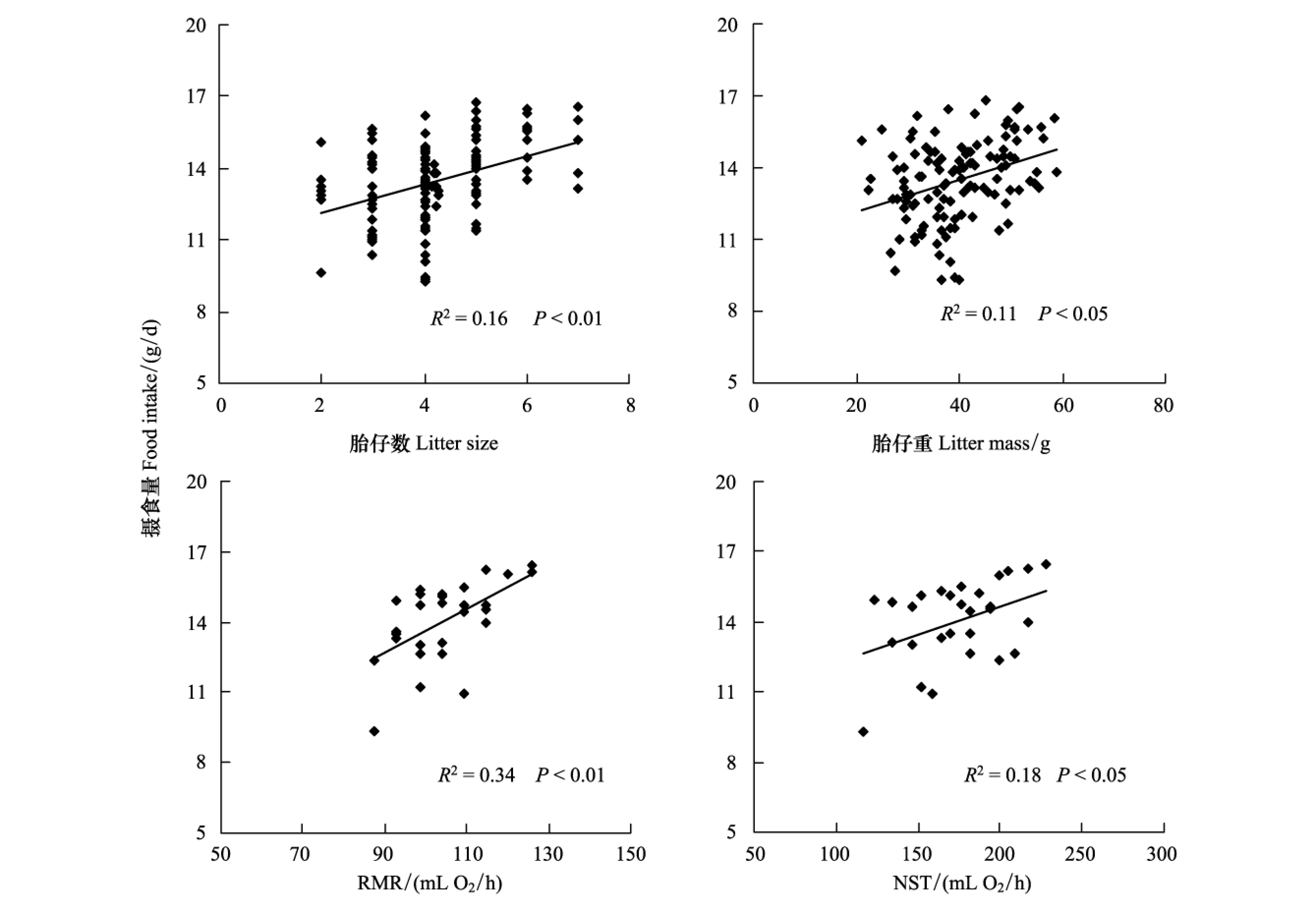
图2 连续降温的条件下连续3次繁殖的黑线仓鼠哺乳高峰期摄食量与胎仔数、胎仔重、静止代谢率(RMR)和非颤抖性产热(NST)的相关性Fig.2 Correlations between asymptotic food intake and litter size, litter mass, resting metabolic rate (RMR) and nonshivering thermogenesis (NST) in striped hamsters throughout three bouts of lactation after being exposed to the decreases in temperature
2.4RMR和NST
断乳时RMR组间差异显著,第2和3次繁殖组显著高于初次繁殖组(F2,25=15.25,P<0.01,图3)。NST组间也存在显著差异,第2和3次繁殖组比初次繁殖组分别高24.1%和27.1%(F2,25=15.25,P<0.01,表1)。摄食量与RMR显著正相关(R2=0.34,P<0.01,图2),与NST的相关性也达到了显著水平(R2=0.18,P<0.05,图2)。
2.5BAT COX活性、T3、T4和催乳素
BAT组织总线粒体蛋白COX活性组间差异显著,第3次繁殖组比初次和第2次繁殖组分别高139.7%和65.5%(F2,26=20.66,P<0.01,表1)。血清T3浓度组间差异显著(F2,26=5.57,P<0.01,表1),第3次繁殖组的血清T3浓度比初次繁殖组高47.4%(post hoc,P<0.05),但第2次与初次繁殖组间差异未达到显著水平(post hoc,P>0.05)。血清T4浓度组间差异不显著,但第3次繁殖组T3/T4显著高于初次和第2次繁殖组(表1),与初次繁殖组相比第2和3次繁殖组血清催乳素水平未出现显著变化(表1)。
2.6胴体重和脂肪含量
初次繁殖、第2和3次繁殖组断乳时体重组间差异不显著(表1)。胴体湿重和干重组间也无显著差异。第2、3次繁殖组的身体脂肪含量较初次繁殖组分别降低了12%和28%,但组间差异未达到显著水平(P=0.07,表1)。
表1连续降温和繁殖经历对黑线仓鼠RMR、NST、BAT COX活性、血清T3、T4和催乳素浓度的影响
Table 1Effect of reproductive experiences on RMR, NST, BAT COX activity, concentrations of serum T3, T4and prolactin in striped hamsters after being exposed to the decreases in temperature

组别GroupLac1Lac2Lac3P静止代谢率Restingmetabolicrate,RMR/(mLO2/h)97.1±1.9b107.4±2.6a115.8±3.6a**非颤抖性产热Nonshiveringthermogenesis,NST/(mLO2/h)151.4±6.5b187.9±5.6a202.2±9.8a**胴体Carcass湿重Wetmass/g17.4±0.516.7±0.515.2±0.5ns干重Drymass/g6.6±0.26.4±0.36.1±0.2ns脂肪含量Bodyfatcontent/%27.8±2.224.4±1.820.1±2.1nsBATCOX活性BATCOXactivity(nmolmg-1min-1)75.4±7.978.2±5.594.7±5.2ns(nmol/min)23.8±2.9b34.5±3.1b57.1±4.6a**甲状腺激素ThyroidhormoneT3/(ng/mL)1.07±0.07b1.23±0.10ab1.58±0.13a**T4/(ng/mL)38.2±1.836.7±2.431.3±2.8nsT3/T40.029±0.003b0.035±0.004b0.053±0.007a**催乳素Prolactin/(U/mL)168.6±7.7178.3±10.2182.3±13.9ns
BAT COX: 褐色脂肪组织细胞色素c氧化酶活性;Lac 1、2和3,初次繁殖、第2和3次繁殖;ns,差异不显著,**P<0.01
3 讨论
小型哺乳动物繁殖是一个复杂而耗能的过程,哺乳期是整个繁殖期能量需求最高的阶段,动物一般通过动用身体的能量贮存和增加摄食量以满足繁殖期增加的能量需求[15,23-24]。可以发现,哺乳期黑线仓鼠摄食量显著增加,体重显著降低,这与以前的研究结果相似[15,25]。随着环境温度的降低,哺乳高峰期黑线仓鼠的摄食量进一步增加,在10—0℃条件下第3次繁殖组的最大持续摄食量比30—20℃下初次繁殖、20—10℃第2次繁殖组分别高7.0%和14.0%。Zhao也发现,低温下(5℃)初次繁殖的黑线仓鼠摄食量比室温(23℃)和暖温下(30℃)繁殖的动物高11.4%[16]。低温暴露也使哺乳期布氏田鼠[4]、拉布拉多白足鼠(Peromyscusmaniculatus)[1]、MF1小鼠[2]摄食量进一步增加。这些研究结果表明,小型哺乳动物的哺乳期能量摄入受环境温度的影响显著。低温下哺乳的动物需要增加摄食量以应对低温与哺乳后代的双重能量需求[1,2,4]。
研究发现,随着环境温度的降低,黑线仓鼠的繁殖输出显著减少,第3次繁殖(10—0℃)组的胎仔重比第2次繁殖(20—10℃)和初次繁殖组(30—20℃)分别降低24.5%和18.6%。Zhao研究发现,室温条件下连续4次繁殖的黑线仓鼠哺乳期能量摄入和繁殖输出未发生显著变化[26],表明不同繁殖经历的黑线仓鼠的繁殖能力相似。因此,低温条件下第3次繁殖组繁殖输出显著降低的原因,可能与动物自身的繁殖能力无关,而主要受环境温度的影响,即连续降低环境温度可能是导致繁殖输出显著降低的主要原因。然而,Krol等发现暖温(30℃)下繁殖的MF1小鼠的泌乳能量支出比室温组(21℃)相比降低了48%,低温(8℃)却显著增加了泌乳能量支出,与室温组相比增加了73%,表明繁殖输出与环境温度呈负相关关系,暖温抑制繁殖输出,低温暴露促进繁殖输出[3]。黑线仓鼠一般会在早春启动繁殖在3—4月份进入第一个繁殖高峰,经过炎热的夏季,第2次繁殖高峰一般在9月份[11]。因此在第2次繁殖期,动物必然要经历环境温度的下降过程[11,14, 27- 28]。“季节性投资假说”认为野生小型哺乳动物能够感受繁殖价值的季节性变化,繁殖的季节越早其繁殖价值越高,而晚出生的后代由于在冬季来临之前没有足够的时间达到性成熟而繁育下一代,因而繁殖价值降低[7- 9]。研究表明,黑线仓鼠可能感受到降低的环境温度,从而减少繁殖输出,与“季节性投资假说”的预测一致。季节性繁殖的野生小型哺乳动物或许能够通过环境温度的变化,感受时间的季节性,进而调节对后代的繁殖投资。
低温暴露使动物的能量需求增加。发现随着环境温度的降低,黑线仓鼠RMR和NST显著增强,第2和3次繁殖组NST比初次繁殖组分别高24.1%和27.1%。BAT COX活性和血清T3水平也显著增加,表明低温下繁殖的黑线仓鼠产热增加。与本研究相似,低温暴露是初次繁殖的黑线仓鼠哺乳高峰期产热增加[16];低温下繁殖的其他啮齿类动物与室温或者暖温下繁殖的动物相比,代谢产热增加,如布氏田鼠[4]、金色中仓鼠(Mesocricetusauratus)[5]、MF1小鼠[2-3]。这些结果表明,小型哺乳动物在繁殖期面临低温环境时,需要额外的能量支出,用于产热,从而维持恒定的体温调节,但这可能导致了用于哺乳后代的能量支出减少,繁殖输出降低[16]。动物自身维持的能量支出和繁殖输出之间存在权衡[15,29]。尽管发现低温下第3次繁殖的黑线仓鼠进一步增加摄食量,但似乎不足以弥补产热的能量支出。在负能量平衡的条件下,降低繁殖输出也许是动物的一种适应性调节的繁殖策略。黑线仓鼠可能通过感受环境温度的降低,增加代谢产热,以维持体温恒定;也可能通过温度的变化,感受时间的季节性变化,在连续降低环境温度的条件下降低繁殖投资。研究结果支持小型哺乳动物繁殖的“季节性投资”假说。
4 结论
在环境温度连续降低的条件下(30—0℃),黑线仓鼠连续繁殖3代。哺乳期间摄食量、胎仔重显著增加,体重显著降低。哺乳高峰期摄食量、产热、胎仔重受环境温度的影响显著。与暖温下(30—20℃)下初次繁殖的动物相比,低温下(10—0℃)第3次繁殖组的摄食量显著增加, RMR、NST、BAT COX活性和血清T3水平显著增加,而断乳时胎仔重显著降低。结果表明,黑线仓鼠面临低温与哺乳后代的双重能量需求,低温下繁殖的黑线仓鼠处于负能量平衡,在自身维持和哺育后代的能量分配之间存在权衡,低温下产热增加,繁殖输出减少;黑线仓鼠可能感知环境温度的变化,在连续降低温度的条件下降低繁殖投资,符合“季节性投资假说”的预测。
[1]Hammond K A, Kristan D M. Responses to lactation and cold exposure by deer mice (Peromyscusmaniculatus). Physiological and Biochemical Zoology, 2000, 73(5): 547- 556.
[2]Kròl E, Speakman J R. Limits to sustained energy intake VI. Energetics of lactation in laboratory mice at thermoneutrality. The Journal of Experimental Biology, 2003, 206(23): 4255- 4266.
[3]Kròl E, Speakman J R. Limits to sustained energy intake VII. Milk energy output in laboratory mice at thermoneutrality. The Journal of Experimental Biology, 2003, 206(23): 4267- 4281.
[4]Zhang X Y, Wang D H. Thermogenesis, food intake and serum leptin in cold-exposed lactating Brandt′s volesLasiopodomysbrandtii. The Journal of Experimental Biology, 2007, 210(3): 512- 521.
[5]Garton D W, Hsu M J, Harder J D. Environmental temperature and metabolic rates during gestation and lactation in golden hamsters (Mesocricetusauratus). Physiological Zoology, 1994, 67(2): 496- 514.
[6]Speakman J R. 小型啮齿动物的繁殖能量代价. 兽类学报, 2007, 27(1): 1- 13.
[7]Speakman J R, Król E. Limits to sustained energy intake IX: a review of hypotheses. Journal of Comparative Physiology B, 2005, 175(6): 375- 394.
[8]Lambin X, Yoccoz N G. Adaptive precocial reproduction in voles: reproductive costs and multivoltine life-history strategies in seasonal environments. Journal of Animal Ecology, 2001, 70(2): 191- 200.
[9]Koivula M, Koskela E, Mappes T, Oksanen T A. Cost of reproduction in the wild: manipulation of reproductive effort in the bank vole. Ecology, 2003, 84(2): 398- 405.
[10]Wu S H, Zhang L N, Speakman J R, Wang D H. Limits to sustained energy intake. XI. A test of the heat dissipation limitation hypothesis in lactating Brandt′s voles (Lasiopodomysbrandtii). The Journal of Experimental Biology, 2009, 212(21): 3455- 3465.
[11]张知彬, 王祖望. 农业重要害鼠的生态学及控制对策. 北京: 海洋出版社, 1998.
[12]李玉春, 卢浩泉, 张学栋, 徐文生. 黑线仓鼠的生长指标分析与年龄指标确定. 兽类学报, 1989, 9(1): 49- 55.
[13]杨玉平, 周延林, 张鹏利, 侯希贤, 董维惠. 黑线仓鼠生长发育的研究. 兽类学报, 1996, 16(4): 309- 311.
[14]鲍伟东, 王德华, 王祖望, 周延林, 王利民. 内蒙古库布齐沙地和呼和浩特平原黑线仓鼠种群繁殖特征的比较. 动物学杂志, 2001, 36(1): 15- 18.
[15]赵志军. 黑线仓鼠繁殖输出与基础代谢率的关系. 兽类学报, 2011, 31(1): 69- 78.
[16]Zhao Z J. Energy budget during lactation in striped hamsters at different ambient temperatures. The Journal of Experimental Biology, 2011, 214(2): 988- 995.
[17]Gorecki A. Kalabukhov-Skvortsov respirometer and resting metabolic rate measurement // Grodzinski W, ed. Methods for Ecological Energetics. Oxford: Blackwell Scientific, 1975: 309- 313.
[18]Zhao Z J, Cao J, Meng X L, Li Y B. Seasonal variations in metabolism and thermoregulation in the striped hamster (Cricetulusbarabensis). Journal of Thermal Biology, 2010, 35(1): 52- 57.
[19]Heldmaier G. Nonshivering thermogenesis and body size in mammals. Journal of Comparative Physiology A, 1971, 73(2): 222- 247.
[20]王建梅, 王德华. 不同去甲肾上腺素剂量下布氏田鼠非颤抖性产热比较. 兽类学报, 2006, 26(1): 84- 88.
[21]Zhao Z J, Wang D H. Short photoperiod enhances thermogenic capacity in Brandt′s voles. Physiology & Behavior, 2005, 85(2): 143- 149.
[22]Zhao Z J, Wang D H. Short photoperiod influences energy intake and serum leptin level in Brandt′s voles (Microtusbrandtii). Hormone and Behavior, 2006, 49(4): 463- 469.
[23]刘赫, 王德华, 王祖望. 小型哺乳动物繁殖期的能量收支对策. 兽类学报, 2001, 21(4): 301- 309.
[24]赵志军, 迟庆生, 曹静. 小型哺乳动物的持续能量收支限制研究进展. 动物学杂志, 2009, 44(4): 155- 160.
[25]Zhao Z J, Chi Q S, Cao J. Limits to sustainable energy budget during lactation in the striped hamster (Cricetulusbarabensis) raising litters of different size. Zoology, 2010, 113(4): 235- 242.
[26]Zhao Z J. Energy budget during four successive bouts of lactation in striped hamsters exposed to decreases in ambient temperature. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2011, 160(2): 229- 236.
[27]侯希贤, 董维惠, 杨玉平, 周延林. 呼和浩特地区黑线仓鼠种群动态研究. 动物学研究, 1993, 14 (2): 143- 149.
[28]姜运良, 卢浩泉, 李玉春, 王玉山, 张学栋, 徐文生, 于之庆. 山东阳谷县黑线仓鼠种群数量预测预报. 兽类学报, 1994, 14(3): 196- 202.
[29]赵志军, 曹静, 李路胜. 小鼠基础代谢率与繁殖输出和繁殖期末器官的关系. 动物学杂志, 2010, 45(4): 39- 45.
Effect of consecutive decreases in temperature and reproductive experiences on energy budget during lactation in the striped hamster (Cricetulusbarabensis)
CAO Jing1, WANG Guiying2, ZHAO Zhijun1,*
1CollegeofLifeandEnvironmentalScience,WenzhouUniversity,Wenzhou325035,China2SchoolofLifeScience,LiaochengUniversity,Liaocheng252059,China
Effects of temperature and reproductive experiences on the energy budget of striped hamsters (Cricetulusbarabensis) during lactation were examined in this study. The hamsters were exposed to a gradual decrease in the ambient temperature, from 30℃ to 0℃ throughout three bouts of lactation. The temperature was decreased from 30℃ to 20℃ during the 1stlactation period, and similarly, from 20℃ to 10℃ and from 10℃ to 0℃ during the 2ndand 3rdlactation periods, respectively. For each bout, the energy intake and energy expenditure of female hamsters were measured during the peak lactation. Furthermore, resting metabolic rate (RMR) and nonshivering thermogenesis (NST) were quantified using an open-flow respirometry system, to indicate the rate of oxygen consumption. Cytochrome c oxidase (COX) activity of brown adipose tissue (BAT) was determined polarographically with oxygen electrode units. Serum thyroid hormone (tri-iodothyronine, T3and thyroxine, T4) and prolactin concentrations were determined using a radioimmunoassay method. Total body fat was extracted from the dried carcass by ether extraction in a Soxhlet extractor. Body mass of female hamsters decreased significantly during lactation, and body mass measurements between days 7 and 17 of lactation decreased by 12.4%, 12.3%, and 13.5% in the 1st, 2nd, and 3rdlactation groups, respectively. The sustained energy intake during the peak observed in the 3rdlactation group was significantly higher than that in the 1stand 2ndlactation groups. Litter sizes were 4.4 ± 0.1, 4.4 ± 0.2, and 4.3 ± 0.4 in the 1st, 2nd, and 3rdlactation groups, respectively, among which no statistically significant differences were observed. In contrast, significant differences in litter mass were observed among the three groups. Litter mass in the 1stand 2ndlactation groups decreased to a greater extent than in the 3rdlactation group by 15.1% and 18.2%, respectively, on day 7 of lactation, and by 24.5% and 18.6%, respectively, on day 17 of lactation. Significant correlations were observed among the sustained energy intake, litter size, and litter mass. RMR and NST were also significantly different among the three groups, with the females in the 2ndand 3rdlactation groups showing higher RMR and NST than those in the 1stlactation group. The sustained energy intake during peak lactation was positively correlated with RMR and NST. Neither wet nor dry carcass mass showed significant differences among the three lactation groups. Fat content in the 2ndand 3rdlactation groups decreased to a greater extent than that in the 1stlactation group, by 12% and 28%, respectively. BAT COX activity in the 1stand 2ndlactation groups increased to a greater extent than in the 3rdlactation group, by 139.7% and 65.5%, respectively. Serum T3concentrations were significantly higher in the 3rdlactation group than in the 1stlactation group, whereas the differences in T4concentration were not significant among the three groups. Serum prolactinconcentrations also did not show significant differences among the three groups. These results suggest a trade-off between the energy allocation to thermogenesis and offspring, in female hamsters under successive decreases in temperature. Cold exposure induces a significant increase in thermogenesis but a decrease in reproductive output. Furthermore, striped hamsters may perceive a decline in ambient temperature and consequently decrease reproductive output. The findings of the present study are consistent with the prediction of “the seasonal investment hypothesis.”
energy budget; reproduction; seasonal investment; striped hamster (Cricetulusbarabensis); thermogenesis
国家自然科学基金资助项目(31270458),温州大学重点实验室开放项目(14SK51A, 14SK52A);浙江省中青年学科带头人学术攀登项目(pd2013374)
2015- 01- 16; 网络出版日期:2015- 11- 17
Corresponding author.E-mail: zhao73@foxmail.com
10.5846/stxb201501160137
曹静,王桂英,赵志军.环境温度和繁殖经历对黑线仓鼠哺乳期能量收支的影响.生态学报,2016,36(15):4824- 4831.
Cao J, Wang G Y, Zhao Z J.Effect of consecutive decreases in temperature and reproductive experiences on energy budget during lactation in the striped hamster (Cricetulusbarabensis) .Acta Ecologica Sinica,2016,36(15):4824- 4831.
