基于OCT图像的组织散射系数提取方法及其应用
2016-10-24朱良慧曾毛毛赵佳玮吉雁鸿
朱良慧, 曾毛毛, 赵佳玮, 吉雁鸿*
(1.华南师范大学物理与电信工程学院,广州 510006; 2.清华大学深圳研究生院生物医学工程研究所,深圳 518055)
基于OCT图像的组织散射系数提取方法及其应用
朱良慧1,2, 曾毛毛2, 赵佳玮1, 吉雁鸿1*
(1.华南师范大学物理与电信工程学院,广州 510006; 2.清华大学深圳研究生院生物医学工程研究所,深圳 518055)
采用自制频域光学相干层析(OCT)系统对大鼠的正常和疮伤皮肤进行成像,轴向分辨率为8 μm,探测深度3 mm,根据组织对光的吸收特性和OCT成像系统的共聚焦特性,建立了A-scan方向图像灰度随探测深度的单次散射-点扩散函数模型. 利用模型中的散射系数作为量化皮肤疮面诊断的光学评价指标. 测量了正常与疮伤皮肤在各阶段的皮肤衰减系数,证明衰减系数能够定量区分正常与疮伤皮肤.
光学相干层析成像; 散射系数; 皮肤疮面量化
光学相干层析(Optical Coherence Tomography, OCT)是一种功能类似于超声、对生物组织横断面进行成像的技术. OCT成像分辨率比超声高1~2个数量级,信噪比超过100 dB. OCT这个概念最早由HUANG等[1]于1991年提出. 近年来,OCT成像技术在多种生物组织探测中取得了巨大进展[2-4],由于OCT成像分辨率在微米量级,成像深度在毫米量级,所以受到眼科、皮肤科和牙科医生和患者的青睐[5-6].
组织光学性能相关的参数包括折射率、吸收系数、散射系数、散射各向异性[7-8]. OCT对组织形态结构的高分辨成像检测出较小的生物组织结构层次图像的同时,它还能测量这些光学参数[9]. 从OCT图像中提取的局部衰减系数能提供组织特异性信息,通过衰减系数定量区分不同组织,这大大拓宽了OCT的临床应用.
对于准平行光(低数值孔径),衰减系数μt=μa+μs,它可以直接由测量的A-scan信号取对数求得. 衰减系数能够量化组织光学性能的变化. 光在组织的传播过程中既包含吸收也包含散射,但是在近红外波段,由于吸收导致能量衰减占据的比例很低,背向散射光的衰减方程斜率几乎等于散射系数μs[10],因此,本文不区分衰减系数和散射系数. 在OCT图像中选择感兴趣的区域,建立该区域内信号模型,衰减系数可以从该模型中计算出. 目前有2种模型可以使用,一种是单次散射模型,另一种是考虑多次散射效应的模型,其中单次散射模型应用最广泛[11-13].
本文用自制的OCT系统对大鼠正常皮肤和疮伤皮肤成像,用单次散射-点扩散函数模型拟合I-z曲线,提取皮肤组织的衰减系数. 测量正常皮肤疮伤在各个阶段的皮肤衰减系数,证明衰减系数能够定量区分正常皮肤与创伤皮肤. 建立A-scan方向图像灰度随探测深度的单次散射-点扩散函数模型,可以作为量化皮肤疮伤诊断的光学评价指标.
1 实验系统与材料
1.1OCT系统构建
频域OCT的硬件系统的核心是一个光纤型迈克尔逊干涉仪(图1),光源为超辐射发光二极管(SLD)宽带光源(武汉英飞华科技有限公司生产). 该光源中心波长为836.4 nm,3 dB带宽为40 nm. 光源输出功率为4.67 mW.
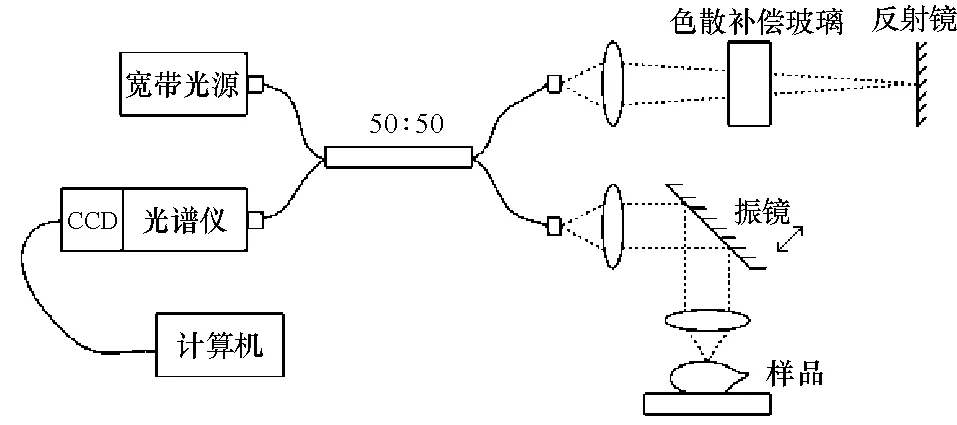
图1 频域OCT硬件系统
光源相干长度的计算公式为
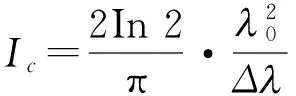
1.2动物模型建立及实验
将20只大白鼠(SD品系)分实验模型组和对照组,每组10只,模型组大鼠在造模前3 d连续前股肌注射氢化可的松试剂,对照组正常饲养. 实验中,将大鼠背部脱毛后,分别在2组大鼠背部靠近脊柱处剪下2 cm×2 cm的方形皮肤组织,模型组大鼠的疮口需埋入方形塑料环. 大鼠疮口制作完毕后,用医用纱布覆盖疮面.
采用频域OCT系统定期对2组大鼠的疮口检测,观察疮面及疮周组织结构和散射系数的变化,扫描区域为3 mm×3 mm.
2 结果与讨论
频域OCT系统搭建完毕后,可以直接获得组织的结构图,但是结构图只能定性反映皮肤组织特点,无法实现定量评估. 为了实现定量评估,需要提取组织内的某些性能参数(如散射系数). 组织散射系数的定量提取需要对图像进行去噪预处理,然后提取组织表面轮廓.
2.1低频噪声的去除和皮肤表面轮廓提取的图像预处理
图2A为OCT系统采集的大鼠皮肤原始图像,从噪声的角度发现,界面以上的噪声是“横线”或“竖线”,这些在信号中表现为直流在频域里的低频噪声. 对图像进行傅利叶变换得到频阈图(图2B),可以设计低通滤波器,除去大量噪声,在此过程中,也会滤除信号的信息. 从信号的角度发现,皮肤表面散射很强,在图像中表现为灰度值大、梯度大,因此,可以利用这些特点来提取皮肤的表面信号.
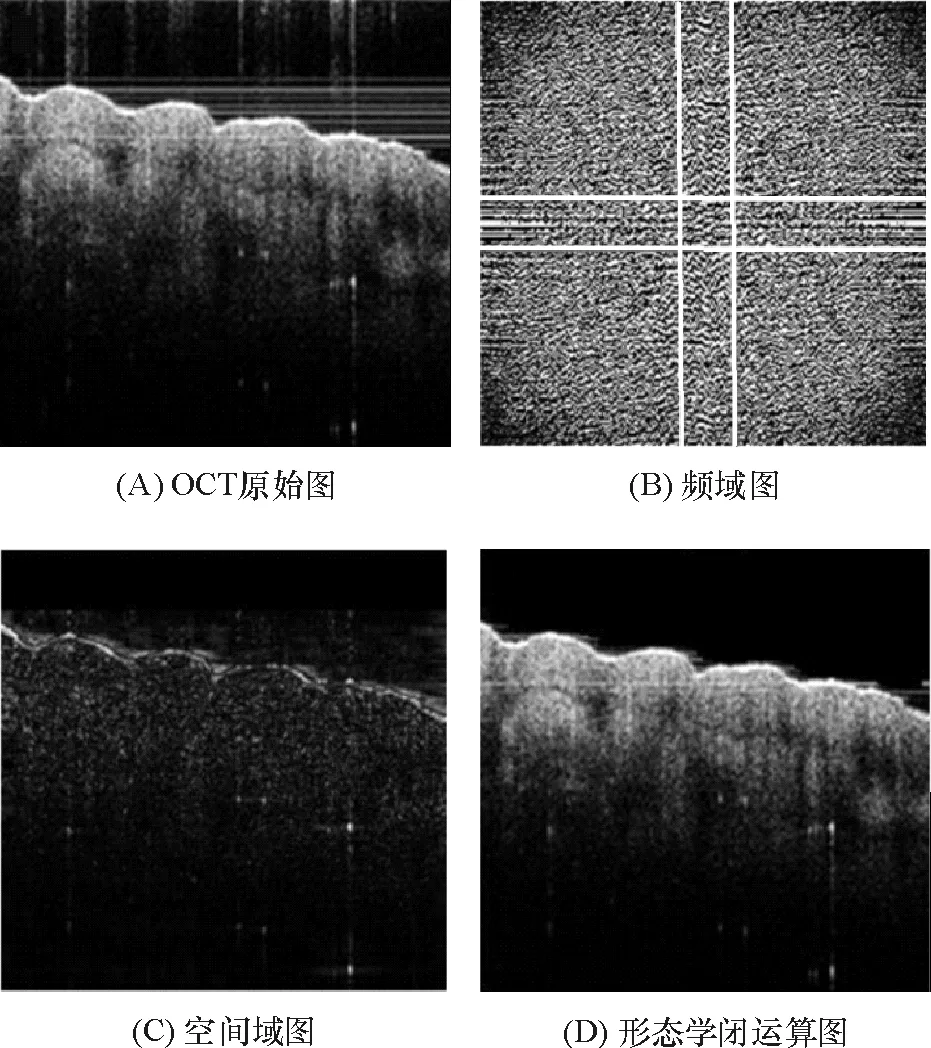
图2SD大鼠皮肤组织的OCT原始图像及其高通滤波时域傅里叶变换信号处理
Figure 2OCT image of skin tissue of SD rat and its high-pass filtering in frequency domain with FFT signal processing algorism
由于皮肤界面变化明显,在频域中它的主要能量集中在高频波段,所以低通滤波器对界面的能量削弱很小. 本文直接选取矩形窗对原始信号频域滤波,如图2B白线区域的低频信号. 在频域内将矩形框内的低频部分滤除,以减小皮肤界面以上的低频噪声.在频域用低通滤波器对原始图像滤波后,再经过逆傅里叶变换得到返回空间域的图像(图2C). 像中“横线”明显减少,“竖线”部分的能量显著降低,同时,图像的整体灰度降低,剩下的部分多数是高频细节. 但是皮肤组织的上边界仍然十分明显,这有利于后续的边界提取. 将图2C采用sobel算子检测形态学闭运算之后,组织界面轮廓以上数据全部置0,得到增强的表面轮廓图像(图2D),且OCT图像边界明显,断开的部分已经被连续地拼接,原始图像皮肤上面的噪声得到很好的抑制.
2.2分段拟合散射系数的提取
图像预处理完毕后,选取目标区域,对该区域的诸多A-scan信号求平均,获得图像灰度随深度变化的曲线. 如果被测样品是均匀物质,那么A-scan信号可以从起点拟合到终点,但通常情况被测样品内部具有分层结构,因此,应该采用分段拟合.
本文采用自动寻找曲线拟合起始点的方法. 将皮肤界面以上噪声去除后,选择目标区域,横向扫描范围在100~200像素,对101条A-scan数据求平均,得到灰度随深度变化的曲线,即I和z满足以下关系:
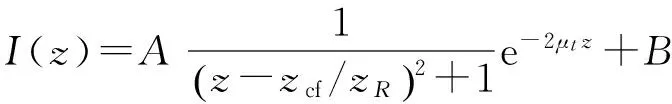
其中,zcf=63±3μm,实验过程中,将样品臂焦点调到样品界面处,以保证zcf=0. 从公式的形式来看,如果样品是均匀物质,即μt不变,那么I不断减小. 图3中的a曲线显示z在0~12以及80~115范围内,I值不断上升,说明z=12、80和115是不同物质的分界点. 用I-z函数的导数来区分,即导数符号发生变化时,很可能出现不同成分的分界面. 根据导数的变号性来确定曲线的拟合起始点,对I-z函数求导,得到I′-z曲线(图3的b曲线).z=12、80和115时,I′前后2个数据符号发生变化.
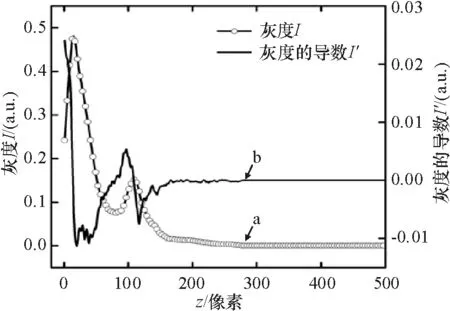
图3 OCT A-Scan 强度深度曲线及其强度导数深度曲线
Figure 3Intensity measuredIas a function of depth and derivative of intensityI′ as a function of depth
确定了拟合起始点后,采用模型对曲线进行拟合. 拟合模型选取考虑OCT共聚焦效应的单次散射模型[14-15],即
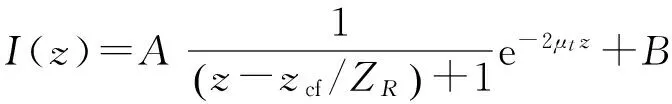
其中,A值固定为1,B是待定系数,zcf=63±3μm,zcf=0. 数据拟合的目标函数为
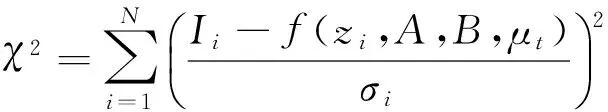
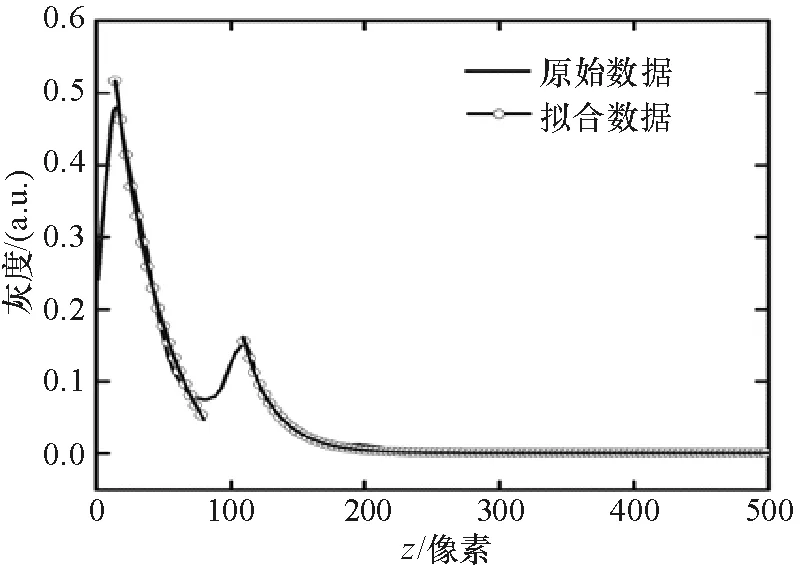
图4 光强对探测深度的拟合曲线
2.3皮肤疮伤处不同部位的散射系数
创伤OCT图像如图5所示,对应的成像范围X方向约为3 mm,Y方向约为2 mm. 图5A为疮周部位图像,接近于正常皮肤;图5B为结痂部位图像,显示痂皮较厚,且内部的组织成分较均匀;图5C为化脓部位图像,内部基本是皮肤组织,外层有1层薄薄的组织液渗出,脓液成分比较单一,主要是表层的渗液. 而正常疮口的肉芽组织非常均匀,表层0.4 mm的散射能力较强,但是近红外光的穿透深度并没有减弱,基本和正常组织的穿透深度保持一致. 图5A、B中OCT信号较强,由于表层信号饱和,产生额外的低频噪声,使得图像顶部噪声较大. 图5D为创伤部位的照片,以作为对比参考.

图5 正常疮口不同症型的OCT扫描图及疮口照片
Figure 5OCT images from different syndrome types of wound skin and its photograph
对组织的内部信息提取,可以得到正常疮口的各种组织状态的散射系数(表1),其中正常皮肤的散射系数为0.096~0.174 mm-1. 结果显示,正常疮口的疮周和肉芽组织与正常皮肤组织存在无明显统计差异,而痂皮、化脓与正常皮肤组织存在有明显统计差异. 说明内部结构、性质发生了很大变化.
表1不同证型的散射系数比较
Table 1Scattering coefficient of different syndrome types of skin wound

组织形态散射系数/(mm-1)疮周(近正常)0.008~0.011b痂皮0.030~0.040a化脓0.001~0.002a
注:a表示P<0.01,有明显差异;b表示P>0.05,无明显差异.
以上结果说明OCT成像系统不仅能从结构上定性地区分不同的组织形态,而且可以通过提取组织散射系数定量区分组织形态,从而初步证实了OCT成像对皮肤疮伤检测的可行性.
3 结论
通过对老鼠正常皮肤和疮伤皮肤的各种组织状态散射系统的提取分析,说明OCT成像系统不仅能从结构上定性地区分不同的组织形态,而且可以通过提取组织散射系数定量区分组织形态,该成果有望推动OCT成像在皮肤疮伤检测的应用.
[1]HUANG D, SWANSON E A, LIN C P, et al. Optical coherence tomography[J]. Science, 1991, 254:1178-1181.[2]SHECK L H N, WILSON C J, VINCENT A L. Analysis of the pre-retinal opacities in Gaucher Disease using spectral domain optical coherent tomography[J]. Ophthalmic Genetics, 2012, 33(4):253-256.
[3]MARSCHALL S, SANDER B, MOGENSEN M, et al. Optical coherence tomography-current technology and applications in clinical and biomedical research[J].Analytical and Bioanaytical Chemistry, 2011,400(9):2699-2720. [4]TSAI M T, LEE I C, LEE Z F, et al.In vivo investigation of temporal effects and drug delivery induced by transdermal microneedles with optical coherence tomography[J].Biomedical Optics Express, 2016,7(5):1865-1876.
[5]DAMODARAN V, RAO S R, VASA N J. Optical coherence tomography based imaging of dental demineralisation and cavity restoration in 840 nm and 1 310 nm wavelength regions[J]. Optics and Lasers in Engineering, 2016, 83: 59-65.
[6]HUANG J X, HINDMAN H B, ROLLAND J P. In vivo thickness dynamics measurement of tear film lipid and aqueous layers with optical coherence tomography and maximum-likelihood estimation[J]. Optics Letters, 2016, 41(9): 1981-1984.[7]刘少杰,吴泳波,唐志列.利用相位差分技术改善光学相干层析图像质量[J].华南师范大学学报(自然科学版),2016,48(2):19-23.
LIU S J, WU Y B, TANG Z L.Using phase-differential technology to improve the imaging quality of optical coherence tomography[J]. Joumal of South China Normal University (Natural Science Edition),2016,48(2):19-23.[8]GUO X, BU P, WANG X Z, et al. Scattering imaging of skin in Fourier domain optical coherence tomography[J]. Optics Communications, 2013,305(305):137-142.
[9]SU Y, YAO X S, LI Z, et al.Measurements of the thermal coefficient of optical attenuation at different depth regions of in vivo human skins using optical coherence tomography: a pilot study[J]. Biomedical Optics Express, 2015,6(2):500-513.
[10]SOMMEREY S, LADURNER R, ARABI N A,et al. Backscattering intensity measurements in optical coherence tomography as a method to identify parathyroid glands[J].Lasers in Surgery & Medicine, 2015,47(6):526-532.
[11]ZHANG Y, WU G, WEI H, et al.Continuous noninvasive monitoring of changes in human skin optical properties during oral intake of different sugars with optical coherence tomography[J]. Biomedical Optics Express, 2014, 5(4):990-999.
[12]OLDENBURG A L, YU X, GILLISS T, et al.Inverse-power-law behavior of cellular motility reveals stromal-epithelial cell interactions in 3D co-culture by OCT fluctuation spectroscopy[J].Optica, 2015,2(10):877-885.
[13]SATTLER E, KSTLE R, WELZEL J. Optical coherence tomography in dermatology[J]. Journal of Biomedical Optics,2013,18(6):Art 061224,6pp.
[14]THRANE L, YURA H T, ANDERSEN P E. Analysis of optical coherence tomography systems based on the extended Huygens-Fresnel principle[J]. Journal of the Optical Society of America A: Optics Image Science & Vision, 2000, 17(3):484-490.
[15]FABER D J, MEER F J V D, MAURICE A, et al. Quantitative measurement of attenuation coefficients of weakly scattering media using optical coherence tomography[J]. Optics Express, 2004, 12(19):4353-4365.
【中文责编:成文英文责编:李海航】
Quantify Wound Skin by Extracting Tissue Scattering Coefficient from OCT Image
ZHU Lianghui1,2, ZENG Maomao2, ZHAO Jiawei1, JI Yanhong1*
(1. School of Physics and Telecommunication Engineering, South China Normal University, Guangzhou 510006, China;2. Research Center of Biomedical Engineering Graduate School at Shenzhen, Tsinghua University, Shenzhen 518055, China)
A home-made frequency domain OCT system with axial resolution of 8 μm and the detection depth of 3 mm has been built for skin imaging. According to the scattering characteristics of tissue and the confocal nature of OCT system, tissue scattering coefficient was extracted with a confocal scattering model from intensities of A-scan signal. Intensity curve was fitted from single scattering point spread function model to extract scattering coefficient of different syndrome types of skin wound. The skin scattering coefficient of normal skin and wound skin was measured at each stage. The results show that scattering coefficient could be a quantitative evaluation index of skin wound.
optical coherence tomography; scattering coefficient; skin wound quantification
2016-04-14 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(61378089, 81571837)
吉雁鸿,副研究员,Email: jiyh@scnu.edu.cn.
O437
A
1000-5463(2016)04-0031-04
