红芪多糖对糖尿病大鼠视网膜VEGF和Ets-1表达的影响*
2016-10-24张花治李桂珍金智生
张花治,刘 莹,李桂珍,金智生
(甘肃中医药大学中医临床学院,甘肃 兰州 730000)
·实验研究·
红芪多糖对糖尿病大鼠视网膜VEGF和Ets-1表达的影响*
张花治,刘莹,李桂珍,金智生
(甘肃中医药大学中医临床学院,甘肃 兰州 730000)
目的:观察红芪多糖(hedisari polysacchcaide,HPS)对糖尿病大鼠视网膜血管内皮生长因子(vascular endothelial growth factor,VEGF)和E26转录因子-1(Ets-1)蛋白表达水平的影响,并探讨其机制。方法:用60 μg/g一次性腹腔注射链脲佐菌素诱导糖尿病模型。将糖尿病模型大鼠分为模型对照组、多贝斯组[90 mg/(kg·d)]和HPS高(200 μg/g)、中(100 μg/g )、低剂量(50 μg/g)组,另设正常对照组,每组10只。均灌胃给药,1 d 1次,药物组给予相应药物,模型对照组和正常对照组给予等剂量生理盐水,连续8周。8周后采用免疫组织化学法和qRT-PCR方法检测Ets-1、VEGF的蛋白表达和mRNA相对表达量。结果:与正常对照组对比,模型对照组视网膜VEGF、Ets-1的蛋白表达增加(P<0.05),视网膜VEGF和Ets-1 mRNA相对表达量明显升高(P<0.05)。与模型对照组对比,HPS高、中、低剂量组和多贝斯组的VEGF和Ets-1蛋白表达明显降低(P<0.05), VEGF和Ets-1 mRNA相对表达含量也明显降低(P<0.05);HPS高剂量组最接近正常对照组。结论:HPS对DM大鼠视网膜有保护作用,推测其机制可能是通过降低视网膜中VEGF、Ets-1的含量来阻遏糖尿病性视网膜病变进程中新生血管生成与增殖,且HPS高剂量组的效果最好。
糖尿病大鼠模型;红芪多糖;血管内皮生长因子;E26转录因子-1;视网膜;动物;大鼠
糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病常见、严重的并发症之一,是全世界20~60岁人群中致盲的首要原因[1-2]。近年来,许多学者认为DR主要病理过程为新生血管形成及增殖,而新生血管发生、发展与血管内皮细胞生长因子(vascular endothelial growth factor,VEGF) 和E26转录因子-1(Ets-1)有着密切的关系[3-4]。Ets-1在血管生成中起着重要的调控作用,可通过诱导VEGF的表达来调控血管发生过程,而VEGF可以反过来上调Ets-1的表达。这个正调控系统在血管发生中起了主要作用。前期研究[5-6]表明:红芪多糖(hedisari polysacchcaide,HPS)能显著改善糖尿病胰岛素抵抗大鼠模型的相关指标,并保护胰腺和肾脏组织。本研究采用qRT-PCR法和免疫组化法进一步观察HPS对糖尿病大鼠视网膜VEGF及Ets-1表达的影响,探讨HPS阻遏DR进程中新生血管生成、增殖的可能性以及其作用机制。
1 材料与方法
1.1动物
雄性SPF级Wistar大鼠60只, 体质量180~220 g,购自甘肃中医学院SPF级实验动物中心,动物许可证号:SCXK(甘)2011-0001。
1.2药品、试剂与仪器
红芪多糖[7]由甘肃中医药大学药学院按照文献方法[8]制备,纯度 70%;多贝斯,西安利君制药有限责任公司产品,批号1305066-1。链脲佐菌素(streptozotocin,STZ),Sigma公司产品,批号S0130-1G; Ets-1鼠抗人多克隆抗体,Lab Vision公司产品,批号DS-2562-GO;兔抗人VEGF多克隆抗体,Abcam公司产品,批号 ab411545;DAB显色试剂盒(批号K145615B)和免疫组化试剂盒(批号13155A11),购自北京中杉金桥生物技术有限公司;总 RNA提取试剂盒II,OMEGA公司产品,批号R6945 ;TIANScript cDNA第一链合成试剂盒(批号RT120430)、2×Taq PCR MasterMix(批号KT201-05),为天根生化科技有限公司产品。稳豪倍优 One Touch血糖测定仪,美国强生Lifescan公司产品;OSE-Y10微量电动组织匀浆器,Tiangen 公司产品;CT14RD台式高速冷冻离心机,上海天美生化仪器设备工程有限公司产品;D1008型掌上离心机,美国 SCILOGEX 公司产品;Q5000型超微量紫外分析仪,美国 Quawell 公司产品;7500型RT-PCR 热循环仪,美国ABI公司产品。
1.3模型的建立、分组与给药
建模前对大鼠进行全身及眼部检查以排除原发性疾病。随机选取50只大鼠禁食12 h,一次性腹腔注射STZ(60 μg/g ,溶于新配制的0.1 mol/L、pH值4.5的柠檬酸钠缓冲液中),72 h后尾静脉取血测血糖,以空腹血糖≥16.7 mmol/L以上、尿量和饮水明显增多者为糖尿病模型诱导成功。另外10只腹腔注入等量柠檬酸钠缓冲液,72 h后测量空腹血糖均<5.6 mmol/L,设为正常对照组。将造模成功的50只大鼠采用随机数字表法分为模型对照组、多贝斯组和HPS高、中、低剂量组,每组10只。多贝斯组每日灌胃多贝斯 90 μg/g,HPS高、中、低剂量组分别灌胃HPS 200,100,50 μg/g,正常对照组、模型对照组灌胃等体积的生理盐水,1 d 1次,连续8周。各组大鼠均给标准饲料喂养,定期测血糖、体质量。
1.4检测指标
采用免疫组织化学法和qRT-PCR方法检测VEGF、Ets-1的蛋白表达和mRNA相对表达量。实验灌胃8周后,以质量分数100 g/L 水合氯醛腹腔注射麻醉大鼠,断颈处死,摘取眼球;右眼球去除眼前节,剥离视网膜组织,液氮速冻,置于EP管中,于-80 ℃冰箱中储存备用;左眼置于40 g/L多聚甲醛(4 ℃,24 h)固定。其中每组的5只眼球切除眼前节并剥离视网膜后再放入固定液中固定(用于检测VEGF);另外5只眼球直接放入固定液中固定,48 h后将整个眼球的部分切除眼前节(用于检测Ets-1),然后与剥离的视网膜一起进行梯度酒精脱水,二甲苯透明,浸蜡、包埋。最后将平行于视神经矢状轴且以其为平面的视网膜进行3 μm厚连续切片,每只眼球选取10个面(去掉有视神经断面的切面),贴于涂有多聚赖氨酸的载玻片,行免疫组织化学检测。
1.4.1VEGF和Ets-1蛋白表达的检测
提取视网膜总RNA及反转录反应 Trizol一步法提取总RNA。反转录反应体系:总RNA 3 μg,OligodT 1 μL,dNTP 1 μL,5×Buffer 4 μL,逆转录酶0.5 μL,加入经DEPC处理的无菌水至20 μL。反应条件:45 ℃反应1 h,95 ℃ 5 min终止反应。反应结束后,-20 ℃冰箱保存备用。qRT-PCR反应:从GenBank获得目的基因mRNA的全长序列,利用引物和探针设计软件Primer 5.0设计引物序列。经过Blast分析,引物序列具有特异性。以β-actin为内对照进行qPCR反应引物序列。β-actin:上游引物5′-CCCATCTATGAGGGTTACGC-3′,下游引物5′-TTTAATGTCACGCACGATTTC-3′。VEGF:上游引物5′-CTGTACCTCCACCATGCCAAG-3′ ,下游引物5′-ACAAGGCTCACAGT-3′。Ets-1:上游引物5′-GGGGCCAGGACTCTTTTGAG-3′,下游引物5′-TTGAATTCCCAGCCGTCTCC-3′。反应体系:cDNA 1 μL,上游引物(20 pmol/μL)0.5 μL,下游引物(20 pmol/μL)0.5 μL,2×SYBR Green 1 μL,2×mix 12.5 μL。加无菌水至25 μL。反应条件:94 ℃预变性2 min;94 ℃变性30 s,退火温度30 s(β-actin 54 ℃、VEGF 55 ℃,Ets-1 55 ℃),72 ℃延伸30 s,共40个循环。反应结束后,得到每份样品中VEGF进行PCR扩增时达到阈值时的Ct值。按目前通用的方法是2-△△CT计算各组间目标基因的表达量的差别,每个标本重复3次,取平均值为CT值。以模型组目标基因的表达量为1,2-△△CT值即为处理后目的基因表达较处理前的倍数。
1.4.2VEGF和Ets-1蛋白表达的免疫组化检测
按照兔抗人VEGF和鼠抗人Ets-1多克隆抗体免疫组织化学试剂盒和DAB显色试剂盒操作说明对切片进行免疫组织化学染色。每个组织块均取3 μm 厚的切片用于免疫组织化学染色,梯度酒精水化,体积分数30 mL/L的H2O2去离子水孵育,微波(95 ℃,3 min)抗原修复。正常山羊血清封闭,依次加入一抗、生物素化二抗,SP复合物,DAB显色,复染,脱水,透明,中性树胶封片。光学显微镜下观察、拍照。各组大鼠随机选取4张切片,每张切片在400倍镜下随机采集阳性染色最强的5个视野,输入计算机后运用 Image-Pro-Plus 6.0图像分析软件进行系统测定视网膜 VEGF和Ets-1的免疫组织化学染色阳性信号的光密度值,取平均值(平均光密度OD值)。
1.5统计学方法
2 结 果
2.1各组大鼠视网膜组织中VEGF和 Ets-1 mRNA相对表达含量对比
与正常对照组对比,模型对照组的VEGF和Ets-1 mRNA相对表达量升高,差别有统计学意义(P<0.05)。与模型对照组对比,HPS各剂量组及多贝斯组的VEGF和Ets-1 mRNA相对表达量有不同程度降低,差别有统计学意义(P<0.05),其中HPS高剂量组VEGF和Ets-1 mRNA表达接近正常对照组。见表1。
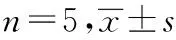

组 别剂量/(g·kg-1)VEGFmRNAEts-1mRNA正常对照组—0.2938±0.12*0.1471±0.09*模型对照组—11多贝斯组0.090.3499±0.18**0.2160±0.13*HPS低剂量组0.050.7067±0.08**##0.6109±0.12**##HPS中剂量组0.100.5856±0.11**#0.5278±0.15**#HPS高剂量组0.200.3825±0.14**0.2396±0.13*F值25.55339.919P值0.0000.000
注:与模型对照组对比,*P<0.05,**P<0.01;与HPS高剂量组对比,#P<0.05,##P<0.01。
2.2各组大鼠视网膜组织中VEGF和Ets-1蛋白表达的平均光密度值对比
免疫组织化学结果中VEGF和Ets-1免疫阳性反应呈棕色,定位于胞浆内。正常对照组视网膜VEGF和Ets-1免疫阳性反应主要见于神经节细胞层及内丛状层细胞,内核层少有表达。HPS各治疗组、多贝斯组和模型对照组阳性反应增强,大鼠视网膜各层细胞的胞浆内均可见棕色的阳性颗粒,阳性部位主要位于神经节细胞层、内核层及内外丛状层。模型对照组与正常对照组对比,VEGF和Ets-1蛋白表达水平明显升高(P<0.05);多贝斯组,HPS高、中、低剂量组 VEGF蛋白表达水平明显低于模型对照组 (P<0.05);HPS高剂量组与多贝斯组,HPS中、低剂量组对比,VEGF和Ets-1蛋白表达水平明显降低 (P<0.05)。见表2。


组 别剂量/(g·kg-1)VEGFEts-1正常对照组—9.31±3.60**0.61±0.10**模型对照组—17.24±4.206.84±1.20多贝斯对照组0.0912.35±8.24**#2.35±1.24**#HPS低剂量组0.0515.15±7.84*##3.15±1.84**##HPS中剂量组0.1013.45±4.25**#2.15±1.25**#HPS高剂量组0.2010.68±5.61**1.02±0.61**F值2.49738.048P值0.0420.000
注:与模型对照组对比,*P<0.05,**P<0.01;与HPS高剂量组对比,#P<0.05,##P<0.01。
3 讨 论
缺氧和高血糖可导致视网膜组织供血不足,机体会通过增加 VEGF 的表达,促进新生血管形成来改善供血、供氧不足;但新生血管的形成可加速DR病程发展[9]。VEGF 不仅能够促进血管内皮细胞的生长,还可以增加血管内皮细胞的通透性,使大量血浆蛋白溢出,进一步为新血管的生成提供良好的基质[10]。Caldwell[11]认为高血糖介导的氧化应激对VEGF的表达和活性的影响,导致一系列细胞和分子改变,最终促成了新生血管和增殖性糖尿病视网膜病变的形成;临床研究也证实DR患者的玻璃体液体中VEGF的含量明显上升,并且与视网膜新生血管化的进程一致[12]。Ets-1表达参与了血管发生和损伤修复过程,血管发生需要Ets-1的参与。体外实验证明在培养的人脐静脉内皮细胞中,VEGF可以诱导Ets-1表达,VEGF结合内皮细胞表面的受体,形成异源二聚体介导这一作用[13]。Ets-1在血管生成中起着重要的调控作用,可通过诱导VEGF的表达来调控血管发生过程,而VEGF可以反过来上调Ets-1的表达,这个正调控系统在血管发生中起了重要作用;因此,抑制VEGF及Ets-1的表达为目前治疗DR的靶方向。
研究显示:黄芪具有益气活血、养阴散瘀之功效,可以改善视网膜微循环,提高机体免疫力,抑制视网膜周细胞的凋亡[14];而黄芪多糖具有调节免疫功能和抗氧化的作用,能减少自由基的生成,增加自由基的清除,还可明显地扩张血管,降低血黏度,促进血液循环,改善微循环,能够降低糖尿病大鼠早期视网膜Muller细胞Kir2.1蛋白表达下降,从而起到减少DR发病率的作用[15]。甘肃地道药材红芪是豆科植物多岩黄芪的干燥根,与黄芪同科异属,与黄芪性味、归经、功效、主治基本相同,药理作用相似。前期研究表明:HPS对糖尿病胰岛素抵抗大鼠模型血糖、血脂、TNF-α、IL-6等指标均有改善作用,并可以保护胰腺和肾脏组织[5-6]。本研究进一步观察了HPS对糖尿病大鼠视网膜VEGF及Ets-1表达的影响。各组大鼠灌胃8周后对视网膜进行qRT-PCR法检测和采用计算机运用图像分析软件测定视网膜 VEGF和Ets-1的免疫组织化学染色阳性信号的光密度值发现:模型对照组与正常对照组对比,视网膜VEGF和Ets-1 mRNA相对表达量明显升高(P<0.05),蛋白表达增加(P<0.01);经多贝斯和HPS干预后,多贝斯组和HPS高、中、低剂量组的VEGF和Ets-1 mRNA相对表达量、蛋白表达明显较模型对照组低(P<0.05或P<0.01);HPS高剂量组最接近正常对照组。结果表明:HPS能降低VEGF、Ets-1在糖尿病视网膜中的表达,且HPS高剂量效果最理想。据此推测黄芪多糖可能是通过降低视网膜中VEGF、Ets-1的含量来阻遏DR进程中新生血管生成与增殖,从而缓解DR发展进程;因此其在预防和治疗DR方面有一定的应用前景。当然,对于将黄芪多糖运用于预防和治疗DR方面还需大量的实验及临床随机对照研究,这也是课题组今后进一步研究的目标和方向。
此外,笔者在进行免疫组织化学法实验时,在眼球2种处理方法的比较中发现剥离的视网膜在浸蜡、包埋和切片时难度都较大,而且图片上色素上皮层缺失;因此,建议今后在做眼球的免疫组织化学法时不要剥离视网膜。
[1]Weltermann B, Reinders S, Bettin M, et al.Screening for diabetic retinopathy in type 2 diabetes:a critical review of an annual routine[J].Z Evid Fortbild Qual Gesundhwes,2013,107(6):403-409.
[2]Aiello LP.Diabetic retinopathy and other ocular findings in the diabetes control and complications trial/epidemiology of diabetes interventions and complications study[J].Diabetes care,2014,37(1):17-23.
[3]Sato Y,Kanno S,Oda N,et al.Properties of two VEGF receptors,Flt-1 and KDR,in signal transduction[J].Ann N Y Acad Sci,2000,902:201-207.
[4]Zhao-Jiang Du,Peng Li,Yan-Nian Hui,et al.Concomitant expression and combined localization of Ets-1 and VEGF in the experimental diabetic rat′s retina[J].International Journal of Ophthalmology,2007,7(2):294-297.
[5]金智生,张东鹏.红芪多糖对2型糖尿病胰岛素抵抗大鼠IL-6的影响[J].甘肃中医学院学报,2006,10(5):6-8.
[6]金智生,孙丹凤,汝亚琴,等.红芪多糖对实验性糖尿病胰岛素抵抗大鼠TNF-α的影响[J].上海中医药杂志,2010,44(9):61-64.
[7]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:142.
[8]马丹,封士兰,赵良功,等.红芪多糖的提取分离纯化及组成分析[J].中国现代应用药学,2008,25(3):177-179.
[9]Ma Y,Zhang Y,Zhao T,et al.Vascular endothelial growth factor in plasma and vitreous fluid of patients with proliferative diabetic retinopathy patients after intravitreal injection of bevacizumab[J].Am J Ophthalmol,2012,153(2):307-313.
[10]Simó R,Sundstrom JM,Antonetti DA.Ocular anti-VEGF therapy for diabetic retinopathy: the role of VEGF in the pathogenesis of diabetic retinopathy[J].Diabetes Care,2014,37(4): 893- 899.
[11]Caldwell RB,Bartoli M,Behzadian MA,et al.Vascular endothelial growth factor and diabetic retinopathy:role of oxidative stress[J].Curr Drug Targets,2005,6(4):511-524.
[12]Nicholson BP,Schachat AP.A review of clinical trials of anti-VEGF agents for diabetic retinopathy[J].Graefes Arch Clin Exp Ophthalmol,2010,248(7):915-930.
[13]Watanabe D,Takagi H,Suzuma K,et al.Transcription factor Ets-1 mediates ischemia and vascular endothelial growthfactor-dependent retinal neovascularization[J].Am J Pathol,2004,164(5):1827-1835.
[14]杨建华,段俊国.黄芪提取物对体外高糖培养牛视网膜毛细血管周细胞的影响[J].国际眼科杂志,2007,7(3):685-687.
[15]李玉红,柯敏,张分队.黄芪多糖对2型糖尿病早期大鼠视网膜Muller细胞Kir2.1表达的影响[J].武汉大学学报,2008,29(2):177-179.
(编辑陶珠)
1001-6910(2016)02-0060-04
R587.1
B
10.3969/j.issn.1001-6910.2016.02.30
金智生,教授,博士生导师,jzsgszy@ 126.com
甘肃中医药大学中青年基金(BH2012-025)
2015-07-14;
2015-11-30
