钩吻素子对孤立大鼠的抗焦虑作用及其机制
2016-10-22陈超杰钟志凤陈慧珍俞昌喜
陈超杰 钟志凤 谢 璇 陈慧珍 俞昌喜,
1.福建医科大学福建省新药安全性评价中心,福建福州 350108;2.福建医科大学药学院,福建福州 350108
钩吻素子对孤立大鼠的抗焦虑作用及其机制
陈超杰1钟志凤2谢璇1陈慧珍1俞昌喜1,2
1.福建医科大学福建省新药安全性评价中心,福建福州350108;2.福建医科大学药学院,福建福州350108
目的 研究钩吻素子连续皮下给药对孤立大鼠抗焦虑样行为的影响,并探讨其作用机制。方法 Wistar大鼠单笼饲养18 d,第12天开始每天皮下注射钩吻素子0.5、1.5mg/kg 1次,连续给药7 d。孤立饲养第17天(即给药第6天)进行高架十字迷宫试验,试验最后1 d(即给药第7天)进行自主活动试验和群居接触试验。行为学试验结束后,通过酶联免疫吸附测定(ELISA)检测动物血浆中促肾上腺皮质激素(ACTH)和皮质酮浓度,并测定海马中孕酮和别孕烯醇酮的含量。结果钩吻素子连续给药6 d能有效提高孤立大鼠在高架十字迷宫开臂区的活动情况,提示钩吻素子具有抗焦虑作用;钩吻素子连续给药7 d对大鼠自主活动无影响,但能提高配对孤立大鼠的接触次数和接触时间,进一步证明了钩吻素子的抗焦虑效应。与模型组比较,钩吻素子1.5mg/kg治疗组能降低孤立大鼠血浆中的皮质酮水平(P<0.05),钩吻素子0.5、1.5mg/kg治疗组均能提高大鼠海马中的别孕烯醇酮含量(P<0.01);而各组动物血浆中的ACTH浓度和海马中的孕酮含量则未见变化。结论 钩吻素子连续给药能增加孤立大鼠的抗焦虑样行为,其抗焦虑作用可能与调节大鼠海马的别孕烯醇酮含量和抑制下丘脑-垂体-肾上腺轴异常活动有关。
钩吻素子;焦虑;高架十字迷宫;群居接触试验;别孕烯醇酮;皮质酮
[Abstract]Objective To study the anxiolytic effects of koumine administrated repeatedly on isolated rats and to explore itsmechanism.Methods Each Wistar ratwas housed in individual cage for 18 days,and at day 12,the rat was subcutaneously administrated of 0.5 or 1.5mg/kg koumine once a day,lasting for 7 days.At the day 17 of individually housing(the sixth day of administration),the elevated plus-maze was used to observe the anxiolytic-like behaviors of rats.And at the final day of individually housing(the seventh day of administration),the behaviors of rats weremeasured by the locomotor activity test and social interaction test subsequently.After the animal behavioral tests,the concentrations of plasma adrenocorticotropic hormone(ACTH)and corticosterone,and the levels of progesterone and allopregnanolone in hippocampus of ratsweremeasured by enzyme-linked immunosorbent assay(ELISA).Results Repeated administration of koumine for 6 days significantly increased activities of isolated rats in the open arms of elevated plus-maze,indicating the anxiolytic effect of koumine.After administration for 7 days,rats did not alter their locomotor activity,but the paired rats in 1.5 mg/kg koumine treatment group increased the contact number and contact time comparing with the model group,further demonstrating the effectiveness of koumine against anxiety.Comparing with themodel group,1.5 mg/kg koumine treatment reduced the concentration of plasma corticosterone(P<0.05),and 0.5,1.5mg/kg of koumine treatment significantly increased the level of allopregnanolone in hippocampus of rats(P<0.05). The concentration of plasma ACTH and the level of progesterone in each group were not altered.Conclusion Repeated administration of koumine can increase the anxiolytic-like behaviors of isolated rats,its anxiolytic mechanism may be related to the mediation of allopregnanolone in hippocampus and the inhibition of abnormal activity of hypothalamic-pituitary-adrenal axis.
[Key words]Koumine;Anxiety;Elevated plus-maze;Social interaction test;Allopregnanolone;Corticosterone
钩吻素子为马钱科植物钩吻(Gelsemium elegans Benth.)生物碱单体中含量最高的有效成分[1]。本课题组前期工作发现,钩吻素子具有一定的抗焦虑作用[2-3]。但焦虑症在临床中是由多种病症所构成,其中包括广泛性焦虑症、社交恐惧障碍和惊恐障碍等,因此临床前的抗焦虑药研发需要更多的焦虑动物模型加以佐证[4]。为此,本研究通过高架十字迷宫和群居接触试验等动物行为学的方法,观察钩吻素子连续给药对大鼠的抗焦虑疗效,并在此基础上探讨其抗焦虑作用机制。
1 材料与方法
1.1主要试剂和仪器
钩吻素子由福建医科大学药学院对闽产野生钩吻(G.elegans)采用高速逆流色谱等技术中分离纯化获得(纯度99%)[5];地西泮注射液(天津金耀氨基酸有限公司,批号1201301);生理盐水(福州海王福药制药有限公司,中国,批号:150401B21)。钩吻素子和地西泮均用生理盐水配制或稀释到相应浓度的溶液进行给药。大鼠高架十字迷宫(EPM)和旷场试验箱(上海移数信息科技有限公司,中国);动物视频行为分析系统(Smart V2.5,Panlab公司,西班牙)。大鼠促肾上腺皮质激素(ACTH)酶联免疫吸附测定(ELISA)试剂盒(Phoenix制药公司,美国);大鼠皮质酮(CORT)和孕酮(PROG)ELISA试剂盒(Enzo公司,美国);大鼠别孕烯醇酮(ALLO)ELISA试剂盒(Arbor assays公司,美国)。
1.2动物
SPF级Wistar雄性大鼠64只,体质量180~220 g,购自北京维通利华实验动物技术有限公司[许可证编号:SCXK(京)2012-0001;合格证号:11400700116711]。动物饲养于屏障环境设施中,刚购进的动物检疫5 d后进行正式试验,检疫期间动物饲养盒的规格为465 mm×300 mm×190 mm,每盒5只,人工照明,明暗各12 h,室温20~26℃,湿度40%~70%。本研究实验动物的使用及处置方法符合动物福利的要求,实验开展前经过福建医科大学实验动物伦理委员会的审查批准。
1.3方法
1.3.1动物分组和给药处理大鼠检疫结束后,随机分为模型组、钩吻素子0.5 mg/kg治疗组、钩吻素子1.5mg/kg治疗组和阳性对照组(地西泮1mg/kg),独笼饲养18 d(动物饲养盒的规格为300 mm×250 mm× 170 mm),保证在群居接触试验前每只受试大鼠均未与其他大鼠接触,以建立大鼠孤立模型。在独笼饲养的第12天,大鼠按上述给药剂量以0.2 mL/100 g体重颈背部连续给药7 d,模型组动物给予等体积的生理盐水,阳性对照组则在第1~6天给予等体积生理盐水,第7天给予地西泮。动物在每天早上给药1次,各组于第6、7天给药1 h后分别进行EPM、自主活动和社会交往试验,试验安排见图1。行为学测试于每日8:00~14:00之间进行。

图1 钩吻素子对孤立大鼠抗焦虑作用的试验安排示意图
1.3.2EPM 在造模第17天(即连续给药第6天),挑选同一组体重相似的2只动物进行配对,配对大鼠体重相差不超过15 g。每个配对组选择1只动物进行EPM,其中阳性对照组动物未给予地西泮,其数据归入模型组中。测试时,将大鼠置于EPM中央区,头朝闭臂,通过计算机分析记录其在5min内的总路程、平均速度,以及在开臂区的路程比例、进入次数比例和停留时间比例。总路程和平均速度作为评价动物自主活动的指标;开臂区路程比例、进入次数比例和停留时间比例则是作为动物焦虑样行为的指标,开臂区的活动性增加则提示动物呈现抗焦虑样的行为变化。
1.3.3自主活动试验在造模第18天(给药第7天),各组动物给药后首先在旷场试验箱进行5min的自主活动试验。测验时,将大鼠置于旷场试验箱(50cm×50cm)的角落里,通过计算机记录动物的总路程和平均速度,以反映动物的自主活动情况。
1.3.4群居接触试验在自主活动试验结束后,每组配对的、首次接触的大鼠分别置于旷场试验箱对角线两端的两个角落里,通过摄像机拍摄下两只动物在10min内的活动情况。采取单盲的方式采集试验数据:由一名熟练而未被告知动物分组和处理情况的实验员,通过录像回放记录配对动物的接触次数和接触时间。本次群居接触的定义是两只大鼠之间的主动接触,包括互相靠近、触碰、跟随、嗅、爬上、下钻或围绕转圈等。而动物之间出现背靠背和攻击等被动性接触,则不列入到本次的接触行为。接触次数和时间的增加提示动物呈现抗焦虑样的行为变化。在以上EPM、自主活动试验和群居接触试验中,每次测试结束均对行为学仪器进行清洗,保证清洁无异味,避免影响下一只动物的测试结果。
1.3.5血浆ACTH和CORT测定动物行为学测试完成后,随机选取5只动物行20mg/kg乌拉坦腹腔注射麻醉,以含肝素钠的真空管于大鼠下腔腹主动脉收集血液,在4℃下4000 r/min离心15 min,分离血浆,于-80℃保存待测。各组动物血浆中的 ACTH和CORT浓度根据各自的ELISA试剂盒说明书进行检测。ACTH和CORT测试方法的最小可测量浓度分别为40、32 pg/mL,组间和组内的变异系数均小于10%。
1.3.6大脑海马PROG和ALLO测定采集血液完成的动物放血安乐死,并迅速取出大脑海马,全过程在冰上操作。每100毫克海马组织加入含1%PMSF的PBS 1mL,冰上匀浆15min以上,在4℃下3000 r/min离心30min,取上清液,于-80℃保存待测。各组动物海马组织中的PROG和ALLO含量根据各自的ELISA试剂盒说明书进行测定。PROG和ALLO测试方法的最小可测量浓度分别为15.62、391 pg/mL,组间和组内的变异系数均小于10%。
1.4统计学方法
应用SPSS statistic 21.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,采用单因素方差分析(One-way ANOVA)进行统计,随后通过LSD检验进行组间比较。以P<0.05为差异有统计学意义。
2 结果
2.1钩吻素子对大鼠高架十字迷宫试验的影响
大鼠高架十字迷宫试验结果显示,各组动物在高架十字迷宫中运动的总路程和平均速度比较差异均无统计学意义(P>0.05)。与模型组比较,钩吻素子1.5 mg/kg治疗组大鼠在开臂区的路程比例、开臂区进入次数比例和开臂区停留时间比例均有显著提高(P<0.01);钩吻素子0.5mg/kg治疗组大鼠开臂区进入次数比例亦显著高于模型组(P<0.05)。见图2。

图2 钩吻素子连续给药对大鼠在高架十字迷宫中行为活动的影响
2.2钩吻素子连续给药对大鼠自主活动的影响
大鼠在旷场试验箱中的自主活动结果显示,各组动物在旷场试验箱中运动的总路程和平均速度比较差异均无统计学意义(P>0.05)。见图3。
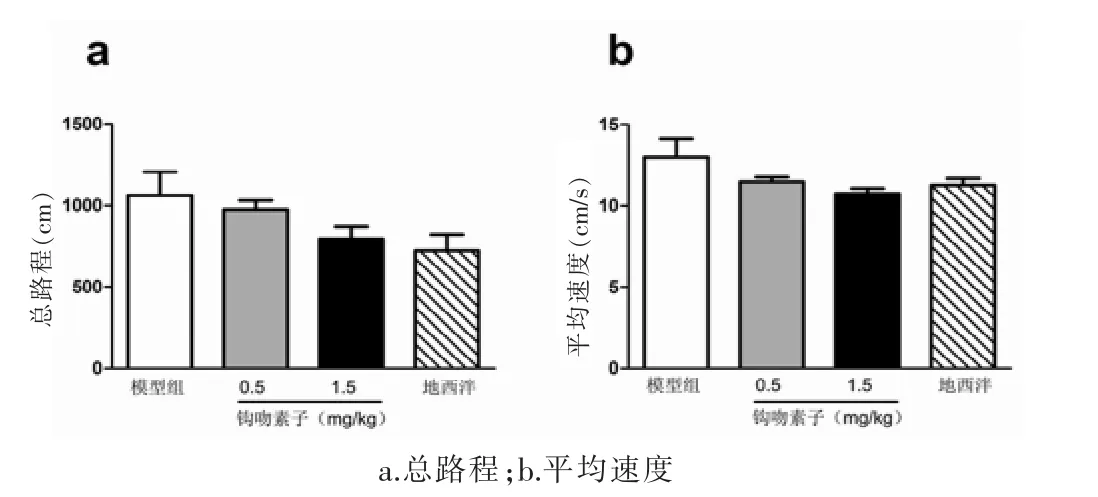
图3 钩吻素子连续给药对大鼠自主活动的影响(n=16)
2.3钩吻素子连续给药对大鼠群居接触试验的影响
与模型组比较,钩吻素子1.5mg/kg治疗组配对大鼠接触次数和接触时间显著提高(P<0.01、P<0.05);阳性对照组配对大鼠的接触次数和接触时间亦显著高于模型组(P<0.05、P<0.01),提示实验系统的可靠性。见图4。

图4 钩吻素子连续给药对两两配对大鼠群居接触试验的影响(n=8)
2.4钩吻素子连续给药对大鼠血浆中 ACTH和CORT水平的影响
各组动物血浆中的ACTH水平比较差异无统计学意义(P>0.05),见图5a。与模型组比较,钩吻素子1.5 mg/kg治疗组和阳性对照组大鼠血浆中的CORT水平显著下降(P<0.05、P<0.01),见图5b。
2.5钩吻素子连续给药对大鼠海马中PROG和ALLO含量的影响
各组动物海马中的PROG含量比较差异无统计学意义(P>0.05),见图6a。与模型组比较,钩吻素子0.5、1.5 mg/kg治疗组大鼠海马中的ALLO含量显著上升(P<0.01),阳性对照组则未见改变,见图6b。
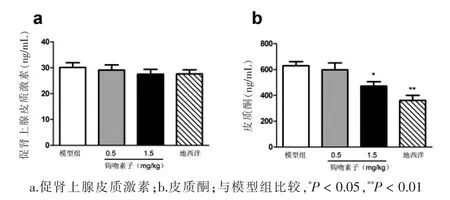
图5 钩吻素子连续给药对大鼠血浆中促肾上腺皮质激素和皮质酮水平的影响(n=5)

图6 钩吻素子连续给药对大鼠海马中孕酮和别孕烯醇酮含量的影响(n=5)
3 讨论
大鼠单独饲养的孤立方式是一种快速有效的应激作用,通过这种应激能提高动物的焦虑水平[6-7]。EPM是利用啮齿类动物对新异环境和高悬开臂的探究和恐惧的矛盾冲突状态,通过它们在开臂区探索行为变化,评价其焦虑状态[8]。群居接触试验则是通过配对孤养大鼠彼此渴望接触,但对陌生环境产生恐惧,而形成矛盾冲突状态,利用它们的接触情况反映其焦虑状态[6]。这些经典的焦虑模型被神经精神药理学研究广泛采用。旷场的自主活动试验则是用于评价动物的整体运动情况。一般来说,只有在受试药不影响动物自主活动性的情况下,产生抗焦虑样行为,才可认为该药具备抗焦虑作用[2,6]。本研究通过EPM、自主活动试验和群居接触试验,提示钩吻素子连续皮下给药超过6 d,即可增强孤立大鼠的抗焦虑样行为,且未影响其自主活动情况,进一步证明了钩吻素子的抗焦虑作用。
PROG和ALLO为脑内重要的神经甾体,它们与焦虑症的发病机制和治疗密切相关[9-10]。其中,ALLO能激动焦虑动物的GABAA受体,使之产生抗焦虑样行为的改变[11]。临床上也发现患有恐慌症的患者体内的ALLO水平显著下降[12]。本课题组前期研究发现,钩吻素子的镇痛作用与其提高脊髓ALLO水平有关[13-14],能够抑制神经甾体合成的士的宁能呈浓度依赖性地拮抗钩吻素子的抗焦虑作用[2]。焦虑症的发病部位主要涉及海马、蓝斑、杏仁核、边缘叶、额叶皮质、下丘脑和网状结构等脑区,其中海马与焦虑症的行为表现关系密切[15]。同时,有文献报道海马富含转位蛋白 (TSPO,18 kDa),并能表达各种合成神经甾体如ALLO所需的酶[16]。海马微量注射TSPO激动剂能产生与ALLO合成、增强GABAA受体功能密切相关的抗焦虑作用[17]。本研究发现钩吻素子连续给药能提高孤立大鼠海马的ALLO的含量,但对PROG含量则无影响。由此提示了钩吻素子的抗焦虑作用与大脑海马的ALLO含量密切相关。这与本课题之前报道的结果一致[18]。此外,阳性药地西泮未能改变大鼠海马中PROG和ALLO的含量。
本研究还发现,钩吻素子连续给药能有效降低孤立大鼠血中的CORT水平,但对ACTH则无影响。应激状态下产生的焦虑情绪与下丘脑-垂体-肾上腺(HPA)轴的关系密切[19]。应激反应可激活下丘脑室释放促肾上腺皮质激素释放激素(CRH),进而使垂体释放ACTH,ACTH经血液达到肾上腺皮质,并促进其释放糖皮质激素,即CORT或皮质醇[20]。因此,应激状态下机体循环系统中的CORT水平与焦虑情绪密切相关。在慢性应激状态下,CORT水平持续增加,则会引起大脑海马损伤[21]。还有研究发现,遭受早期母婴分离应激的大鼠在给予ALLO后,能有效抑制焦虑样行为,并能调节应激对肾上腺皮质分泌反应、保护糖皮质激素负反馈效应,以及改变下丘脑CRH和海马糖皮质激素受体的转录水平,提示增加体内的ALLO可有效抑制应激引起的HPA轴活性失调[22]。结合以上证据与本次研究结果可以看出,钩吻素子的抗焦虑作用可能通过调节海马的ALLO含量,从而抑制HPA轴的异常活化,降低血液中的CORT水平,最终抑制焦虑行为的发生。另外值得一提的是,阳性药地西泮也能降低孤立大鼠血浆中的CORT水平,但并不能改变其海马中的神经甾体含量,提示钩吻素子与地西泮的抗焦虑作用机制可能存在差异。
综上所述,本研究结果提示,钩吻素子连续给药能增加孤立大鼠的抗焦虑样行为,其抗焦虑作用可能与调节大鼠海马的ALLO含量和抑制HPA轴的异常活动有关。
[1]张兰兰,王志睿,黄昌全,等.钩吻总生物碱中钩吻素子的提取与分离[J].第一军医大学学报,2004,24(9):1006-1008.
[2]Liu M,Huang HH,Yang J,et al.The active alkaloids of Gelsemium elegans Benth.are potent anxiolytics[J].Psychopharmacology,2013,225(4):839-851.
[3]黄慧慧,刘铭,陈超杰,等.钩吻素子对大鼠焦虑行为的影响[J].西北药学杂志,2014,26(6):593-595.
[4]Cryan JF,Sweeney FF.Theageofanxiety:roleofanimalmodels of anxiolytic action in drug discovery[J].Br JPharmacol,2011,164(4):1129-1161.
[5]Su YP,Shen J,Xu Y,et al.Preparative separation of alkaloids from Gelsemium elegans Benth.using pH-zone-refining counter-current chromatography[J].JChromatogr A,2011,1218(23):3695-3698.
[6]File SE,Seth P.A review of 25 years of the social interaction test[J].Eur JPharmacol,2003,463(1/2/3):35-53.
[7]Morozova A,Zubkov E,Strekalova T,et al.Ultrasound of alternating frequencies and variable emotional impact evokes depressive syndrome in mice and rats[J].Prog Neuropsychopharmacol Biol Psychiatry,2016,68:52-63.
[8]Hamson DK,Jones BA,Csupity AS,etal.Androgen insensitivemale rats display increased anxiety-like behavior on theelevated plusmaze[J].Behav Brain Res,2014,259:158-163.
[9]Pang Y,Dong J,Thomas P.Characterization,neurosteroid binding and brain distribution of human membrane progesterone receptorsδand{epsilon}(mPRδand mPR{epsilon})and mPRδinvolvement in neurosteroid inhibition of apoptosis[J].Endocrinology,2013,154(1):283-295.
[10]Longone P,Di Michele F,D'agati E,et al.Neurosteroids asneuromodulatorsin the treatmentofanxiety disorders[J]. Front Endocrinol(Lausanne),2011,2:55.
[11]Jin X,Zhong W,Jiang C.Time-dependentmodulation of GABA(A)-ergic synaptic transmissionbyallopregnanolone in locus coeruleus neurons of Mecp2-nullmice[J].Am J Physiol Cell Physiol,2013,305(11):C1151-C1160.
[12]Str ohle A,Romeo E,diMichele F,etal.Induced panic attacksshiftgamma-aminobutyric acid type A receptormodulatory neuroactive steroid composition in patients with panic disorder:preliminary results[J].Arch Gen Psychiatry,2003,60(2):161-168.
[13]Xu Y,Qiu HQ,Liu H,et al.Effects of koumine,an alkaloid of Gelsemium elegans Benth.,on inflammatory and neuropathic pain models and possible mechanism with allopregnanolone[J].Pharmacol Biochem Behav,2012,101(3):504-514.
[14]Qiu H,Xu Y,Jin G,et al.Koumine enhances spinal cord 3alpha-hydroxysteroid oxidoreductase expression and activity in a ratmodel of neuropathic pain[J].Mol Pain,2015,11(1):1-13.
[15]de Oliveira MR,Silvestrin RB,Mello E Souza T,et al. Oxidative stress in the hippocampus,anxiety-like behavior and decreased locomotory and exploratory activity of adult rats:effects of sub acute vitamin A supplementation at therapeutic doses[J].Neurotoxicology,2007,28(6):1191-1199.
[16]Mellon SH,Deschepper CF.Neurosteroid biosynthesis:genes for adrenal steroidogenic enzymes are expressed in the brain[J].Brain Res,1993,629(2):283-292.
[17]Bitran D,Foley M,Audette D,etal.Activation of peripheral mitochondrial benzodiazepine receptors in the hippocampus stimulates allopregnanolone synthesis and produces anxiolytic-like effects in the rat[J].Psychopharmacology,2000,151(1):64-71.
[18]黄慧慧,陈超杰,刘铭,等.钩吻素子抗焦虑作用及其对海马区神经甾体水平的影响[J].海峡药学,2016,28(2):21-24.
[19]Faravelli C,Lo Sauro C,Lelli L,et al.The role of life events and HPA axis in anxiety disorders:a review[J]. Curr Pharm Des,2012,18(35):5663-5674.
[20]Gunn BG,Cunningham L,Mitchell SG,et al.GABAA receptor-acting neurosteroids:a role in the development and regulation of the stress response[J].Front Neuroendocrinol,2015,36:28-48.
[21]Reich CG,Mihalik GR,Iskander AN,et al.Adolescent chronic mild stress alters hippocampal CB1 receptormediated excitatory neurotransmission and plasticity[J]. Neuroscience,2013,253(17):444-454.
[22]Patchev VK,Montkowski A,Rouskova D,et al.Neonatal treatment of rats with the neuroactive steroid tetrahydrodeoxycorticosterone(THDOC)abolishes the behavioral and neuroendocrine consequences of adverse early life events[J].JClin Invest,1997,99(5):962-966.
Discussion on the anxiolytic effect of koumine for the isolated rats and its mechanism
CHEN Chaojie1ZHONG Zhifeng2XIE Xuan1CHEN Huizhen1YU Changxi1,2
1.Fujian Center for Safety Evaluation of New Drug,Fujian Medical University,Fujian Province,Fuzhou350108,China;2.College of Pharmacy,Fujian Medical University,Fujian Province,Fuzhou350108,China
R964
A
1673-7210(2016)09(b)-0008-05
2016-05-02本文编辑:张瑜杰)
国家自然科学基金资助项目(81302756);教育部高等学校博士学科点专项科研基金(20133518110004);福建医科大学博士科研启动基金项目(2001BS003)。
俞昌喜(1963.12-),男,博士,教授,博士生导师;研究方向:神经精神药理学。
