江苏大学附属昆山医院2012-2014年细菌耐药性分析
2016-10-22顾金花张庆慧
顾金花, 顾 涛, 张庆慧, 陈 玲, 徐 姿
·论著·
江苏大学附属昆山医院2012-2014年细菌耐药性分析
顾金花, 顾 涛*, 张庆慧*, 陈 玲*, 徐 姿*
目的 了解江苏大学附属昆山医院2012—2014年临床常见分离菌的分布及其对抗菌药物的耐药情况,为临床用药提供依据。方法 采用自动化仪器和纸片扩散法(K-B法)对3年中临床分离的5 471株细菌进行药敏试验并按CLSI 2015年标准判断结果。结果 5 471株临床分离株中革兰阳性菌936株(17.1 %),革兰阴性菌4 535株(82.9 %)。甲氧西林耐药金黄色葡萄球菌(金葡菌,MRSA)和凝固酶阴性葡萄球菌(MRCNS)在各自菌种中的检出率为39.0 %和75.6 %,未发现耐万古霉素和利奈唑胺的金葡菌。MRSA对抗菌药物的耐药率均高于甲氧西林敏感金葡菌(MSSA)。肠球菌中屎肠球菌对大多数抗菌药物的耐药率高于粪肠球菌,屎肠球菌和粪肠球菌对万古霉素的耐药率分别为5.3 %和0.4 %。革兰阴性菌中肠杆菌科细菌产ESBL株对抗菌药物的耐药率均显著高于非产ESBL株。鲍曼不动杆菌对抗菌药物有较高的耐药率。结论 细菌耐药情况严重,临床应重视细菌耐药性监测并根据结果合理使用抗菌药物。
细菌耐药性监测; 药物敏感性试验; 抗菌药物
随着抗菌药物的广泛使用,多重耐药、广泛耐药和全耐药的细菌呈现越来越多的趋势,再加上新抗菌药物研发困难,导致感染性疾病的治疗面临巨大的挑战[1-2]。因此对细菌耐药性的监测显得非常重要,其结果可为临床医师合理使用抗菌药物提供依据。现总结我院2012年1月-2014年12月3年间临床常见分离菌株的耐药情况,报道如下。
1 材料与方法
1.1 材料
1.1.1 细菌来源 收集我院2012年1月-2014年12月临床常见分离菌株,剔除同一患者同一部位的重复菌株,凝固酶阴性葡萄球菌仅保留分离自血、脑脊液等无菌体液标本。
1.1.2 培养基和抗菌药物纸片 药敏试验用培养基采用上海科玛嘉微生物技术有限公司生产的MH培养基和含5 %脱纤维羊血MH培养基;抗菌药物纸片为英国OXOID公司商品。
1.2 方法
1.2.1 药敏试验 采用法国生物梅里埃公司的VITEK自动化仪器进行药敏测定,其余需要补充药敏按照2015年版美国临床和实验室标准化协会(CLSI)推荐的纸片扩散法(K-B法)。质控菌株为大肠埃希菌ATCC 25922、 肺炎克雷伯菌ATCC 700603、 铜绿假单胞菌ATCC 27853、金黄色葡萄球菌(金葡菌)ATCC25923、肺炎链球菌 ATCC 49619、 流感嗜血杆菌ATCC 49247 。药敏结果判读按照CLSI 2015年版标准[3]。
1.2.2 ESBL检测 按CLSI推荐的纸片法筛选和酶抑制剂增强确证试验检测大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌中产ESBL菌株。
1.2.3 耐万古霉素肠球菌(VRE)检测 经仪器法测定MIC结果为万古霉素不敏感者,用万古霉素和替考拉宁E试验条测定MIC值。
1.2.4 碳青霉烯类耐药肠杆菌科细菌(CRE)定义 对亚胺培南、美罗培南或厄他培南中任何一种药物耐药者。
1.2.5 统计分析 采用WHONET5.6软件统计分析。
2 结果
2.1 细菌种类及分布
共分离到非重复菌株5 471株,其中革兰阳性菌936株(17.1 %)。金葡菌487株,占革兰阳性菌的52.0 %(487/936);肠球菌288株,占30.8 %(288/936),主要是屎肠球菌和粪肠球菌;凝固酶阴性葡萄球菌62株,占6.6 %(62/936);肺炎链球菌38株占4.0%(38/936);β溶血链球菌31株占3.3 %(31/936)。革兰阴性菌4 535株(82.9 %),主要为肠杆菌科细菌和不发酵糖革兰阴性杆菌,分离前5位的是大肠埃希菌1 056株,占革兰阴性菌的23.3 %(1 056/4 535);克雷伯菌属930株占20.5 %(930/4 535);假单胞菌属824株占18.2 %(824/4 535);不动杆菌属602株占13.3 %(602/4 535)和肠杆菌属352株占7.8 %(352/4 535)。住院的分离菌株占85.6 %,门急诊占14.4 %。各标本主要来源于呼吸道、尿液、血液,其中呼吸道标本3 458份(63.2 %),尿液标本805份(14.7 %),血液标本312份(5.7 %),其他标本占16.4 %。主要细菌菌种分布见表1。

表1 2012-2014 年主要细菌种类Table1 The distribution of bacterial species from 2012 to 2014
2.2 革兰阳性菌对抗菌药物的耐药率和敏感率
2.2.1 葡萄球菌属 葡萄球菌中甲氧西林耐药金葡菌(MRSA)和凝固酶阴性葡萄球菌(MRCNS)的检出率分别为39.0 %、72.6 %,两者对β内酰胺类、大环内酯类、氨基糖苷类和喹诺酮类等抗菌药物的耐药率显著高于甲氧西林敏感株(MSSA和MSCNS)。MRSA对左氧氟沙星、红霉素、庆大霉素、环丙沙星和克林霉素的耐药率均高于55 %,对甲氧苄啶-磺胺甲唑的耐药率为16.8 %,高于MSSA菌株的8.6 %。MRCNS对红霉素、甲氧苄啶-磺胺甲唑的耐药率均高于60 %,但对利福平的耐药率较低,为18.4 %。葡萄球菌属中均未检出万古霉素、利奈唑胺耐药的菌株。见表2。

表2 葡萄球菌属细菌对抗菌药物的耐药率和敏感率Table2 Susceptibility of Staphylococcus strains to antimicrobial agents
2.2.2 肠球菌属 288株肠球菌中屎肠球菌137株占47.6 %,粪肠球菌136株占47.2 %,其他肠球菌占5.2 %。除四环素外,粪肠球菌对大多数抗菌药物的耐药率均显著低于屎肠球菌,粪肠球菌对万古霉素和利奈唑胺的耐药率低于1 %,对呋喃妥因和氨苄西林耐药率分别为1.4 %和11.7 %,对红霉素、克林霉素的耐药率均超过70 %。屎肠球菌对万古霉素的耐药率为5.3 %,对利奈唑胺的耐药率为0.4 %,对呋喃妥因的耐药率低于40 %,对克林霉素的耐药率为77.8 %,但对左氧氟沙星、环丙沙星、青霉素、红霉素、氨苄西林和利福平的耐药率均高于80 %。见表3。
2.2.3 肺炎链球菌 共检出38株肺炎链球菌,其中30株来源于痰标本, 占78.9 %。 青霉素敏感(PSSP)、中介(PISP)和耐药(PRSP)菌株各占77.6 %、8.6 %和13.8 % 。肺炎链球菌对红霉素、克林霉素、甲氧苄啶-磺胺甲唑的耐药率较高,已出现少数对左氧氟沙星耐药株,未检测出对万古霉素和利奈唑胺耐药的菌株。

表3 粪肠球菌和屎肠球菌对抗菌药物的耐药率和敏感率Table3 Susceptibility of Enterococcus species to antimicrobial agents
2.3 革兰阴性菌对抗菌药物的耐药率和敏感率
2.3.1 肠杆菌科细菌 2 662株肠杆菌科细菌中主要是大肠埃希菌、克雷伯菌属和肠杆菌属等,对碳青霉烯类、头孢哌酮-舒巴坦、哌拉西林-他唑巴坦和阿米卡星的耐药率均较低,对氨苄西林和头孢唑林的耐药率均较高。其中大肠埃希菌对大多抗菌药物的耐药率均高于其他菌属;而对碳青霉烯类的耐药率低于克雷伯菌属。见表4。

表4 肠杆菌科细菌对抗菌药物的耐药率和敏感率Table4 Susceptibility of Enterobacteriaceae species to antimicrobial agents
产ESBL大肠埃希菌对大多数抗菌药物的耐药率均高于非产ESBL菌株,此类菌对头孢哌酮- 舒巴坦、哌拉西林-他唑巴坦、亚胺培南、美罗培南、呋喃妥因和阿米卡星的耐药率低于10 %,对环丙沙星、庆大霉素、左氧氟沙星、甲氧苄啶-磺胺甲唑和其他头孢菌素类抗菌药物的耐药率均较高。产ESBL肺炎克雷伯菌对抗菌药物的耐药率也大多高于非产ESBL株,对碳青霉烯类抗生素耐药率低于10 %,对头孢哌酮-舒巴坦、哌拉西林-他唑巴坦和阿米卡星的耐药率则高于10 %,对其他抗菌药物的耐药率均较高。见表5。
2.3.2 不发酵糖革兰阴性杆菌 1 853株不发酵糖革兰阴性菌中,铜绿假单胞菌对亚胺培南和美罗培南的耐药率分别为25.7 %和28.6 %,对阿米卡星、环丙沙星和左氧氟沙星的耐药率为11.3 %、20.9 %和18.2 %,对两种含酶抑制剂头孢哌酮-舒巴坦和哌拉西林-他唑巴坦的耐药率低于30 %。鲍曼不动杆菌对亚胺培南和美罗培南的耐药率分别为65.6 %和41.4 %,对阿米卡星、头孢哌酮-舒巴坦和哌拉西林-他唑巴坦的耐药率均大于40 %,对其他抗菌药耐药率大多在50 %以上。嗜麦芽窄食单胞菌对米诺环素、左氧氟沙星和甲氧苄啶-磺胺甲唑的耐药率均低于10 %,对头孢他啶的耐药率为22.9 %。见表6。
3 讨论
耐药菌的复杂性和反复发作的特点严重威胁着受感染患者,并经常导致不良预后,如住院时间较长,病死率增加,以及更高的住院费用[4-5]。因此对临床分离菌的耐药监测是非常重要的,通过细菌耐药性监测我们就可以采取有效的预防和控制措施,避免耐药菌的流行。本研究统计分析了我院2012-2014年临床分离病原菌的分布和对抗菌药物的耐药率,对流行病学调查及临床合理使用抗生素提供了依据。
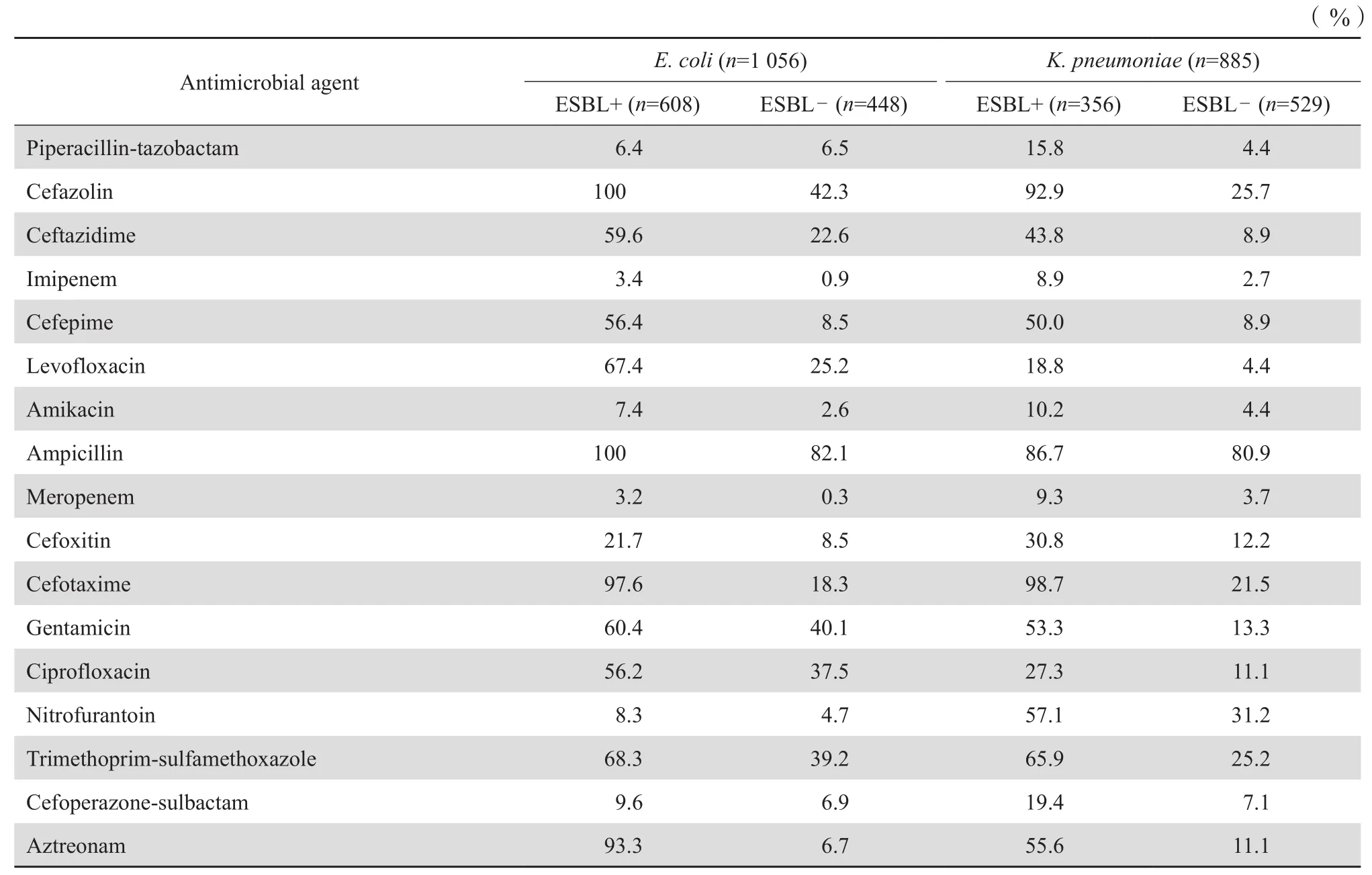
表5 主要产ESBL细菌对抗菌药物的耐药率Table5 Susceptibility of ESBLs-producing strains to antimicrobial agents

表6 主要不发酵糖革兰阴性杆菌对抗菌药物的耐药率和敏感率Table6 Susceptibility of non-fermentative gram-negative bacilli to antimicrobial agents
研究结果显示,本院分离到的细菌中分离率最高的革兰阳性菌分别为金葡菌、屎肠球菌、粪肠球菌、凝固酶阴性葡萄球菌和肺炎链球菌,金葡菌占革兰阳性菌52.0 %,稍低于CHINET细菌耐药性监测网的数据[6]。凝固酶阴性葡萄球菌的分离率比较低,可能与临床规范化采集标本、提高送检标本质量有关。血培养凝固酶阴性菌的检出率与采血前的消毒操作等密切相关。分离率前5位的革兰阴性菌为大肠埃希菌、克雷伯菌属、假单胞菌属、不动杆菌属和肠杆菌属,主要是肠杆菌科和不发酵糖革兰阴性杆菌占据。我院的门急诊细菌分离率为14.4 %,与2014 CHINET细菌耐药性监测相差不大[6]。 标本类型中呼吸道标本占主要地位,这与其他医院的菌种构成有差别,可能与微生物工作人员与临床医师间缺乏沟通有关系,未能及时指导临床该如何规范采集标本。尿标本细菌分离率占14.7 %,其次是血标本占5.7 %,这比CHINET细菌耐药性监测网数据构成稍低[7]。分析其原因,尿液标本分离率少可能与患者留取尿液不规范导致非致病菌生长,而血液标本分离率低可能因临床工作人员未做到双侧双瓶采样或未把握采样时间而导致阴性结果。
统计显示,MRSA检出率为39.0 %,低于全国监测数据[6-7]。所有MRSA株对万古霉素和利奈唑胺均敏感,此两种抗菌药物现已作为对抗革兰阳性菌的有效药物。粪肠球菌和屎肠球菌已出现对万古霉素和利奈唑胺耐药的菌株,而且屎肠球菌的比例更大,这可能与细菌携带VanA、VanB、VanM型基因有关[8-9],此类细菌除了对万古霉素耐药还对氨苄西林、高浓度氨基糖苷类和喹诺酮类抗菌药物耐药。本研究中PRSP占13.8 %.
肠杆菌科细菌对多种抗菌药物的耐药率呈上升趋势,主要与产ESBL和产AmpC酶相关,产ESBL株对抗菌药物的耐药率普遍高于非产酶株,ESBL能水解青霉素、广谱青霉素、头孢菌素、单环类、第四代头孢菌素,但不能水解碳青霉烯类和头霉素类。而CRE菌株的检出率也呈明显上升趋势[10],肠杆菌科对碳青霉烯类药物耐药的主要机制为产碳青霉烯酶,碳青霉烯酶中研究较多的是KPC酶,还有金属酶IPM类、VIM类和NDM类[11-12]。有研究表明患者病房和床位的频繁更换、使用广谱抗菌药物、侵袭性诊疗操作及患者本身严重的基础疾病是CRE传播或定植菌感染的危险因素[13]。因此尤其需要加强医院感控措施,如医护人员要做好手卫生,对CRE患者隔离措施等。
不发酵糖革兰阴性杆菌中铜绿假单胞菌的检出最多,鲍曼不动杆菌第2位。本研究显示,铜绿假单胞菌对阿米卡星、头孢他啶、两种酶抑制剂复合剂(哌拉西林-他唑巴坦和头孢哌酮-舒巴坦)的敏感率较高,可选择联合用药。鲍曼不动杆菌对大多数抗菌药物的耐药率都较高,对各类药物有各自的耐药机制[14],呈多重耐药和广泛耐药的趋势,给由此菌引起感染的治疗带来很大挑战。因此医务人员要引起高度重视,要对广泛耐药的鲍曼不动杆菌患者及时隔离,注意手卫生,环境空气消毒,有效减少细菌的传播,降低医院感染的发生率。
综上所述,本研究分析了我院3年中常见分离菌的分布及对抗菌药物的耐药情况,多重耐药菌株日趋严重,少见耐药表型已有出现。通过这项研究,我们可以更好地把握耐药菌的情况,并采取更有效的措施来控制耐药菌在未来发生。
[1]NAMBIAR S, LAESSIG K, TOERNER J, et al. Antibacterial drug development: challenges, recent developments, and future considerations[J]. Clin Pharmacol Ther, 2014, 96(2): 147-149.
[2]STAFFORD KA, BOUTIN M, EVANS SR, et al. Difficulties in demonstrating superiority of an antibiotic for multidrug-resistant bacteria in nonrandomized studies[J]. Clin Infect Dis, 2014, 59(8): 1142-1147.
[3]Clinical and Laboratory Standards Institute. Performance Standards forAntimicrobial Susceptibility Testing[S]. Twenty-Fifth Informational Supplement, 2015, M100-S25.
[4]SELIGMAN R, RAMOS-LIMA LF, OLIVEIRA VDO A, et al. Risk factors for infection with multidrug-resistant bacteria in non-ventilated patients with hospital-acquired pneumonia[J]. J Bras Pneumol, 2013, 39(3): 339-348.
[5]BOUCHER HW, TALBOT GH, BRADLEY JS, et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009, 48(1):1-12.
[6]胡付品,朱德妹,汪复,等. 2014年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2015, 15(5): 401-410.
[7]胡付品,朱德妹,汪复,等. 2013 年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2014, 14(5): 365-374.
[8]LEE CR, LEE JH, PARK KS, et al. Quantitative proteomic view associated with resistance to clinically important antibiotics in Gram-positive bacteria: a systematic review[J]. Frontiers in Microbiology, 2015, 6: 828.
[9]RAMOS S, CHAFSEY I, SILVA N, et al. Effect of vancomycinon the proteome of the multiresistant Enterococcus faecium SU18 strain[J]. J Proteomics, 2015, 113: 378-387.
[10]HU F, CHEN S, XU X, et al. Emergence of carbapenemresistant clinical Enterobacteriaceae isolates from a teaching hospital in Shanghai, China[J]. J Med Microbiol, 2012, 61(Pt 1): 132-136.
[11]NORDMANN P, GNIADKOWSKI M, GISKE CG, et al. Identification and screening of carbapenemase-producing Enterobacteriaceae[J]. Clin Microbiol Infect, 2012, 18(5):432-438.
[12]TZOUVELEKIS LS, MARKOGIANNAKIS A, PSICHOGIOU M, et al. Carbapenemases in Klebsiella pneumoniae and other Enterobacteriaceae: an evolving crisis of global dimensions[J]. Clin Microbiol Rev, 2012, 25(4): 682-707.
[13]QIN X, YANG Y, HU F, et al. Hospital clonal dissemination of Enterobacter aerogenes producing carbapenemase KPC-2 in a Chinese teaching hospital[J]. J Med Microbiol, 2014, 63(Pt 2):222-228.
[14]张辉,张小江,徐英春,等. 2012 年中国CHINET不动杆菌属细菌耐药性监测[J]. 中国感染与化疗杂志, 2014, 14(5):392-397.
Surveillance of antibiotic resistance in Kunshan Hospital Affiliated to Jiangsu University from 2012 to 2014
GU Jinhua, GU Tao, ZHANG Qinghui, CHEN Ling, XU Zi.
(Department of Infection Control, Kunshan Hospital Affiliated to Jiangsu University, Kunshan Jiangsu 215300, China)
Objective To examine the distribution and antibiotic resistance of common clinical isolates in Kunshan Hospital Affiliated to Jiangsu University from 2012 to 2014. Methods A total of 5 471 clinical isolates were isolated from clinical specimens. Automated systems and disk diffusion method were used to determine the susceptibility of these bacterial isolates according to American Society of Clinical and Laboratory Standards Institute (CLSI) 2015 guidelines. Results Of the 5 471 strains,936 (17.1 %) were gram-positive bacteria, and 4 535 (82.9 %) were gram-negative bacteria. The prevalence of methicillin-resistant S. aureus (MRSA) and coagulase-negative Staphylococcus (MRCNS) was 39.0 % and 75.6 %, respectively. No S. aureus strain was found resistant to vancomycin or linezolid. MRSA strains showed higher resistance rate to most antimicrobial agents than methicillinsensitive strains (MSSA). Overall, 5.3 % of the E. faecalis and 0.4 % of the E. faecium strains were resistant to vancomycin. As for the gram-negative bacteria, ESBLs-producing Enterobacteriaceae strains were generally more resistant than non-ESBLsproducing strains. A. baumannii isolates were highly resistant to most antimicrobial agents. Conclusions As antibiotic resistance is getting worse, we should pay more attention to the monitoring of antimicrobial resistance and rational use of antibiotics based on susceptibility testing.
antibiotic resistance surveillance; antimicrobial susceptibility testing; antimicrobial agent
R378
A
1009-7708(2016)04-0637-07
10.16718/j.1009-7708.2016.04.020
2015-11-12
2015-12-17
江苏大学附属昆山医院医院感染管理科,江苏昆山 215300;*检验科。
顾金花(1981—),女,硕士研究生,主管检验师,主要从事微生物检验工作。
徐姿,E-mail:tulip1981@163.com。
