猪繁殖与呼吸综合征病毒分离株E11105 N基因的序列分析与原核表达
2016-10-20张升波陈绍品温贵兰伍昌华李天珍王开功龚新勇
张升波,陈绍品,温贵兰,伍昌华,李天珍,李 晨,王开功,文 明,龚新勇
(贵州大学动物科学学院预防兽医实验室,贵州贵阳 550025)
猪繁殖与呼吸综合征病毒分离株E11105 N基因的序列分析与原核表达
张升波,陈绍品,温贵兰*,伍昌华,李天珍,李晨,王开功,文明,龚新勇
(贵州大学动物科学学院预防兽医实验室,贵州贵阳 550025)
为研究PRRSV N蛋白的结构、功能以及N蛋白在病毒致病中的作用,以临床分离PRRSV毒株E11105为研究对象,采用Primer Premier 5.0设计一对特异性引物,经RT-PCR扩增出N基因片段,利用相关分子生物学软件对N基因序列进行分析;将N基因克隆连接到pCold Ⅰ原核表达载体上,经PCR、双酶切鉴定及序列测定后,得到重组质粒pCold Ⅰ-N,将pCold Ⅰ-N转入大肠埃希菌BL21(DE3)感受态细胞中,IPTG诱导表达后用SDS-PAGE蛋白电泳及Western blot验证分析。结果显示,分离株E11105 N基因与北美洲型代表株VR-2332、欧洲型代表株Lelystad virus(LV)、中国2006年暴发的高致病性PRRSV代表株JXA1、中国代表株CH-1a的核苷酸序列同源性分别为93.3%、34.7%、99.2%、95.4%,氨基酸序列同源性分别为94.4%、15.3%、94.4%、99.2%;系统进化树显示,E11105株N基因与美洲型代表株VR-2332、中国高致病性JXA1毒株的亲缘关系较近;分离株E11105 N基因所编码蛋白不存在跨膜区;二级结构主要以α-螺旋和无规则卷曲为主,分别占20.33%和63.41%;预测该蛋白可能存在5个较为明显的B细胞优势抗原表位。SDS-PAGE蛋白电泳结果表明,重组N蛋白主要存在于菌体沉淀中,分子质量约为16.7 ku;Western blot结果显示,带His标签的重组表达蛋白能被His单克隆抗体识别,显色后条带约为16.7 ku,与SDS-PAGE蛋白电泳的条带大小一致。
猪繁殖与呼吸综合征病毒;N基因扩增;序列分析;原核表达
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)也称猪蓝耳病,是猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种传染病[1]。PRRSV既可水平传播,也可通过胎盘感染胎儿,仔猪及成年猪被PRRSV感染后多表现为呼吸困难、肺炎、生长速度减慢,并可能出现其他病毒或细菌的继发性感染[2-3]。目前将PRRSV分为2个基因型,即欧洲型(代表株为LV株)和美洲型(代表株为VR-2332株)[4]。PRRSV是单股正链RNA病毒,其基因组包含至少9个开放阅读框(open reading frame,ORF),其中ORF1a和ORF1b约占整个基因组全长的2/3,编码14个非结构蛋白,其余基因编码8个病毒结构蛋白[5-6]。核衣壳蛋白N是PRRSV的结构蛋白之一,由ORF7基因编码,为碱性蛋白,N蛋白含有5个~7个抗原决定簇,具有良好的抗原性,是功能最为复杂的蛋白[7-8]。本研究以临床分离的PRRSV毒株E11105为材料,应用基因工程技术成功构建了携带E11105毒株N基因的重组原核表达质粒pCold Ⅰ-N并对其N基因进行序列分析,首次对E11105毒株N基因编码蛋白进行预测分析并实现了E11105毒株N蛋白在大肠埃希菌原核表达系统中的表达。本研究结果为后续进一步研究E11105毒株N蛋白的结构、功能以及PRRSV N蛋白在病毒致病中的作用奠定了基础。
1 材料与方法
1.1材料
1.1.1生物材料猪繁殖与呼吸综合征病毒分离毒株E11105,浙江大学方维焕教授惠赠(浙江分离株);pCold Ⅰ质粒,上海兽医研究所马永志教授惠赠;大肠埃希菌BL21(DE3)、DH5α感受态细胞、Marc145细胞,贵州大学动物科学学院预防兽医实验室保存。
1.1.2所用试剂RNA提取试剂盒、琼脂糖凝胶回收试剂盒、dNTP,上海生工生物工程技术服务有限公司产品;RNasin○R核酸酶抑制剂、反转录酶M-MLV,普洛麦格(北京)生物技术有限公司产品;Oligo(dT)15 Primer,天根生化科技(北京)有限公司产品;Primer STAR HS DNA Polymerase、限制性内切酶EcoRⅠ和XbaⅠ、连接酶Solution Ⅰ、质粒DNA抽提试剂盒、Marker DL 2 000,宝生物工程(大连)有限公司产品;His-tag抗体、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)、二氨基联苯胺(DAB)显色试剂盒,碧云天生物公司产品。
1.2方法
1.2.1引物设计与合成根据GenBank中已公布的猪繁殖与呼吸综合征病毒全基因序列进行分析(GenBank登录号:EF112445),采用Primer Premier 5.0设计1对引物,引物序列为N-EcoRⅠ-pCold Ⅰ-F:CGGAATTCATGCCAAATAACAACGGC;N-XbaⅠ-pCold Ⅰ-R:GCTCTAGACTATGCTGAG GGTGATGCTG,下划线处分别为EcoRⅠ、XbaⅠ酶切位点,预期扩增片段长度为372 bp。引物由上海英骏生物技术有限公司合成。
1.2.2病毒RNA的提取与RT-PCR扩增取成功转染E11105毒株的Marc145细胞,采用RNA提取试剂盒操作方法提取总RNA,并反转录生成cDNA。反转录体系:RNA溶液8 μL,Oligo(dT)152 μL,70 ℃的水浴作用5 min后,取出置于冰上,再加入 5×M-MLV buffer 6 μL,RNasin 1 μL,dNTP 2 μL,M-MLV反转录酶1 μL,补H2O至20 μL。反转录条件:42 ℃ 1 h,75 ℃ 15 min。用反转录生成的cDNA为模板进行PCR扩增,PCR反应体系为: 5×GC buffer 4 μL,dNTP Mix 2.5 μL,上、下游引物各0.5 μL,PrimerStar 0.5 μL,cDNA 2 μL,补H2O至20μL。PCR反应条件为:98 ℃ 3 min;98 ℃ 10 s;50 ℃ 5 s;72 ℃ 1 min,共进行35个循环;最后72 ℃ 10 min。反应结束后经10 g/L琼脂糖凝胶电泳检测PCR产物。
1.2.3原核表达载体pCold Ⅰ-N的构建及双酶切鉴定 PCR产物经10 g/L琼脂糖凝胶电泳鉴定后,参照胶回收纯化试剂盒操作方法纯化回收PCR产物。将回收的PCR产物与原核表达载体pCold Ⅰ分别用EcoRⅠ和XbaⅠ双酶切,用Solution Ⅰ连接酶16℃连接过夜,转化至大肠埃希菌DH5α感受态细胞中,并涂布于含有氨苄青霉素的LB固体培养基上,置于37℃细菌培养箱培养16 h~24 h,挑单个菌落于LB液体培养基中过夜培养,取菌液按照1.2.2进行PCR扩增及电泳检测。菌液PCR鉴定出阳性重组质粒后,用质粒提取试剂盒操作方法提取质粒,并用EcoRⅠ、XbaⅠ进行双酶切,鉴定目的片段与质粒是否成功连接,将初步鉴定为阳性的重组质粒送广州立菲生物公司测序。
1.2.4N基因序列比对分析及生物信息学分析使用DNA Star7.1生物学软件,根据获得的N基因序列片段推导其氨基酸序列,对GenBank已发表的15株PRRSV N基因序列进行比对和分析,参考毒株信息[9-10]见表1,并运用MegAlign软件绘制系统进化树;采用SOPMA在线服务器(https://npsa-prabi.ibcp.fr/cgi-bin/secpred-sopma.pl)预测蛋白质二级结构;采用TMHMM Server V.2.0在线服务器(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜结构区;采用DNA Star7.1软件中Protein程序预测B细胞表位参数。
1.2.5重组N蛋白的诱导表达与SDS-PAGE分析 将重组菌按1∶100的比例接种于LB液体培养基中,37℃振荡培养至OD 600 nm≈0.6,加入IPTG(终浓度为1.0 mmol/L),于18 ℃振荡培养12 h,取诱导表达的菌液,离心取沉淀,用PBS悬浮于冰上超声破碎处理,超声后的菌体经离心后,分别收集上清和菌体,菌体重新加入PBS悬浮,加入5×SDS上样缓冲液,煮沸5 min~10 min。其他对照组也用同样方法处理,用150 mL/L的SDS-PAGE分析重组蛋白的表达结果。
1.2.6Western blot分析 蛋白样品经150 mL/L SDS-PAGE电泳后,电转印至PVDF膜上,用50 g/L脱脂乳PBST(含0.5 mL/L Tween-20)37 ℃封闭1 h,加入His-tag抗体(1∶1 000稀释),4 ℃摇床孵育过夜,TBST洗5次,每次8 min;加入辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(1∶1 000稀释),37 ℃摇床孵育1 h;TBST洗膜5次,每次5 min;二氨基联苯胺(DAB)-H2O2避光显色30 min,去离子水终止反应,分析结果。
2 结果
2.1N基因的扩增
利用提取的总RNA逆转录合成cDNA,然后进行PCR扩增,经10 g/L琼脂糖凝胶电泳检测,扩增出约372 bp的特异性条带(图1),与预期条带一致。

M.DNA 标准DL 2 000;1,2.N基因的PCR产物
M.DNA Marker DL 2 000;1,2.PCR products of N gene
图1N基因的RT-PCR结果
Fig.1RT-PCR results of N gene
2.2重组表达载体pCold Ⅰ-N酶切鉴定
提取经菌液PCR鉴定阳性菌液的质粒,用限制性内切酶EcoRⅠ和XbaⅠ对重组质粒进行双酶切,凝胶电泳检测。结果显示酶切产物呈现两个条带(图2),一条为目的条带,大小为372 bp;另一条为质粒条带,大小为4 407 bp。结果表明目的片段已成功插入质粒。
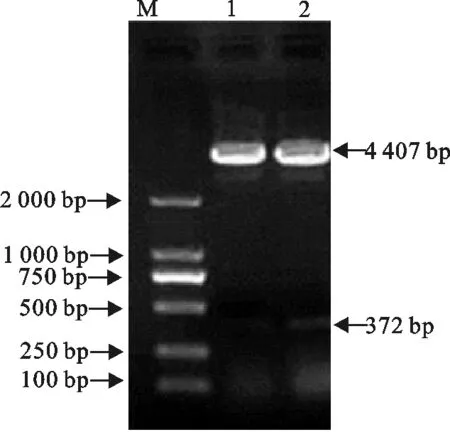
M.DNA 标准DL 2 000;1,2.重组质粒pCold Ⅰ-N酶切产物
M.DNA Marker DL 2 000;1,2.Products of recombinant plasmid pCold Ⅰ-N by enzyme digestion
图2重组质粒pCold Ⅰ-N的酶切鉴定结果
Fig.2Enzyme digestion results of recombinant plasmid pCold Ⅰ-N
2.3N基因序列测定结果与分析
将阳性重组质粒送广州立菲生物公司测序。获得E11105毒株N基因的核苷酸系列,长度为372 bp,编码123个氨基酸(图3)。

图3 E11105株N基因测序结果
2.3.1N基因同源性比对分析将本次重组得到的N基因序列和推导的氨基酸序列与GenBank中公布的PRRSV N基因和推导的氨基酸序列进行比对分析。结果显示,分离株E11105 N基因与北美洲型代表株VR-2332(PRU87392)核苷酸序列同源性为93.3%,氨基酸序列同源性为94.4%;而与欧洲型代表株Lelystad virus(M96262)核苷酸序列同源性为34.7%,氨基酸序列同源性仅为15.3%;与中国2006年暴发的高致病性PRRSV代表株JXA1(EF112445)核苷酸序列同源性高达99.2%,氨基酸序列同源性为94.4%;与中国代表株CH-1a(AY032626)核苷酸序列同源性为95.4%,氨基酸序列同源性高达99.2%(图4和图5)。
2.3.2N基因系统进化树分析将分离株E11105与GenBank公布的不同毒株N基因的核苷酸序列采用MegAlign软件绘制系统进化树。由图6可知,以欧洲型代表株Lelystad virus(M96262)与美洲型代表株VR-2332(PRU87392)在进化树上分为两个大支,分离株E11105与美洲型代表株VR-2332(PRU87392)属于同一分支,与中国暴发的高致病性JXA1处于同一小分支,说明本研究毒株E11105与中国的高致病性PRRSV亲缘关系接近。
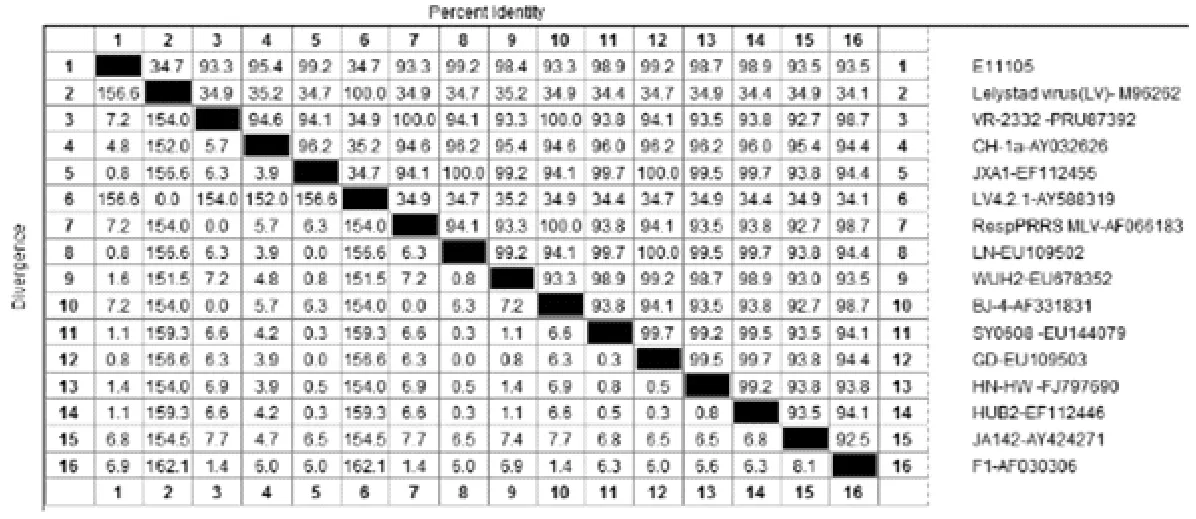
图4 E11105株N基因核苷酸序列同源性比较

图5 E11105株N基因编码的氨基酸序列同源性比较

图6 E11105株N基因核苷酸序列系统进化树
2.4N基因编码蛋白的生物信息学分析
2.4.1N基因编码蛋白的跨膜结构预测采用TMHMM Server V.2.0在线服务器对N基因编码蛋白的跨膜结构域进行预测和分析(图7)。结果显示,E11105株N基因编码蛋白不具有跨膜区。
2.4.2N基因编码蛋白二级结构预测 在线服务器预测N基因编码蛋白的二级结构(图8)。由图可知,E11105株N基因编码蛋白的二级结构主要包括α-螺旋、β-转角、β-折叠和无规则卷曲,所占比例分别为20.33%、4.07%、12.19%和63.41%(表2)。整个结构中无规则卷曲与α-螺旋区域出现较多,而此序列中β-转角和β-折叠所占比例相对较少。
2.4.3N基因编码蛋白B细胞抗原表位预测 采用DNA Star的Protein软件,综合分析预测N基因编码蛋白B细胞表位各参数。Kyte-Doolittle法分析亲水性,Karplus-Schulz法分析柔韧性,Jameson-Wolf法分析抗原指数,Emini法分析氨基酸表面可及性,以高于阈值的氨基酸残基作为候选参考区域。1-75位氨基酸区域有良好的亲水性,抗原性和表面可及性都较高,氨基酸柔性区域分布不均匀,但相对集中。75-123位氨基酸区域亲水性和表面可及性参数较小,58-123位氨基酸区域氨基酸柔性区域分布较均匀,92-102位氨基酸区域抗原性较高(图9),表明N基因编码蛋白N端肽段各参数优势相对明显。根据对E11105株N基因编码蛋白的B细胞抗原表位的亲水性、抗原指数、柔韧性、氨基酸的表面可及性综合分析,各肽段的优势抗原表位(表3),预测N蛋白可能存在5个B细胞优势抗原表位,综合各参数预测N蛋白可能存在5个优势表位(aa),分别为5-15、17-19、32-53、59-62、68-71位氨基酸。
2.5重组表达蛋白的SDS-PAGE电泳结果
取超声的诱导菌液上清、未诱导的菌液、超声的诱导沉淀菌体、未超声诱导的菌液,用150 mL/L SDS-PAGE电泳成像(图10),对结果进行分析。由图10可知,在蛋白分子质量15 ku~20 ku之间出现一条大小约为16.7 ku的特异性蛋白条带,与预期的蛋白大小一致且主要存在于菌体沉淀中,对照样品则未见明显表达。
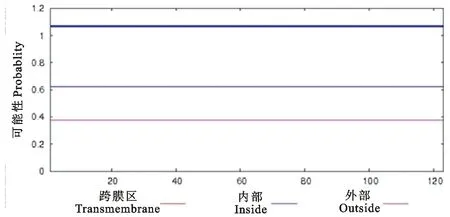
图7 N基因编码蛋白跨膜结构域预测
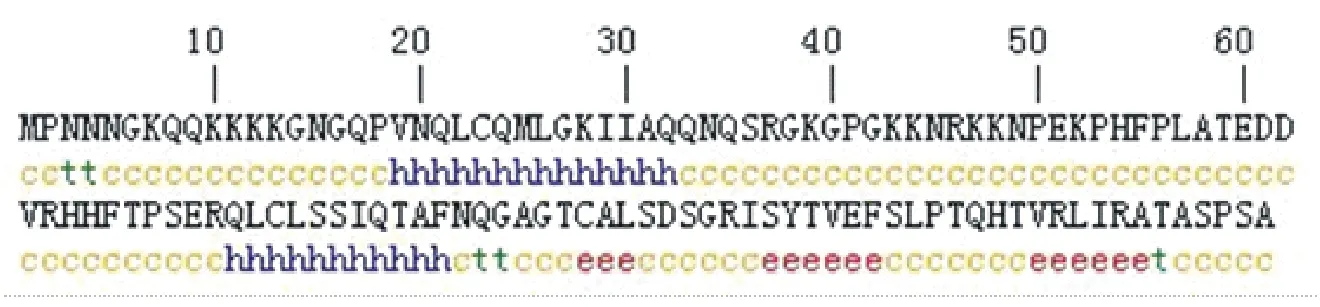
图8 N基因编码蛋白二级结构预测

二级结构名Nameofsecondarystructureα-螺旋/%Alphahelixβ-转角/%Betaturnβ-折叠/%Betaextendedstrand无规则卷曲/%IrregularcoilPRRSV-E11105-N20.33(25/123)4.07(5/123)12.1(15/123)63.41(78/123)

图9 N基因编码蛋白B细胞表位参数预测

预测参数Predictionparameters预测结果Predictionresults亲水性Hydrophlicity1-21,30-74,81-85,95-99,105-107,109-113柔韧性Flexibility5-20,32-53,59-62,68-73,77-81,83-88,93-98,107-109,119-121抗原指数Antigenicindex1-19,31-54,58-74,84-88,92-100,106-108,113-116,118-123表面可及性Surfaceprobabilityplots1-19,32-54,58-63,66-71,107-110,122-123合计Total5-15,17-19,32-53,59-62,68-71

M.蛋白分子质量标准; 1~3.超声的诱导菌液上清;4.未诱导的菌液;5~7.超声的诱导沉淀菌体;8.未超声的诱导菌液
M.Protein molecular weight Marker;1-3.The supernatants of ultrasound bacteria induced by IPTG;4.Bacteria without induction by IPTG;5-7.The precipitates of ultrasound bacteria induced by IPTG;8.Induced bacteria without ultrasound
图10重组N蛋白的SDS-PAGE鉴定
Fig.10SDS-PAGE identification of recombinant N protein
2.6Western blot检测结果
重组蛋白经SDS-PAGE电泳后湿转至PVDF转移膜上,进行Western blot分析(图11)。由图11可见,PVDF膜出现了与目的蛋白理论值大小一致的条带,约16.7 ku。
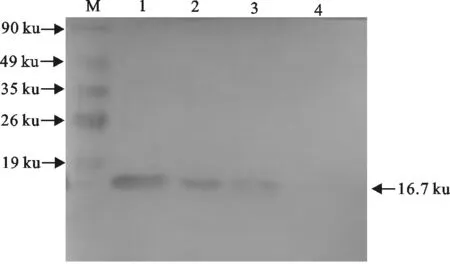
M.蛋白分子质量标准;1~3.重组蛋白pCold Ⅰ-N;4.空载体pCold Ⅰ
M.Protein molecular weight Marker;1-3.Recombinant protein pCold Ⅰ-N;4.Empty vector pCold Ⅰ
图11重组N蛋白的Western blot分析
Fig.11Western blot analysis of recombinant N protein
3 讨论
尽管全世界有众多关于PRRSV的研究,但迄今为止PRRS的防控仍然不理想。PRRSV含有多个基因,编码核衣壳蛋白的ORF7基因非常保守,可作为PCR检测的靶基因[11]。ORF7基因编码的核衣壳蛋白N为高保守性的非糖基化核衣壳蛋白,该蛋白在病毒感染的细胞中表达丰富,是病毒粒子中含量最高的蛋白,约占病毒蛋白总量的20%~40%[12]。N蛋白是免疫原性最强的蛋白,能刺激机体产生强烈的免疫应答[13-14],猪感染PRRSV后,7 d即可检测抗N蛋白抗体,并且针对N蛋白的抗体在体内存活时间较长,以N蛋白作为检测抗原具有较高的敏感性和特异性,是临床诊断与检测方法中的首选[15]。
本研究把从临床分离的毒株E11105 N基因克隆连接到pCold Ⅰ原核表达载体上,并对N基因序列进行了分析。通过序列比对发现,分离株E11105与VR-2332、JXA1、CH-1a的N基因核苷酸序列、推导氨基酸序列同源性极高,系统进化树显示E11105株N基因与VR-2332、JXA1毒株的亲缘关系较近,属于同一遗传进化分支,可以推测E11105分离株接近与美洲型PRRSV;分离株E11105 N基因所编码蛋白不存在跨膜区;二级结构主要以α-螺旋和无规则卷曲为主,分别占20.33%和63.41%;预测该蛋白可能存在5个较为明显的B细胞优势抗原表位,这与张松林等[16]报道相似,但氨基酸区域有一定的差异,这可能是由于不同毒株变异引起的,有待进一步研究。
本研究利用pCold Ⅰ-N重组质粒高效表达出的重组蛋白带有组氨酸标签,可以利用亲和层析技术纯化蛋白,为今后制备标准化的抗原打下基础,也为进一步研究E11105毒株N蛋白的结构、功能以及PRRSV N蛋白在病毒致病中的作用具有重要意义。
[1]马苏,李玉峰,段舒怡,等.猪繁殖与呼吸综合征病毒N蛋白单克隆抗体的制备及生物学特性分析[J].畜牧与兽医,2007,39(4):1-3.
[2]Collins J E,Benfield D A,Christianson W T,et al.Isolation of swine infertility and respiratory syndrome virus (isolate ATCC VR-2322) in North America and experiment reproduction of the disease in gnotobiotic pigs[J].J Vet Diagn Invest,1992,4(2):117-126.
[3]Salguero F J,Frossard J P,Rebel J M J,et al.Host-pathogen interactions during porcine reproductive and respiratory syndrome virus 1 infection of piglets[J].Virus Res,2015,202:135-143.
[4]Murtaugh M P,Elam M R,Kakach L T.Comparison of the structural protein coding sequences of the VR-2332 and Lelystad virus strains of the PRRS virus[J].Arch Virol,1995,140:1451-1460.
[5]李成,李六金,谷守林,等.猪繁殖与呼吸系统综合征病毒形态学特征[J].畜牧兽医学报,2001,32(6):563-567.
[6]高志强,郭鑫,杨汉春,等.猪繁殖与呼吸综合征病毒缺失变异株的基因组特征[J].畜牧兽医学报,2005,36(6):575-584.
[7]Shen S,Wang K,Liu W, et al. Determination of the complete nucleotides sequence of a vaccine strain of PRRSV and identification of the NSP2 gene with a unique msertion[J].Arch Virol, 2000(145): 871-883.
[8]Loemba H D,Mounir S,Mardasi H,et al.Kinetics of humoral immune response to the major structural proteins of the porcine reproductive and respiretory syndrome virus[J].Arch Virol,1996,141:751-761.
[9]王文成,边少国,舒秀伟,等.猪繁殖与呼吸综合征病毒国内分离经典毒株与变异株的全基因组序列分析[J].畜牧与兽医,2008,40(7):34-37.
[10]刘永宏,赵丽,刘俊峰,等.猪繁殖与呼吸综合征病毒BJSD株和BJPG株序列分析[J].中国畜牧兽医,2011,38(12):111-118.
[11]单晶晶,陈天慧,于红欣,等.猪繁殖与呼吸综合征病毒荧光定量PCR检测方法的建立[J].北京农学院学报,2016,31(1):60-63.
[12]Rowland R R,Steffen M,Ackerman T,et al.The evolution of porcine reproductive and respiratory syndrome virus: quasispecies and emergence of a virus subpopulation during infection of pigs with VR-2332[J].Virology,1999,259(2):262-266.
[13]廖立珊,曾少灵,孙洁,等.高致病性猪繁殖与呼吸综合征病毒N基因真核表达载体的构建及表达[J].动物医学进展,2014,35(9):25-28.
[14]刘建奎,魏春华,戴爱玲,等.福建地区猪繁殖与呼吸综合征ORF7基因遗传变异分析[J].中国兽医杂志,2015(10):17-19.
[15]王凤雪,刘莹,杨勇,等.高致病性PRRSVJL-04/12株核衣壳蛋白的表达与抗原性分析[J].动物医学进展,2015,36(10):60-64.
[16]张松林,沈志强,刘磊,等.猪繁殖与呼吸综合征病毒结构和非结构蛋白生物学功能研究进展[J].畜牧兽医学报,2012,43(11):1683-1696.
�毒株信息 Table 1The information of
序号№毒株名称StrainnameGenBank登录号GenBankaccessionnumber分离地区Isolatedregion1Lelystadvirus(LV)M96262荷兰Netherlands2VR2332PRU87392美国American3CH-1aAY032626国China4JXA1EF112445中国China5LV4.2.1AY588319欧洲Europe6RespPRRSMLVAF066183美国American7LNEU109502中国China8WUH2EU678352中国China9BJ-4AF331831中国China10SY0608EU144079中国China11GDEU109503中国China12HN-HWFJ797690中国China13HUB2EF112446中国China14JA142AY424271中国China15F1AF030306中国台湾TaiwanChina
Sequence Analysis and Prokaryotic Expression of N Gene of PRRSV E11105 Strain
ZHANG Sheng-bo,CHEN Shao-pin,WEN Gui-lan,WU Chang-hua,LI Tian-zhen,LI Chen,WANG Kai-gong,WEN Ming,GONG Xin-yong
(LaboratoryofPreventiveVeterinaryMedicine,CollegeofAnimalScience,GuizhouUniversity,Guiyang,Guizhou,550025,China)
In order to study the N protein structure,function of PRRSV and its role in the viral pathogenesis,we took the isolated PRRSV strain E11105 as the research object and designed a pair of primers by Primer Premier 5.0.Then we amplified N gene by RT-PCR and analyzed N gene sequences by molecular biology related software.We constructed a recombinant vector pCold Ⅰ-N.The recombinant plasmid pCold Ⅰ-N was confirmed by PCR,double enzyme digestion and sequencing,and was transfected intoEscherichiacoliBL21(DE3) competent cells.N protein induced by IPTG was detected and analyzed by SDS-PAGE and Western blot.The results showed that the N gene nucleotide sequence similarities of the isolated E11105 with North American type strain VR-2332,the European type strain Lelystad virus (LV),highly pathogenic PRRSV strain JXA1 in 2006 in China and Chinese strain CH-1a are respectively 93.3%,34.7%,99.2% and 95.4%,and the amino acid sequence similarities are respectively 94.4%,15.3%,94.4%,99.2%.Phylogenetic tree showed that the N gene of E11105 strain and the American type VR-2332,the highly pathogenic JXA1 strain are closely related.There were no transmembrane domains for N gene encoding protein of E11105.The secondary structure is mainly dominated by alpha helix and irregular coil,which account for 20.33% and 63.41%,and the N protein was predicted that might have five B cell dominant epitopes.SDS-PAGE showed that recombinant N protein has a 16.7 ku molecular weight and mainly distributes in the cell precipitate.Western blot results showed that the recombinan N protein has an immune response with His antibody,and the band is about 16.7 ku,which is coincident with the result that analyzed by SDS-PAGE.
PRRSV; N gene amplification; sequence analysis; prokaryotic expression
2016-03-17
国家自然科学基金项目(31460668);贵州省科学技术基金项目(黔科合J字[2015]2046号);贵州大学大学生“SRT”计划项目(贵大SRT(2014)121号);贵州大学“本科教学工程”项目(JKSP2013004)
张升波(1992-),男(苗族),贵州务川人,动物医学专业本科生,主要从事预防兽医学研究。*通讯作者
S852.659.6;Q789
A
1007-5038(2016)10-0041-07
