四种转基因玉米多重PCR检测方法的建立
2016-10-19尹全李忆宋君王东张富丽刘文娟常丽娟雷绍荣刘勇
尹全 李忆 宋君 王东 张富丽 刘文娟 常丽娟 雷绍荣 刘勇


摘要:为建立能同时检测4种转化体的多重PCR方法,选择进口转基因玉米最为常见的4种转化体Bt11、Bt176、MON810和MON863,利用国家标准中现行有效的转化体检测引物作为多重PCR检测体系引物,对多重PCR退火温度和引物浓度等进行优化。结果表明,多重PCR方法的适宜退火温度为58 ℃,适宜引物终浓度(μmol/L)配比为0.4∶0.4∶0.4∶0.4,通过建立快速、准确、高效的多重PCR为进口转基因玉米检测提供有价值的参考。
关键词:转基因玉米;多重PCR;筛查;检测
中图分类号:S513 文献标识码:A 文章编号:0439-8114(2016)06-1540-05
DOI:10.14088/j.cnki.issn0439-8114.2016.06.045
转基因玉米就是利用现代分子生物技术,将种属关系十分遥远且有用的基因导入需要改良的玉米遗传物质中,并使其后代表现出人们所追求的具有稳定遗传性状的玉米[1]。转基因玉米是目前全世界种植最多的4种转基因作物之一[2]。2011年全球转基因玉米种植面积仅次于转基因大豆,达到5 100万hm2,占转基因作物总面积的32%[3]。目前,中国批准Bt11、Bt176、MON810、MON863等15种转基因玉米进口用作加工原料[4]。本研究选择最为常见的转基因玉米Bt11、Bt176、MON810和MON863 4种转化体。转基因玉米Bt11是由先正达公司研发的,为兼具抗虫害及耐除草剂两种特性的品系,其转入的抗虫基因为Bt系列毒蛋白基因的cry1Ab抗虫基因,转入的耐草丁膦除草剂基因是草丁膦乙酰转移酶基因[5]。转基因玉米Bt176是由先正达公司研发的,为具抗虫害特性的品系,其转入的抗虫基因为Bt系列毒蛋白基因的cry1Ab抗虫基因[6]。转基因玉米MON810是由孟山都公司研发的,为具抗虫害特性的品系,其转入的抗虫基因为Bt系列毒蛋白基因的cry1Ab抗虫基因,可抗欧洲玉米螟[7]。转基因玉米MON863是由孟山都公司研发的,为具抗虫害特性的品系,其转入的抗虫基因为Bt系列毒蛋白基因的cry3Bb1抗虫基因。
随着转基因技术不断发展,转基因商业化产品不断增多,其安全性问题也越来越受到社会各界甚至普通大众的广泛关注,包括中国在内的越来越多国家制定并实施了相关转基因产品标识制度[8],而转基因标识制度如何科学执行就必须依托快速、有效的转基因产品检测技术。目前,转基因产品检测技术主要有蛋白质和核酸两大类,PCR技术是核酸检测技术的一种,其具有敏感、快速、简便的特点,主要用于检测转基因作物及产品中的外源基因[9,10],转化体特异也能利用该技术检测。然而在检测作物及其产品时,往往需要检测多个外源基因来确认其是否为转基因产品及含哪些转基因成分或者需要检测包含多种转化体的样品,普通PCR(Polymerase Chain Reaction,PCR)技术分别检测外源基因或转化体时,存在操作繁琐、时间和试剂耗费大等缺点[11]。因此,为了解决普通PCR技术在检测转基因产品时存在的缺点,多重PCR(Multiplex Polymerase Chain Reaction,MPCR)技术在转基因产品检测中得到了应用[12-14]。本试验旨在提高转化体检测效率、降低检测成本,根据单个转化体检测方法,建立转基因玉米Bt11、Bt176、MON810和MON863 4种转化体的多重PCR检测技术体系。
1 材料与方法
1.1 材料
1.1.1 试验材料 转基因玉米Bt11、Bt176、MON810和MON863来源于IRRM[Institute for Reference Materials and Measurements]。
1.1.2 主要试剂 植物基因组提取试剂盒、标准分子量(M)购于天根生化科技(北京)有限公司;Master Mix购于日本东洋纺(TOYOBO)株式会社;引物由成都擎科梓熙生物技术有限公司合成。
1.2 引物序列设计
转基因玉米Bt11、Bt176、MON810和MON863转化体特异引物序列参照国家相关标准(表1),将各检测基因上、下游引物浓度稀释为10 μmol/L。
1.3 样品DNA提取
样品DNA提取按照天根生化科技(北京)有限公司的植物基因组DNA提取试剂盒说明书进行,测定样品DNA浓度。
1.4 多重PCR方法的建立
1.4.1 单个转化体特异性验证 反应体系及扩增程序依据相关标准配制反应,采用Qiagen毛细管电泳仪对反应产物进行结果分析。
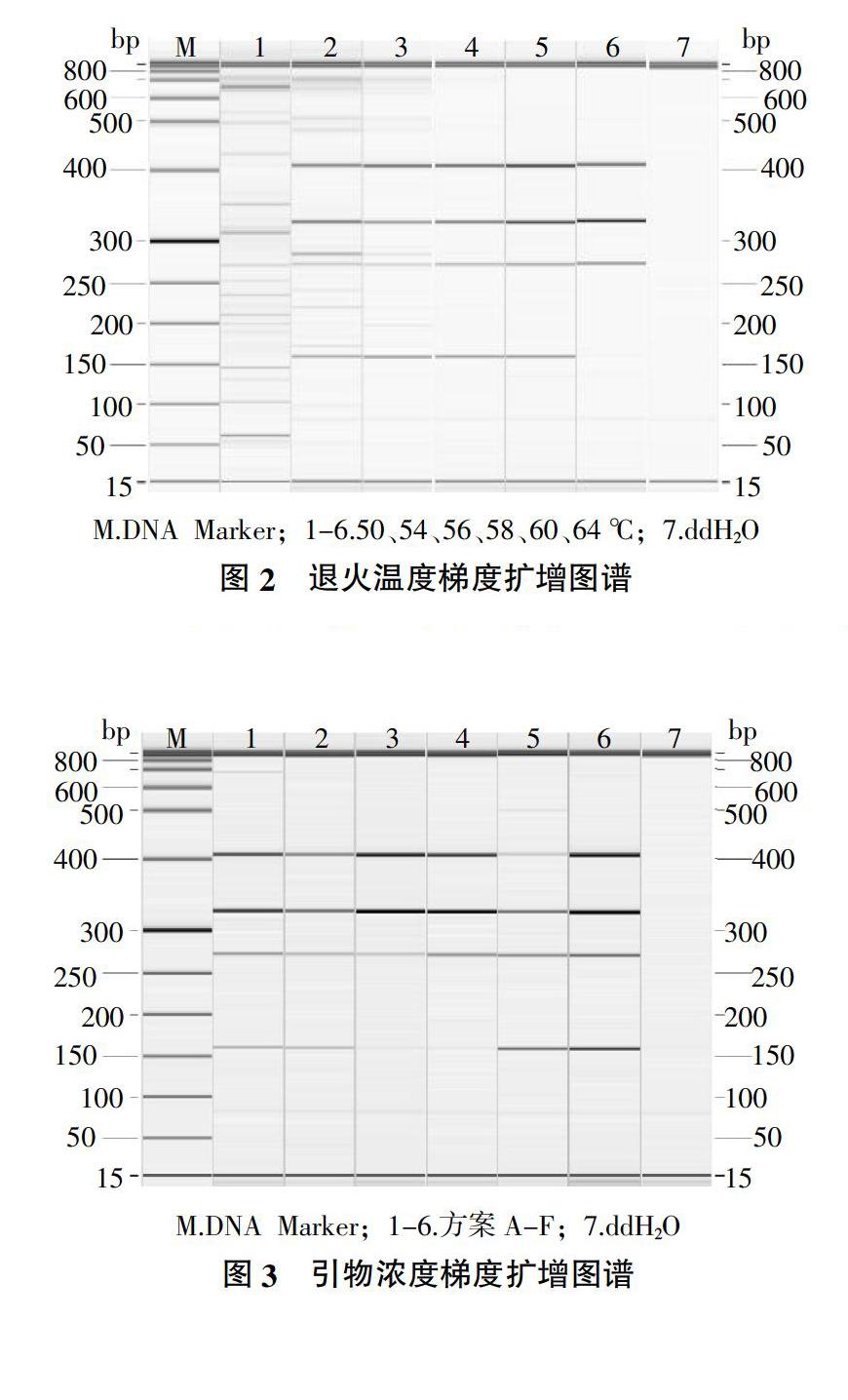
1.4.2 多重PCR条件优化 利用以下体系和程序对多重PCR退火温度进行优化。反应体系为:2×Master Mix 12.5 μL,4对转化体特异引物上、下游引物终浓度各0.2 μmol/L,4个转化体样品DNA模板各1 mg/L,加ddH2O至25 μL。PCR扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,退火温度设置梯度50、54、56、58、60、64 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min。采用Qiagen毛细管电泳仪对反应产物进行结果分析,按照条带特异、二聚体少、扩增效率一致等要求选择适宜的引物退火温度。
利用以上体系和程序对多重PCR引物浓度进行优化。PCR反应体系:2×Master Mix 12.5 μL,4对引物终浓度按照表2设置引物浓度梯度,4个转化体样品DNA模板各1 mg/L,加ddH2O至25 μL。PCR扩增程序选择退火温度优化后确定的程序。采用Qiagen毛细管电泳仪对反应产物进行结果分析,按照条带特异、二聚体少、擴增效率一致等要求选择适宜的引物浓度配比。
1.5 多重PCR方法灵敏度检测
将4个转化体样品DNA模板等比混合,将混合后的DNA模板进行梯度稀释,使得每个反应体系中基因组DNA的拷贝数分别为1 000、200、100、50、20、10个,利用试验优化后的多重PCR方法进行灵敏度试验。
1.6 已知样品验证
利用试验优化后的MPCR检测体系,对已知样品进行验证。
2 结果与分析
2.1 样品DNA提取
样品总DNA提取纯化采用植物基因组提取试剂盒,通过NanoDrop 1000(Thermo scientific)超微量分光光度计测定浓度和质量。结果表明,所有样品浓度都大于25 ng/μL,且OD260 nm/OD280 nm范围为1.8~2.0,OD260 nm/OD230 nm大于2.0,提取的样品DNA可满足PCR扩增对模板DNA的要求[19],将样品DNA浓度稀释至25 ng/μL待测。
2.2 单个转化体特异性验证
本试验选择的单个转化体PCR检测方法可以将目的基因片段成功扩增,而其他不含该转化体的样品中没有相应扩增,结果(图1)表明,4个转化体引物目的条带特异,没有非特异性条带出现,在国家标准的基础上进一步说明本试验选择的4个转化体引物可用于多重PCR检测体系研究。
2.3 多重PCR条件的优化
结果(图2)表明,退火温度太低容易产生非特异性条带和引物二聚体,而退火温度太高又不能使全部目的条带得到理想扩增。当退火温度为50 ℃时,所有目的条带都未得到扩增,而且还出现了许多非特异性条带,退火温度50 ℃是不适合的。当退火温度为54和56 ℃时,虽然所有目的条带都得到扩增,但也出现了许多非特异性条带,退火温度54和56 ℃也是不适合的。而退火温度为64 ℃时,Bt11转化体的目的条带未得到有效扩增,退火温度64 ℃也不适合。当退火温度为58和60 ℃时,目的条带得到扩增,且没有出现非特异条带,考虑到所有目的条带扩增效率和单基因扩增时的退火温度,因此,选择多重PCR反应的适宜退火温度为58 ℃。
通过引物浓度梯度试验,结果(图3)表明,各引物终浓度按照方案F配比时,各转化体目的条带的扩增效率高并且一致,没有非特异性条带出现;而其他几种引物浓度方案结果均不理想,目的基因存在无扩增、扩增效率不一致以及出现非特异条带现象等。因此,最终确定适宜的引物终浓度(μmol/L)配比为0.4∶0.4∶0.4∶0.4。
2.4 多重PCR灵敏度结果
结果(图4)表明,在模板浓度不低于100个拷贝时,4个转化体目的条带均可得到有效扩增。而当模板浓度低于100个拷贝时,4个转化体目的条带几乎没有扩增。本试验所建立的多重PCR检测体系灵敏度可达100个拷贝。
2.5 已知样品验证
采用优化后的多重PCR体系对已知样品进行检测,结果(图5)表明,所有已知样品的扩增条带与其含有的转化体一致,该结果进一步验证了建立的多重PCR检测方法的可靠性。
3 小结与讨论
多重PCR最早由Chamberlain等[12]于1988年提出,目前已被廣泛应用于医学及生物等领域,包括基因敲除分析、多态性分析、定量分析、RNA检测及微生物耐药检测等[20]。在实际应用中,不同引物序列对多重PCR结果存在很多影响因素(如引物浓度、退火温度等)。在关键影响因素引物浓度选择过程中,本试验采用不同引物浓度梯度和引物配比,在充分考虑PCR反应过程中易产生的引物二聚体、非特异性条带等特殊情况下,选择目的条带特异、引物二聚体少,各转化体引物扩增效率相对一致的引物浓度配比。退火温度是多重PCR反应中一个关键因素。通常情况下可以依据引物的解链温度直接选择退火温度,但有时结果与预期并不一致。在多重PCR反应条件优化过程中,最简单的方法就是设置54 ℃为初始退火温度,如果多重PCR扩增产生非特异性条带,需适当提高引物退火温度,反之则降低引物退火温度[21]。本试验从6个退火温度中,根据4个转化体引物特异性条带扩增效率、非特异性条带以及引物二聚体的产生等因素确定了58 ℃作为转化体多重PCR检测体系退火温度。
为了提高检测效率,本试验将分辨率更高、电泳条带更清晰的毛细管电泳引入到多重PCR检测体系中,也是本研究的最大特点。目前毛细管电泳技术已应用于无机及有机化合物、蛋白质、氨基酸、肽的分离分析,核酸的分离分析等方面[22]。虽然目的条带间碱基差异大也可以采用普通琼脂糖凝胶电泳方法进行分析判断,但毛细管电泳能将扩增目的条带分离得更明显,结果更加清晰;如果需要检测的目的基因间的碱基差异大小不能采用普通琼脂糖凝胶电泳方式进行准确分析,特别是在只有几个碱基差异时,毛细管电泳的优势则更明显。
本试验建立的转化体多重PCR检测方法,可实现在1个反应体系中同时检测4种转化体,有效简化了操作步骤、缩短了检测时间、提高了检测效率,为转基因玉米检测提供了速度快、效率高、成本低以及污染小的方法。
参考文献:
[1] 李余良,胡建广.转基因玉米研究进展[J].中国农学通报,2006,22(2):71-75.
[2] JAMES C.2014年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志,2015,35(1):1-14.
[3] JAMES C.2011年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志,2012,32(1):1-14.
[4] 农业部农业转基因生物安全管理办公室.2004-2011年进口用作加工原料的农业转基因生物审批情况[EB/OL].http://www.moa.gov.cn/ztzl/zjyqwgz/spxx/201202/P020130618408715248212.pdf.
[5] 覃 文,曹际娟,朱水芳.加工产品中转基因玉米Bt11成分实时荧光PCR定量(性)检测[J].生物技术通报,2003,19(6):46-50.
[6] 李葱葱,王青山,李飞武,等.用实时荧光PCR方法定量检测Bt176转基因玉米[J].吉林农业科学,2007,32(5):24-27.
[7] 曹际娟,曹远银.PCR对转基因玉米MON810鉴定检测[J].玉米科学,2003,11(1):19-21.
[8] 金芜军,贾士荣,彭于发.不同国家和地区转基因产品标识管理政策的比较[J].农业生物技术学报,2004,12(1):1-7.
[9] 尹 全,宋 君,刘 勇.生物技术作物食品检测技术研究进展[J].江西农业学报,2010,22(5):135-137.
[10] 张富丽,雷绍荣,刘 勇.转基因作物及加工品检测技术概述[J].生物技术通讯,2009,20(5):733-737.
[11] 郑景生,吕 蓓.PCR技术及实用方法[J].分子植物育种,2003, 1(3):381-394.
[12] CHAMBERLAIN J S,GIBBS R A,RANIER J E,et al. Detection screening of the duchenne muscular dystrophy locus via multiplex DNA implication[J]. Nucleic Acids Res,1988,16:1141-1156.
[13] 自 月,才 华,奕风侠,等.多重PCR结合DHPLC方法检测番茄中转基因成分[J].作物杂志,2011(2):28-31.
[14] GERMINI A,ZANETTI A,SALATI C,et al. Development of a seven target multiplex PCR for the simultaneous detection of transgenic soybean and in feeds and foods[J].Journal of Agricultural and Food Chemistry,2004,52(11):3275-3280.
[15] 中華人民共和国农业部.农业部869号公告-3-2007,转基因植物及其产品成分检测抗虫和耐除草剂玉米Bt11及其衍生品种定性PCR方法[S].
[16] 中华人民共和国农业部.农业部2122号公告-15-2014,转基因植物及其产品成分检测抗虫和耐除草剂玉米Bt176及其衍生品种定性PCR方法[S].
[17] 中华人民共和国农业部.农业部2122号公告-16-2014,转基因植物及其产品成分检测抗虫玉米MON810及其衍生品种定性PCR方法[S].
[18] 中华人民共和国农业部.农业部869号公告-10-2007,转基因植物及其产品成分检测抗虫玉米MON863及其衍生品种定性PCR方法[S].
[19] 李 忆.多重PCR方法同时检测3种转基因作物外源基因[J].现代农业科技,2014,44(22):14-16.
[20] 赵红庆,苑锡铜,黄留玉.多重PCR技术在病原检测中的应用[J].生物技术通讯,2007,8(5):863-866.
[21] HENEGARIU O,HEEREMA N A,DLOUHY S R,et al. Multiplex PCR: Critical parameters and step-by-step protocol[J]. Biotechniques,1997,23(3):504-511.
[22] 陈 义.毛细管电泳技术及应用[M].北京:化学工业出版社,2000.
