猪流行性腹泻病毒湖北株的分离鉴定及其s1基因进化分析
2016-10-19桂锐郭锐田永祥李文浩蔡行段正赢杨克礼刘泽文袁芳艳刘威邢崔昱周丹娜
桂锐 郭锐 田永祥 李文浩 蔡行 段正赢 杨克礼 刘泽文 袁芳艳 刘威 邢崔昱 周丹娜


摘要:猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)是猪的肠道传染病病原,主要引起仔猪呕吐、腹泻和脱水,对一周龄内的哺乳仔猪危害最为严重,死亡率可达50%~100%。利用Vero86细胞从湖北某猪场腹泻仔猪小肠病料中分离到一株病毒,经RT-PCR检测、序列比对后确定其为PEDV,命名为HB201503株。设计PEDV s1基因的全长扩增引物,获得该株病毒的s1基因全长序列并进行了进化分析,结果表明该毒株与近年来在GenBank 登陆的PEDV s1基因核苷酸序列相似性在91.4%~99.2%,与疫苗株CV777相似性较低,仅为91.8%。通过s1基因进化树分析表明HB201503以及近几年国内分离毒株主要集中在第 I 个亚群,且HB201503株与KM406183(2014,四川)和KM609206(2015,江苏)同源性较高。此外,s1蛋白氨基酸序列比对显示,HB201503与近几年分离毒株及疫苗株CV777均在 55-74、157-163位氨基酸出现了连续4个以上氨基酸的缺失或替换,而且HB201503株与CV777及近几年分离毒株相比,还在270-283位氨基酸上出现了1个氨基酸的缺失和10个氨基酸的替换。
关键词:猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV);分离鉴定;s1基因;进化分析
中图分类号:S852.65 文献标识码:A 文章编号:0439-8114(2016)06-1506-05
DOI:10.14088/j.cnki.issn0439-8114.2016.06.036
猪流行性腹泻是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的急性、接触性、高度传染性消化道疾病,主要症状为呕吐、水样腹泻和脱水[1]。各日龄的猪均易感染,其中以哺乳仔猪、断奶仔猪和育肥猪发病率最高,尤其以哺乳仔猪受害最为严重[2]。20世纪90年代后期,中国开始大面积使用传染性胃肠炎和流行性腹泻二联苗进行免疫,取得了很好的效果。然而最近几年,猪场在广泛应用PED灭活疫苗和弱毒疫苗的同时,仔猪流行性腹泻不断发生,甚至呈局部暴发流行,这提示可能PEDV发生了变异[3]。对中国最近几年流行性腹泻病毒进化发育分析表明,近年来大规模暴发流行性腹泻的原因可能是流行性腹泻病毒的s基因发生了变异[4]。PEDV的S蛋白可分为S1(1aa-735aa)区和S2(736aa-1383aa)区,其中S1区包含多个病毒主要中和表位和受体结合域,与病毒抗原性和吸附入侵密切相关[5]。因此对PEDV的分离鉴定及s1基因的进化分析对PEDV的防控具有重要意义。本研究从湖北某暴发仔猪腹泻的猪场分离到一株PEDV并命名为HB201503,并对其s1基因进行了克隆测序。将测序结果与最近几年NCBI登陆的PEDV毒株及疫苗株CV777的s1基因核苷酸序列进行了进化分析,旨在为猪流行性腹泻的防控及免疫机理的研究提供理论依据。
1 材料与方法
1.1 材料
大肠杆菌DH5α感受态细胞购至康为世纪科技生物有限公司;pET-30A(+)载体、PEDV检测引物参照文献[6]合成;Vero 86细胞由湖北省农业科学院畜牧兽医研究所兽医团队保存。
1.2 主要试剂
AxyPrep体液病毒DNA/RNA小量制备试剂盒购自康宁生命科学有限公司,One-step RT-PCR Super Mix购自北京全式金生物科技有限公司,胶回收试剂盒、质粒提取试剂盒均购自康为世纪科技生物有限公司,同源重组酶购自南京唯赞生物科技有限公司,BamH I和Hind Ⅲ快切酶均购自TaKaRa公司,胰蛋白示磷酸盐肉汤(Tryptose Phosphate Broth)购自上海浩然生物技术有限公司,氨苄青霉素(Amp)、链霉素(Kan)、DMEM培养基、胎牛血清(FBS)、胰酶均购自Invitrogen公司。
1.3 试验方法
1.3.1 细胞培养 采用DMEM培养基(100 U/mL氨苄青霉素,100 μg/mL链霉素,5%FBS)对Vero 86细胞进行培养,培养条件为37 ℃,5%CO2。
1.3.2 病毒分离 采集湖北某猪场腹泻仔猪小肠及内容物加入5倍体积的生理盐水后进行组织匀浆并用0.22 μm微孔滤膜过滤后参照文献[7]中的PEDV分离方法进行病毒分离,具体为:将长满单层Vero 86细胞的6孔板利用PBS缓冲液(不含镁离子和钙离子)洗涤两遍后每孔加入500 μL处理好的病毒悬液,37 ℃、5%CO2条件下孵育30 min,每孔中加入2 mL的DMEM(100 U/mL氨苄青霉素,100 μg/mL链霉素,0.3%TPB)及10 μg/mL的胰酶2 mL。當80%以上细胞出现细胞病变时反复冻融收集病毒悬液。将病毒悬液继续按上述方法接种于Vero上,连续传代3次后对出现细胞病变的阳性孔进行PCR检测。
1.3.3 引物设计 根据GenBank 上近几年登陆的PEDV毒株的基因序列,利用DNAman比对序列后在s1基因序列两边的保守区域利用Primer 5.0设计了一对扩增s1基因序列全长的同源重组引物。引物序列为:上游引物F:5′-GCCATGGCTGATATCGGATCCTCTAATCATTTGGTCAACGTA-3′,下游引物 R:5′-CTCGAGTGCGGCAAGCTTCATTACAAACATA
TGTAACG-3';检测引物序列为:上游P1:5′-TTCGGTTCTATTCCCGTTGATG-3′,下游P2:5′-CCCATGAAGCACTTTCTCACTATC-3′。
1.3.4 RNA 提取 对采集的疑似感染PEDV病料加入5倍体积的生理盐水后进行组织匀浆并反复冻融3次,然后取上清按照说明书进行RNA提取。对于传代3次后且出现细胞病变的细胞,利用移液器将其悬浮后反复冻融3次,离心取上清后按照AxyPrep体液病毒DNA/RNA小量制备试剂盒说明书提取RNA。
1.3.5 s1基因扩增 以提取的RNA为模板利用全式金One-step RT-PCR Super Mix对s1基因进行扩增。具体反应体系如下:RNA模板5 μL,上、下游引物各1 μL,2×One-step Reaction Mix 25 μL,One-step Enzyme Mix 1 μL,RNase-free water 17 μL。一步法反应条件如下:45 ℃反转录30 min;94 ℃预变性 5 min;94 ℃变性1 min,60 ℃退火30 s,72 ℃延伸150 s,35个循环;72 ℃延伸10 min。检测引物扩增体系与s1基因全长扩增体系一样;反应条件为退火温度55 ℃,延伸时间60 s,其余条件与s1基因全长扩增条件一致。反应结束后取5 μL PCR产物进行琼脂糖电泳检测,其余产物用于胶回收。
1.3.6 s1基因克隆 依照胶回收试剂盒说明书对扩增s1片段进行回收,参照Clone Express II one step kit 说明书将s1片段连接到pET-30A(+)载体上,然后将重组质粒转化到DH5α并挑取单菌落进行扩大培养并抽提质粒进行酶切鉴定,对阳性的重组质粒进行测序。
1.3.7 s1基因序列分析 将测序结果利用DNAman生物软件进行拼接后,再利用DNAStar软件对HB201503毒株的s1核酸序列与近几年国内外流行的PEDV毒株(表1)和疫苗株CV777的s1核酸序列进行序列分析。利用MEGA6.0对s1核酸序列做系统进化分析。最后根据进化树结果选择代表性毒株对其s1基因氨基酸推导序列进行比对分析。
2 结果与分析
2.1 病毒分离结果
将连续传代3次后出现细胞病变的细胞毒样品收集,提取RNA后,利用PEDV检测引物对样品进行检测,RT-PCR电泳结果(图1)显示样品可扩增到663 bp大小的目标片段,即分离得到一株PEDV,命名为HB201503。
2.2 s1基因克隆
以PEDV阳性细胞毒中提取的RNA为模板,利用设计的s1基因全长引物进行RT-PCR扩增,结果出现2.4 kb左右的目的条带(图2)。将产物回收用同源重组克隆至pET-30A(+)载体上,提取质粒,用BamH I和Hind Ⅲ做双酶切鉴定,电泳结果(图3)显示分别在2.4 kb和5.2 kb左右出现条带。
2.3 s1基因序列分析
将s1基因测序结果拼接后与疫苗毒株CV777及近几年在GenBank上登陸的部分PEDV毒株进行比较分析,发现HB201503与其他毒株s1基因相似性在91.4%~99.2%,其中HB201503与KM406183(2014)相似性最高,为99.2%,与日本毒株AB548624(2010)相似性最低,为91.4%,与经典毒株CV777相似性较低,为91.8%(图4)。
2.4 s1基因进化分析
将HB201503株的s1核苷酸序列与表1中列举的核苷酸序列以MEGA6.0软件中的最大似然法构建系统进化树(图5),结果显示PEDV主要被分为两个亚群。HB201503位于第I个亚群,与KM406183(2014,四川)和KM609206(2015,江苏)亲源关系较近。国内外近几年在NCBI登陆的毒株主要集中在第I个亚群,而疫苗毒株CV777在第II个亚群。
2.5 S1蛋白氨基酸序列分析
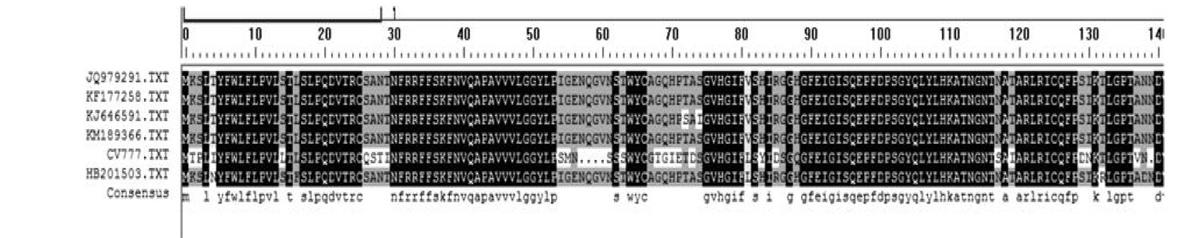
依据上述构建的系统发育树,选取JQ979291、KF177258、KJ646591、KM189366、CV777等各分支的代表序列,推导其S1蛋白的氨基酸序列并进行蛋白质序列比对,结果(图6)显示其变异位置主要发生在55-74、157-163、270-283这三个位置。CV777与HB201503及近几年分离的其他毒株在55-74、157-163位氨基酸出现了连续4个以上氨基酸替换或缺失。HB201503与CV777及近几年分离的其他毒株比较,还在270-283位氨基酸出现了1个氨基酸缺失和10个氨基酸的替换。
3 小结与讨论
国内目前应用于防控PED的疫苗主要是通过将CV777毒株在Vero细胞上传代125代后获得了CV777弱毒株后,在此基础上研发而成的弱毒苗[8]。但近年来国内出现在免疫疫苗后仍然暴发PED的情况,这提示毒株有发生变异的可能。纤突蛋白基因(s)是PEDV结构蛋白中最大的基因,是诱导机体产生免疫性中和抗体的主要免疫蛋白基因[9],其中S蛋白的S1亚基包含了PEDV主要的中和抗原位点[10]。
本研究通过对HB201503、CV777以及近几年在NCBI上登陆的PEDV s1基因序列进行比较分析,发现近几年的分离株包括HB201503与疫苗株的s1核苷酸序列相似性均较低,这提示毒株发生了一定程度上的变异。从进化树分析结果来看,国内近几年分离到的毒株与美国、韩国等国家近年分离到的毒株被类聚到一个亚群,而这些国家近年来都暴发流行过PED,提示毒株的变异可能造成了病毒毒力的改变或抗原性的改变。本研究根据s1基因系统进化树,将HB201503、CV777及其他一些具有代表性的毒株的s1基因推导氨基酸序列做分析比对,发现CV777与HB201503及近几年分离的其他毒株在55-74、157-163位氨基酸出现了连续4个以上氨基酸替换或缺失,而HB201503与CV777及近几年分离的其他毒株比较,还在270-283位氨基酸出现了1个氨基酸的缺失和10个氨基酸的替换。目前相关研究证明S1蛋白氨基酸在248-280区域是一个能和PEDV颗粒具有高亲和力的表位序列[10]。它出现连续氨基酸的替换可能是导致免疫失败的一个原因。与疫苗株CV777相比,近年来在NCBI登陆的其他毒株S1蛋白氨基酸序列在55-74出现连续4个氨基酸缺失、在157-163位点出现连续5个氨基酸替换对PEDV在生物学意义上有何影响,还有待进一步研究。
参考文献:
[1] 高君恺,刘浩飞,杨 倩,等.猪流行性腹泻病毒研究进展[J].南京农业大学学报,2014,37(1):1-5.
[2] 付梦瑾,朱 玲,吴云飞,等.猪流行性腹泻病毒的分离鉴定及增殖规律[J].中国兽医科学,2013,43(11):1133-1139.
[3] 张 志,李 岚,王赛赛,等.猪流行性腹泻新病毒的分离鉴定和致病性研究[J].中国兽医学报,2012,32(10):1422-1428.
[4] GAO Y,KOU Q,GE X,et al. Phylogenetic anslysis of porcine epidemic diarhea virus field strains prevailing recently in China[J]. Arch Virol,2013,158(3):711-715.
[5] 陈弟诗,任玉鹏,张 斌,等.猪流行性腹泻病毒S基因研究进展[J].动物医学进展,2014,35(7):77-81.
[6] 张 坤,何启盖.猪流行性腹泻病毒、传染性胃肠炎病毒和猪A群轮状病毒多重RT-PCR检测方法的建立及临床应用[J].畜牧兽医学报,2010,41(8):1001-1005.
[7] OKA T, SAIF L J, MARTHALER D, et al. Cell culture isolation and sequence anslysis of genetically diverse US procine epidemic diarrhea virus strains including a novel strain with a large deletion in the spike gene[J]. Veterinary Microbiology, 2014,173(3-4):258-269.
[8] 畢 静.猪流行性腹泻病毒AJ1102株的分离、鉴定及其分子进化特征[D].武汉:华中农业大学,2013.
[9] 李一经,张 博,唐丽杰,等.PEDV地方流行毒株S1基因的遗传变异分析及HLJ-2012株免疫原性检测[J].东北农业大学学报,2014,45(12):1-9.
[10] 孙东坡.猪流行性腹泻病毒S蛋白抗原表位鉴定及受体结合域的初步筛选[D].北京:中国农业科学院,2009.
