高产纤维素酶木霉菌株的筛选
2016-10-19冯小飞赵宁陈玉惠
冯小飞 赵宁 陈玉惠

摘要:以前期筛选获得的20株木霉菌株为试验对象,通过刚果红羧甲基纤维素钠(CMC-Na )培养基筛选出11株产纤维素酶能力较好的菌株,对其进行酶活性检测,发现菌株SS003产生的纤维素酶活性最高,并研究了温度和pH对该菌株所产的纤维素粗酶活性的影响。结果表明,SS003产生的纤维素酶最适反应温度为55~60 ℃,最适pH为3.0。
关键词:木霉;纤维素酶;酶活力
中图分类号:Q55 文献标识码:A 文章编号:0439-8114(2016)06-1429-04
DOI:10.14088/j.cnki.issn0439-8114.2016.06.017
纤维素酶是降解纤维素生成葡萄糖的一组酶的总称,具有很高的应用价值。自1906年Serlliere[1]在蜗牛的消化液中发现纤维素酶以来,以纤维素转化成葡萄糖为主要目标对纤维素酶开展了大量的研究[2]。木霉属(Trichoderma)真菌因其合成胞外纤维素酶,对纤维素的水解具有较强的活性而成为当今研究的热点。其中研究最多的木霉真菌有里氏木霉(T. reesei)、绿色木霉(T. viride)、康氏木霉(T.koningii)和拟康氏木霉(T. pseudokoningii)[3]。在酶学性质的研究中,纤维素酶的活性受到多种因素的影响[4]。pH和温度是影响纤维素酶活力的重要因素,也是酶制剂应用中的一个主要参数。研究发现,木霉属真菌产生的纤维素酶具有一定的热稳定性,最适反应温度变化范围在40~60 ℃之间[5];此外,纤维素酶在酸性环境中有较高的酶活,大多数纤维素酶组分最适pH在4~5之间,且酶活性与温度有关[6]。近几年来,人们陆续筛选到了一些耐碱性的细菌和真菌[7],但是大规模工业化的生产对纤维素酶提出了更高的要求。为了选育高酶活的纤维素分解菌株,本研究在前期研究的基础上,以20株木霉供试菌株为试验对象,用CMC-Na培养基筛选出产酶高活性菌株,并研究温度和pH对所产纤维素粗酶的影响,为高产纤维素酶木霉菌株的开发利用奠定基础。
1 材料与方法
1.1 供试材料
1.1.1 菌株来源 20株供试菌株由西南林业大学生命科学学院提供,于-70 ℃条件下保存。菌株名称及编号为康氏木霉(Trichoderma koningii):SWFC8662、SWFC8665、SWFC8676、SWFC8679、SWFC8675;深绿木霉(Trichoderma atroviride):SS003、SWFC 8686、SWFC 8956;哈茨木霉(Trichoderma harzianum):SWFC 8705、SWFC 8719、 SWFC 8696、 SWFC 8713;长枝木霉(Trichoderma longibrachiatum):SWFC 8690、SWFC 8682、SWFC 8661;绿色木霉(Trichoderma viride):LS020;里氏木霉(Trichoderma reesei):SWFC 8709、SWFC 8732、SWFC 8695、SWFC 8727。
1.1.2 主要試剂 葡萄糖、CMC-Na、(NH4)2SO4、NH4NO3、MgSO4·7H2O、KH2PO4、NaCl、刚果红、NaOH、Na2HPO4、柠檬酸、3,5-二硝基水杨酸、酒石酸钾钠、苯酚、无水亚硫酸钠,所有药品均为分析纯试剂,购自国药集团化学试剂有限公司。
1.1.3 培养基 PDA培养基:马铃薯 200 g、葡萄糖 20 g、琼脂 17 g、水1 000 mL,自然pH;初筛培养基[8](刚果红-CMC-Na培养基):CMC-Na 2 g、(NH4)2SO4 2 g、MgSO4·7H2O 0.5 g、KH2PO4 1 g、刚果红 0.2 g、琼脂 20 g、水1 000 mL、自然pH;种子培养基:马铃薯 200 g、葡萄糖 20 g、水1 000 mL、自然pH;发酵产酶培养基[9]:CMC-Na 10 g、(NH4)2SO4 4 g、KH2PO4 2 g、MgSO4·7H2O 0.5 g、水1 000 mL、自然pH。
1.1.4 仪器和设备 BHC-1300ⅡA/B3生物安全柜;HH-S型水浴锅;722型可见分光光度计;MLS-3750型高压灭菌器;P270型摇床;5810R型高速冷冻离心机。
1.2 试验方法
1.2.1 菌株活化 将20株冻藏菌株在38℃的水浴锅中迅速解冻,在无菌条件下将其转移到PDA平板上,每个菌株设2个重复,室温下培养5 d。
1.2.2 菌株种子液体培养 在装有50 mL液体种子培养基的250 mL三角瓶中接入2块直径为6 mm的菌块,每个菌株设2个重复,在25~28 ℃下,120 r/min摇床中培养2 d,作为液体种子。
1.2.3 产纤维素酶菌株的初筛 将供试木霉菌株接种在初筛培养基上,每个平板上3个菌落,使其均匀分布。25~28 ℃培养72 h后,测量菌落直径和透明圈直径大小。根据透明圈和菌落直径比值的大小衡量纤维素酶的产生能力并进行产酶菌株的初步选择。
1.2.4 产纤维素酶菌株复筛
1)产酶培养。根据初筛结果,将初步筛选出来的菌株以4%(V/V)的接种量接种到盛有100 mL发酵产酶培养基的250 mL三角瓶中,每个菌株设3个重复,在25~28 ℃、120 r/min的摇床中培养4 d。发酵液经多层纱布过滤,4 ℃、5 000 r/min条件下离心20 min,上清液即为粗酶液。
2)纤维素酶活力测定。参照巫小琴等[10]的方法并稍加改动。将1.0 mL粗酶溶液在50 ℃水浴锅中预热2 min,加入4 mL已预热至50 ℃的1.2%羧甲基纤维素钠溶液后再置于50 ℃水浴中准确保温15 min。保温结束后立即加入1 mL 2 mol/L氢氧化钠溶液和2 mL DNS显色液,摇匀并置于沸水浴中5 min后取出,流水迅速冷却后定容至50 mL,摇匀后于722型分光光度计490 nm处测定吸光值。每个样品设3个重复,以失活的粗酶液做对照。用葡萄糖做标准曲线,以每1 mL酶提取液15 min催化CMC-Na水解产生1 mg葡萄糖为1个酶活力单位(U)。
1.2.5 纤维素酶的最适温度及热稳定性测定 取粗酶液各1.0 mL,按“1.2.4”中“2)”的反应系统分别于40、45、50、55、60、65 ℃温度下反应15 min后,测定不同温度下的酶活力。
1.2.6 高产酶菌株纤维素酶的最适pH及酸碱稳定性测定 取粗酶液1.0 mL,加入0.2 mol/L Na2HPO4-柠檬酸缓冲液2 mL,按“1.2.4”中“2)”的反应系统分别于pH为3.0、4.0、5.0、6.0、7.0、8.0的条件下反应15 min后,测定不同pH条件下的酶活力。
2 结果与分析
2.1 产纤维素酶菌株的初筛
供试20株木霉在刚果红培养基上生长3 d后菌落直径、水解圈直径及清晰度见表1。由表1可知,20株供试菌株中仅2株哈茨木霉(SWFC8703、SWFC8719)在纤维素酶筛选培养基上未观察到水解圈产生,表明他们没有产生纤维素酶的能力。而其余18株木霉在纤维素酶筛选培养基上生长时均不同程度地出现了水解圈即具有产生纤维素酶的能力,但各菌株产酶能力不同,所产水解圈的大小和清晰度存在一定差异。其中SWFC 8675、SWFC 8676、SS003、SWFC 8686、SWFC 8696、SWFC 8713、SWFC 8690、SWFC 8661、SWFC 8709、SWFC 8732、LS020这11株木霉产生的水解圈清晰度较好,水解圈直径与菌落直径之比大于1.10,产纤维素酶的能力较强。
2.2 产纤维素酶菌株的复筛
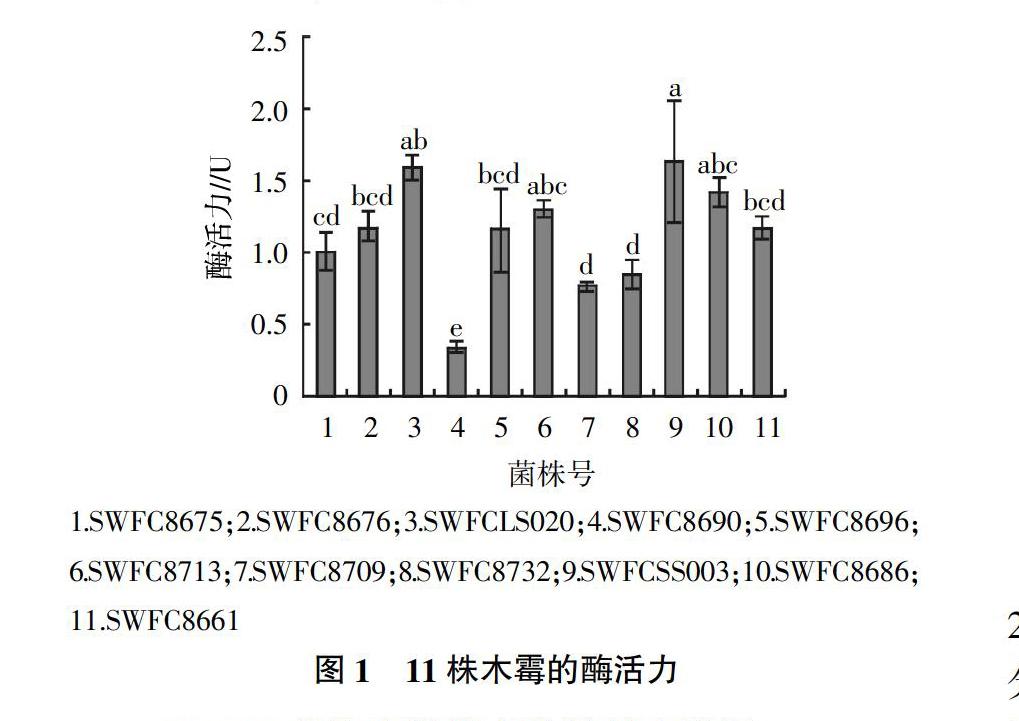
对初筛获得的11株产纤维素酶较强的菌株进行复筛,结果见图1。由图1可知,11株供试木霉液体发酵后发酵液中均检测出了纤维素酶活性,但各菌株的产酶能力存在着明显差异。11株木霉中有8株木霉的纤维素酶活性大于1 U,其中绿色木霉LS020、深绿木霉SS003和SWFC8686 3个菌株的纤维素酶活性超过1.4 U,平均分别达到1.595、1.644和1.420 U,显示出了较强的产酶能力。纤维素酶活性小于1 U的菌株仅有3株,分别为长枝木霉SWFC8690、里氏木霉SWFC8709和SWFC8732,其中产酶能力最差的菌株为SWFC8690,平均酶活性仅为0.344 U且与SWFC8709和SWFC8732菌株间存在显著差异(P<0.05)。
2.3 SS003菌株产纤维素酶的基本性质
2.3.1 温度对SS003菌株纤维素酶活性的影响 SS003菌株的粗酶液在40、45、50、55、60、65 ℃温度梯度条件下的酶活性见图2。从图2可以看出,SS003产生的纤维素酶(粗酶)在40~60 ℃温度范围内酶活力随温度的升高逐渐增加,但增加幅度不大。而当温度超过60 ℃时,随温度的继续升高,酶活力迅速下降。以上结果表明SS003的粗酶在60 ℃以下温度范围内对热较稳定。而当温度超过60 ℃后其热稳定性迅速下降。通过趋势图的比较可得出SS003菌株所产纤维素粗酶的最适反应温度范围为55~60 ℃。
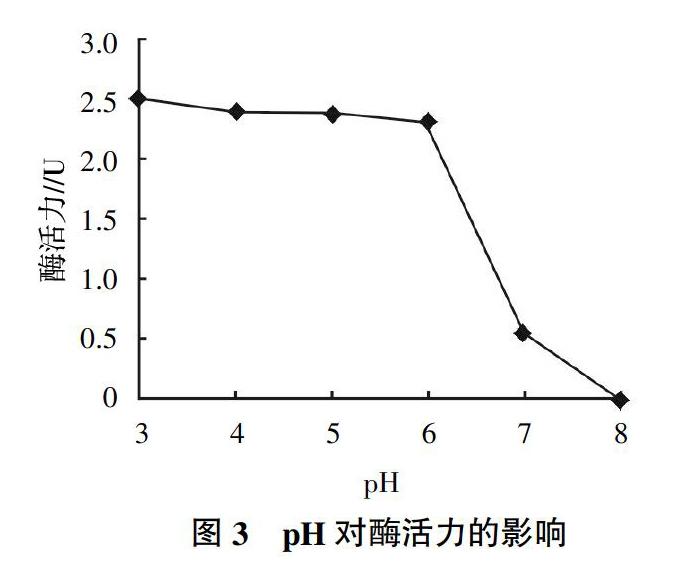
2.3.2 pH对酶活性的影响 SS003菌株的粗酶液分别在pH为3.0、4.0、5.0、6.0、7.0、8.0条件下的酶活性见图3。从图3可以看出,SS003产生的纤维素粗酶在3.0~6.0的pH范围内酶活力随着pH的升高而呈现出逐渐降低的趋势,但酶活力相对都较高,而当pH超过6以后,酶活力急剧下降,当pH升至8时酶已完全散失原有活力。以上结果表明该菌株所产纤维素粗酶具有酸稳定性而对碱不稳定。通过趋势图可以看出,在所测pH范围内SS003的纤维素粗酶在pH 3时的酶活力最高。
3 讨论
1)刚果红纤维素培养基筛选法[11]明显优于传统的筛选法。该法除了可用于识别产纤维素酶的菌株外,它还可用于初步判定酶活性高低。产酶越多,水解圈越大,产酶越快,水解圈出现越早。因此,根据水解圈/菌落直径大小、水解圈出现早迟可粗略估计菌株产酶情况,免去了一一筛选的烦琐。然而,虽然水解圈大小、水解圈/菌落直径大小直接反映了酶浓度的高低,但不能完全代表菌株产酶能力,这主要由于各种类型分泌纤维素酶的微生物本身差异就较大,水解圈大小除了同酶浓度有关外,应当还涉及到细胞壁厚薄、菌丝粗细和疏密、细胞聚集成团的程度、凝固剂多少而引起的水解酶渗过快慢、菌落与菌落之间相互位置和产物或分泌物抑制等因素,因而以水解圈大小、水解圈/菌落直径大小作为菌株产纤维素酶活力大小的定量指标是不可靠的,所以液体发酵复筛必不可少。只要能产纤维素酶的菌株都应该进行液体发酵,测定酶活力,这样得出的数据才比较可靠。
2)深绿木霉SS003在供试菌株中产生的纤维素酶活力最强,达到了1.64 U。通过测定不同温度和pH梯度条件下SS003的酶活力,发现该菌株产生的纤维素酶在一定范围内对热(40~60 ℃)和酸(pH 3~6)都具有稳定性;其最适反应温度为55~60 ℃、最适反应pH为3。本研究探索了木霉属部分菌株产纤维素酶的基本情况,发现了产纤维素酶活力最強的菌株SS003,为木霉属高产纤维素酶菌株的开发和利用奠定了基础。但是由于本研究供试菌株数量较少,若要全面反映木霉属产纤维素酶的情况,相关研究还有待进一步深入。
参考文献:
[1] 杨玉华,刘德海,王子光,等.纤维素酶提高食醋产量的研究[J].食品与发酵工业,1999,25(4):67-69.
[2] 高培基.纤维素酶降解机制及纤维素酶分子结构与功能研究进展[J].自然科学进展,2003,13(1):21-29.
[3] ROBSON L M,CHAMBLISS G H. Cellulases of bacterial Origin[J]. Enzyme and Microbial Technology,1989,11(10):626-644.
[4] JONES C S,KOSMAN D J. Purification, properties, kinetics,and mechanism of β-N-acetylglucosamidase from Asppergillus niger[J]. Journal of Biological Chemistry,1981,255(24):1186-1189.
[5] ADIKANE H V,PATIL M B. Isolation and properties of beta-glucosidase from Aspergillus niger[J]. Indian Journal of Biochemistry & Biophysics,1985,22(2):97-101.
[6] 张启先.纤维素和纤维素酶[J].微生物学通报,1976,3(2):31-34.
[7] 田新玉,王 欣.碱性纤维素酶的产生条件和一般性质[J].微生物学通报,1997,24(4):195-198.
[8] 詹 萍,吴 明.产纤维素酶菌种的分离筛选和酶学性质的研究[J].安徽农业科学,2009,37(19):5846-5847.
[9] 林远声,列璞怡.降解纤维素的真菌分离、筛选及其酶活测定[J].中山大学学报(自然科学版),2004,43(S1):82-85.
[10] 巫小琴,徐 强,李 燚,等.纤维素酶产生菌的分离及其酶活力测定[J].安徽农业科学,2009,37(35):17323-17325.
[11] 叶姜瑜.一种纤维素分解菌鉴别培养基[J].微生物通报,1997, 24(4):251-252.
