保健食品试制现场核查方式的优化研究
2016-10-19北京市保健品化妆品技术审评中心100053王健刘彬于春媛刘东红
北京市保健品化妆品技术审评中心(100053)王健 刘彬 于春媛 刘东红
1 背景
根据《保健食品注册管理办法(试行)》和《保健食品样品试制和试验现场核查规定(试行)》的相关规定,保健食品的试制现场核查由试制单位所在地的省级食药监局来办理。北京市作为试制单位的一个集中地区,承担了较多的试制现场核查数量。从受理情况来看,近年来从北京市食药监局受理的保健食品新产品注册分别有:543个(2012年)、643个(2013年)、721个(2014年)、730个(2015年)。
随着北京市范围内保健食品申报数量的不断增加,近年来试制现场核查的数量和难度也逐渐增大。由于保健食品申报周期较长、不同试制单位之间差异较大,目前统一的核查方式存在着重复性、低效率等弊端。因此,笔者认为有必要将北京市范围内保健食品试制现场核查根据试制单位的不同情况进行分类分析,发现存在的问题,探索针对不同情况的试制单位进行相应的优化,从而改进试制现场核查的工作方式,提高试制现场核查的工作效率。
2 目前试制现场核查方式
2.1 法规要求 根据《保健食品注册管理办法(试行)》和《保健食品样品试制和试验现场核查规定(试行)》的规定,省、自治区、直辖市(食品)药品监督管理部门受国家食品药品监督管理总局委托,负责对国产保健食品注册申请资料的受理和形式审查,对申请注册的保健食品试验和样品试制的现场进行核查。
试制现场核查的具体内容包括样品试制单位的生产资质证明、按照申报资料的工艺流程图核查样品的生产工艺工程、样品的原料来源和投料记录、抽取检验用样品和其它需要核查的内容。
省、自治区、直辖市食品药品监督管理部门应当在保健食品注册申请受理后的15日内组织并完成现场核查。
2.2 目前核查方式 北京市食品药品监督管理局严格执行国家食药监总局(局)下发的各项规定和文件精神,按照要求开展保健食品的试制现场核查工作。北京市食药监局官方网站上公布的保健食品申报流程对现场核查做了详细规定。
目前保健食品的试制现场核查工作由北京市保健品化妆品技术审评中心负责组织开展,针对每一个申报的产品,在受理之后规定的时限内,前往样品的试制现场,按照法规规定的核查内容和程序对该产品进行核查。

附表 2015年试制现场核查情况统计
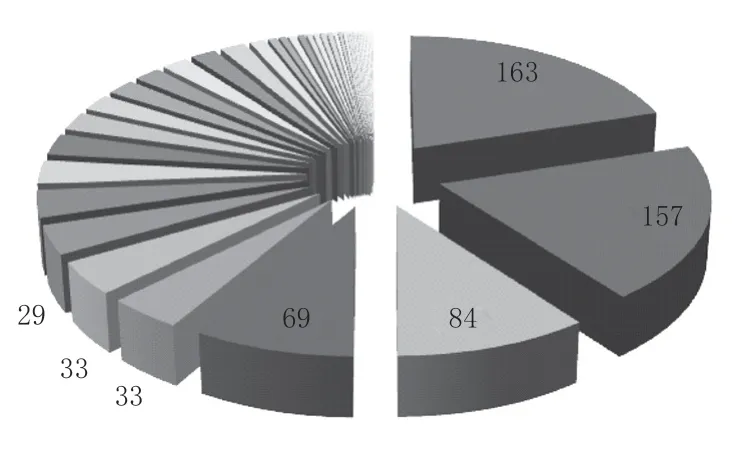
各现场核查产品数量分布情况
按照北京市局公布的保健食品注册事项的相关流程,编号为38-32-01(新产品注册)、38-32-02(变更)、38-32-03(再注册)、38-32-04(技术转让)的事项的审查时限分别为8个、3个、12个、3个工作日,而作为其中的一部分,试制现场核查的时限也不能超出上述时限。
3 目前核查方式存在的问题
3.1 现行的试制现场核查方式是按照产品受理情况,在8个工作日内对涉及同一试制现场的产品进行合并、逐一核查。这样的核查方式,会出现某个试制现场在较短时间内多次接受核查的请况。
通过对2015年试制现场核查情况进行统计,各现场核查情况(见附表和附图)。
(未完待续)
