常备试剂法提取人外周血DNA
2016-10-19刘青青孙丹丹
刘青青,孙丹丹,冯 巍,陈 炯
·法医学·
常备试剂法提取人外周血DNA
刘青青1,孙丹丹2,冯巍3,陈炯3
目的探讨使用一种常备试剂提取外周血DNA,而无需PK、毒性有机溶剂或特殊缓冲液。方法分别使用常备试剂法、试剂型kit法和柱式型kit法提取外周血DNA,进而比较3种方法的DNA产量和质量。结果使用常备试剂法,提取200 μL人外周血的DNA量为(5.77±3.49) μg,低于试剂型kit法(P<0.05),但与柱式型kit法(P=0.10)差异无统计学意义。常备试剂法提取的DNA样品,A230/A260为0.49±0.05,A260/A280为1.98±0.10,片段大于15 kb,AluI、BamHI-HF酶切完全,PCR扩增稳定、高效,DNA质量与两种kit法差异无统计学意义。常备试剂法的每样品耗费低,操作时间约30~40 min。结论常备试剂法能够保证外周血DNA产量和质量,试剂方便易得,操作快速、安全,且费用低廉,可作为一般实验室备选方案。
外周血;基因组DNA;DNA提取
从基础生物研究到临床诊疗,外周血是最常用的生物样品之一[1-3]。DNA提取试剂盒通常价格昂贵,且不宜于长期存储、随时取用,因而在一般实验室,尤其是处理小批量外周血样品时,手工提取方案仍然具有廉价、易于调控、无需特殊设备等优势[2,4-6]。但是,使用传统手工方案提取外周血DNA,或者需要长时间酶解组织[7-8],或者需要毒性有机试剂[4,8],或者DNA质量欠佳[9],而且通常需要配制特殊的反应缓冲液[2,5,8]。本研究拟使用一般实验室常备试剂,弃用蛋白酶、毒性试剂及特殊缓冲液,尝试寻求一种简便、安全、低廉且高效的外周血DNA提取方法,现报道如下。
1 材料与方法
1.1材料15% EDTA·2Na抗凝外周血20份,4 ℃冷藏时间小于32 h,由河南科技大学法医学院提供。
1.2DNA提取
1.2.1柱式型kit法取抗凝血200 μL,使用PureLink Genomic DNA Mini Kit(Thermo Fisher Scientific Inc,USA),参照说明书提取DNA。
1.2.2试剂型kit法取抗凝血200 μL,使用DNAzol BD Reagent Kit(Thermo Fisher Scientific Inc,USA),参照说明书提取DNA。
1.2.3常备试剂法①取抗凝血200 μL加入1.5 mL离心管,加入3倍体积(600 μL)去离子水,轻弹离心管壁混匀;常温4 000 g离心3 min;弃上清及影细胞。②加入2倍体积(400 μL)60 mol·L-1NaCl溶液,悬浮并分散沉淀物;常温4 000 g离心3 min;弃上清及影细胞。此步骤可重复操作1~2次,至沉淀物呈灰白色。③加入2倍体积1×TE缓冲液(400 μL),轻弹离心管壁,悬浮并分散沉淀物;再加入10% SDS 8 μL,颠倒混匀;65 ℃水浴5 min。④加入1倍体积6 mol·L-1NaCl溶液(200 μL),涡流震荡3~5 s;使用预冷离心机,离心力20 000 g,4 ℃离心5 min。⑤取上清500 μL,加入1 mL无水乙醇,混匀,4 ℃静置5 min;使用预冷离心机,离心力20 000 g,4 ℃离心10 min。⑥弃上清,加入预冷70%乙醇400 μL,上下翻转离心管数次;使用预冷离心机,离心力20 000 g,4 ℃离心3 min。⑦弃上清,通风橱内风干3 min,加入100 μL TE充分溶解DNA沉淀。
1.3DNA产量和质量检测
1.3.1紫外分光光度检测使用FLA6000型紫外可见分光光度仪(杭州晶飞科技有限公司,中国),测定DNA样品的A230、A260、A280。
1.3.2琼脂糖凝胶电泳取0.3~0.6 μg DNA样品,0.8%琼脂糖凝胶电泳,0.5% EB染色成像。
1.3.3RE酶切取0.3~0.6 μg DNA,加入10 U BamHI-HF和2 μL 10×NEBuffer(NEB,USA),用去离子水补足至20 μL;37 ℃温育90 min。取0.3~0.5 μg DNA,加入5 U AluI和2 μL 10×NEBuffer 4(NEB,USA),用去离子水补足至20 μL;37 ℃温育30 min。酶切产物使用0.8%琼脂糖凝胶电泳,EB染色。
1.3.4PCR扩增上下游PCR引物:849-F (5’-TTGTAACTCCTTTAAATTGATCAC-3’)和849-R (5’-CCATAACAAAATCTTTAATGGAA-3’) ,由生工生物工程(上海)股份有限公司合成。10 μL 反应体系,包括0.1 μg DNA样品,0.2 μM 849-F/R,200 μM dNTPs,0.5 U of Recombinant Taq DNA Polymerase (Takara Biotechnology Co.Ltd)和1×PCR buffer。PCR扩增参数为:98 ℃预变性30 s,而后98 ℃变性10 s,54 ℃退火15 s,72 ℃延伸30 s ,共计28个循环反应,此后 72 ℃温育5 min。PCR扩增产物经 0.8%琼脂糖凝胶电泳,EB染色。

2 结果
2.1DNA产量初始样品量为200 μL人外周血,CRP的DNA产量为(5.77±3.49) μg,低于PureLink Genomic DNA Mini Kit[(8.79±4.39) μg,P<0.05],但与DNAzol BD Reagent Kit差异无统计学意义 [(6.46±3.64 ) μg,P=0.10],见表1。
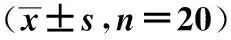
表1 3种方法提取200μL外周血DNA 的产量与纯度比较
注:①与柱式型kit法比较:P<0.05。
2.2DNA质量CRP提取DNA,其A230/A260为0.49±0.05,A260/A280为1.98±0.10,与kit法差异无统计学意义,见表1。3种方法提取人外周血DNA,均富集于15~20 kb之间形成高亮条带区,见图1A。限制性内切酶BamHI-HF、AluI消化完全,见图1B、C。PCR扩增均可获得稳定、清晰的产物谱带,见图2。

DNAzol BD Reagent Kit (第1、4、5道),PureLink Genomic DNA Mini Kit (第2、6、7道),常备试剂法(第3、8、9道)。DNA上样量:第1~3道为0.6 μg,第4~9道为0.3 μg。M为DL15,000 DNA Marker图1 A:琼脂糖凝胶电泳;B:AluI酶消化处理;C:CBamHI-HF酶消化处理

DNAzol BD Reagent Kit(第1~3道),PureLink Genomic DNA Mini Kit(第4~6道),常备试剂法(第7~9道)。M为DL2,000 DNA Marker图3 3种方法提取DNA样品的常规PCR扩增产物
2.3试剂易得性、操作时间、安全性和费用比较本文常备试剂法提取外周血DNA,仅需一次管间样品转移,能够有效避免样品交叉污染。同时,操作简洁、快速,约30~40 min即可完成全血DNA提取,长于柱式kit法,但与试剂型kit法大致相同,见表2。

表2 3种DNA提取方法的毒性、操作时间和费用比较
注:①产品手册说明标注。
3 讨论
3.1DNA产量与质量
DNA产量通常是评价DNA提取方法优劣的首要指标。使用本文常备试剂法,200 μL全血的DNA产量为(5.77±3.49) μg,最高可达12.76 μg,虽低于柱式kit法,但与试剂型kit法比较差异无统计学意义。采用紫外分光光度法测评DNA纯度,如果A230/A260/A280为1/1.8/1,则认为DNA样品中小分子、盐类及蛋白质残留较少,纯度较好[10-11]。本研究中常备试剂法提取外周血DNA,其A230/A260为0.49±0.05,A260/A280为1.98±0.10,虽略高于kit法,但差异无统计学意义。
DNA完整性是衡量DNA质量的关键指标,涉及DNA一级结构损伤问题(分子断裂、碱基损伤或脱失、共价交联等),往往直接决定后续DNA分析工作的成败。琼脂糖凝胶电泳表明,3种方法提取的基因组DNA,均未见明显涂抹样降解的DNA碎片表现,且富集于15~20 kb之间形成高亮条带区,因此,就DNA断裂程度而言,本研究常备试剂法提取的DNA样品,能够满足大多数DNA分析工作。同时,本研究中发现选择新鲜抗凝血或组织样品,分别使用多种DNA提取方法时,凡是在细胞裂解后进行短暂涡流震荡操作,所得DNA样品片段大小基本一致。对于3种方法提取的DNA样品,均分别使用BamHI-HF、AluI处理,酶切产物电泳结果显示消化完全;分别进行PCR常规扩增,各DNA样品均可获得稳定、清晰的产物谱带;因此,就DNA完整性而言,3种方法之间无明显差异。
3.2试剂易得性、操作时间、安全性和费用
理想的DNA提取方法,除保证DNA产量和质量之外,还要考虑设备和试剂易得性、操作快捷性和安全性、费用等指标。本研究中常备试剂法仅涉及去离子水、NaCl、SDS、1×TE缓冲液和乙醇,均是理化性质稳定的一般实验室常备试剂,仅需离心机、水浴箱和涡流振荡器,因而适用范围广。而且不使用苯酚、氯仿、甲酰胺、盐酸胍等任何毒性试剂,操作安全,也不会造成环境或人身损害[5,8]。本研究方法的操作时间大体与chelex法相近,而远小于蛋白酶K/苯酚法、经典盐析法乃至一些试剂盒提取法[2,4,8]。耗费低廉是此常备试剂法的突出优点,每样品费用不足0.05元,而柱式kit法、试剂型kit法则分别花费28.42元、13.77元,因此费用最为低廉[2,4]。
本研究的常备试剂法提取血样DNA,不需配置特殊缓冲液,不使用毒性有机试剂,直接使用理化性质稳定的一般实验室常备试剂,操作安全性好,而且省时省力。获取的DNA质量不逊于柱式kit法和试剂型kit法。尤其突出的是本方法费用低廉,远远低于两种kit法,可作为一般实验室备选方案。
[1]Gong R,Li S.Extraction of human genomic DNA from whole blood using a magnetic microsphere method [J].Int J Nanomedicine,2014,9(1):3781-3789.
[2]Psifidi A,Dovas CI,Bramis G,et al.Comparison of eleven methods for genomic DNA extraction suitable for large-scale whole-genome genotyping and long-term DNA banking using blood samples[J].PLoS One,2015,10(1):e0115960.
[3]Griffiths L,Chacon-Cortes D.Methods for extracting genomic DNA from whole blood samples: current perspectives[J].J Bioreposit Sci App Med,2014,2:1-9.
[4]Carpi FM,Di Pietro F,Vincenzetti S,et al.Human DNA extraction methods: patents and applications [J].Recent Pat DNA Gene Seq,2011,5(1):1-7.
[5]Tan SC,Yiap BC.DNA RNA,and protein extraction: the past and the present[J].J Biomed Biotechnol,2009,2009:574398.
[6]Chacon-Cortes D,Haupt LM,Lea RA,et al.Comparison of genomic DNA extraction techniques from whole blood samples: a time,cost and quality evaluation study[J].Mol Biol Rep,2012,39(5):5961-5966.
[7]Di Pietro F,Ortenzi F,Tilio M,et al.Genomic DNA extraction from whole blood stored from 15-to 30-years at-20 degrees C by rapid phenol-chloroform protocol:a useful tool for genetic epidemiology studies[J].Mol Cell Probes,2011,25(1):44-48.
[8]Nasiri H,Forouzandeh M,Rasaee MJ,et al.Modified salting-out method: high-yield,high-quality genomic DNA extraction from whole blood using laundry detergent [J].J Clin Lab Anal,2005,19(6):229-232.
[9]Altayari W.DNA Extraction:Organic and solid-phase[J].Methods Mol Biol,2016,1420:55-68.
[10]Simbolo M,Gottardi M,Corbo V,et al.DNA qualification workflow for next generation sequencing of histopathological samples[J].PLoS One,2013,8(6):e62692
[11]Lee JH,Park Y,Choi JR,et al.Comparisons of three automated systems for genomic DNA extraction in a clinical diagnostic laboratory[J].Yonsei Med J,2010,51(1):104-110.
A Common Reagents Protocol for DNA Extraction from Human Peripheral Blood Samples
LIU Qing-qing1,SUN Dan-dan2,FENG Wei3,CHEN Jiong3
(1.Xiayi People’s Procuratorate,Xiayi 476400,China;2.Luoyang Municipal Public Security Bureau,Luoyang 471000,China;3.School of Forensic Medicine,Henan University of Science and Technology,Luoyang 471003,China)
ObjectiveTo propose a common reagents protocol (CRP) for DNA extraction from human peripheral blood samples.This CRP does not contain enzymes like proteinase-K,hazardous solvents like phenol,and special buffers like chaotropic agents.MethodsHuman peripheral blood samples were treated with the CRP,DNAzol BD Reagent Kit and PureLink Genomic DNA Mini Kit,respectively.Then the yield and quality of DNA extracted were evaluated and compared.ResultsThe average yield of DNA isolated by CRP was (5.77±3.49)μg that was lower than chaPureLink Genomic DNA Mini Kit (P<0.05),but the same as DNAzol BD Reagent Kit (P=0.10).The A230/A260 was 0.49±0.05,and A260/A280 was 1.98±0.10.Gel electrophoresis of the isolated DNA samples showed that the DNA fragments were above 15 kb.The isolated DNA was successfully digested by BamHI-HF or AluI restriction enzymes,and PCR amplification was also performed completely,indicating the DNA produced by CRP had acceptable quality.The CRP could be completed within 30~40 min.Furthermore,all the reagents were common and the most cost-effective of all methods.ConclusionThe efficiency,speed,safety,and cost-effectiveness make this CRP as an appropriate alternative to existing protocols for extracting DNA from peripheral blood in conventional laboratories.
peripheral blood;human genomic DNA;DNA extraction
1672-688X(2016)03-0219-04DOI:10.15926/j.cnki.issn1672-688x.2016.03.017
国家自然科学基金(81501634)
2016-07-25
1.夏邑县人民检察院,河南夏邑476400
2.洛阳市公安局,河南洛阳 471000
3.河南科技大学法医学院,河南洛阳 471003
刘青青(1986-),女,河南夏邑人,法医师,从事法医学研究及鉴定工作。
Q785
A
