响应面试验优化微波法提取刺玫籽原花青素的工艺
2016-10-18容晨曦张秀玲李铁柱胡济美李倬林
容晨曦,张秀玲,*,李铁柱,胡济美,张 杰,李倬林
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.吉林省农业科学院,吉林 长春 130033;3.中国国际工程咨询公司,北京 100048)
响应面试验优化微波法提取刺玫籽原花青素的工艺
容晨曦1,张秀玲1,*,李铁柱2,胡济美3,张杰2,李倬林2
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.吉林省农业科学院,吉林 长春 130033;3.中国国际工程咨询公司,北京 100048)
利用响应面分析,对微波法提取刺玫籽中原花青素工艺进行优化。采用铁盐催化法测定原花青素质量分数,结果表明刺玫籽中原花青素总含量为(1.55±0.12) g/100 g。单因素试验结果表明,六偏磷酸钠添加量为0.2%时能达到最佳稳定效果。在此基础上,选取提取时间、料液比、微波功率、乙醇体积分数为自变量,以原花青素提取率为响应值,采用Box-Behnken设计方法,研究各因素及其交互作用对原花青素提取率的影响。结果表明,最佳工艺参数为:提取时间70 s、料液比1∶20(g/mL)、微波功率360 W、乙醇体积分数60%。经验证,单次提取原花青素的提取率为72.58%,与预测值73.46%相比,相对误差为1.12%,表明优化工艺参数可靠。提取次数为3 次时,原花青素提取率可以达到93.19%。
刺玫籽;原花青素;响应面;提取工艺
刺玫果(Rosa davnrica Pall.)又称山刺玫,是一种具有开发前途的野生经济植物,分布于我国黑龙江、吉林、山东、内蒙古及河北等省区[1]。刺玫果果实有很高的药用价值[2-4],刺玫果籽中也含有丰富的营养物质,如刺玫籽油(质量分数8%)等[5],然而刺玫果加工过程中产生的刺玫果籽常作为生产废料,一般不被国内利用,或直接烧毁,或出口到国外,用于动物饲料,造成了资源的浪费。原花青素(proanthocyanidins,PC)是目前国际公认的天然抗氧化剂,以高效、低毒、高生物利用率著称,可预防自由基相关疾病[6-10]。因此,若能使刺玫籽变废为宝,充分利用刺玫籽中的原花青素物质,将为刺玫果开发行业带来巨大的经济利益。
近年来,利用微波技术的研究受到广泛的关注,研究[11-14]采用微波辅助法提取葡萄籽中的原花青素,较传统提取方法缩短了提取时间;赵春艳等[15]在山楂果中提取原花青素,采用微波法提取率是传统方法的2 倍。本实验采用微波法提取刺玫果籽中的原花青素,利用响应面分析法优化提取条件,开发出简单、有效的提取工艺,对延长刺玫果产业链具有重要的现实意义。
1 材料与方法
1.1材料、试剂与仪器
刺玫籽购自东北长白山区;原花青素标品(纯度≥95%) 天津一方科技有限公司;其余试剂均为国产分析纯。
722E可见分光光度计 上海光谱仪器有限公司;HWS24型恒温水浴锅 上海一恒科技有限公司;FW100中草药粉碎机 天津市泰斯特仪器有限公司;JW-1016低速离心机 安徽嘉文仪器装备有限公司;FA2004B电子分析天平 上海佑科仪器仪表有限公司;LABCONCO冷冻干燥机 美国Labconco公司。
1.2方法
1.2.1刺玫籽原花青素提取工艺流程
刺玫籽→烘干(40 ℃)→粉碎(60 目)→正己烷脱脂→滤去浸提液→脱脂刺玫籽粉末→自然挥干溶剂→微波提取→离心取上清液(4000 r/min,10 min)
1.2.2刺玫籽原花青素含量测定
1.2.2.1标准曲线的绘制
以葡萄籽原花青素为标准品,分别配制质量浓度为12.5、25、50、100、200 μg/mL的标准液,采用铁盐催化法[16-17],各取1 mL移入带塞试管中,然后加入2%硫酸铁铵溶液(溶解于2 mol/L盐酸)0.2 mL和95%正丁醇-盐酸溶液6 mL,摇匀。反应液于100 ℃沸水浴中准确反应40 min后,冰水迅速冷却,在550 nm波长处测定其吸光度,用乙醇代替样品作为空白对照。重复测定3 次,根据吸光度与质量浓度对应关系绘制标准曲线,得到回归方程为:Y=0.003 6X+0.041 8,R2=0.996 7。原花青素质量浓度在12~200 μg/mL范围,线性关系良好。
1.2.2.2刺玫籽中可提取原花青素总含量的测定[18]
取刺玫籽粉200 mg,加入10 mL的70%丙酮溶液在室温条件下漩涡混匀器提取30 min,10 000 r/min离心15 min。再用70%丙酮溶液洗涤残渣3 次,离心,合并上清液定容至25mL。取待测1 mL,加入显色剂,操作同上,测定其吸光度,重复3 次。
1.2.2.3原花青素提取率的测定
微波提取原花青素,离心,取上清液定容至一定体积(据情况而定),取定溶液1 mL替代上述方法中标准液,测定吸光度。重复3 次,根据回归方程,按公式(1)、(2)计算提取的原花青素含量和提取率。

式中:c为所测溶液吸光度带入方程得到原花青素质量浓度/(μg/mL);m为刺玫籽粉质量/g;N为稀释倍数;V为试样定容体积/mL。
1.2.3单因素试验设计
称取刺玫籽粉末0.500 g,按照料液比1∶20加入70%的乙醇溶液及添加0.1%的六偏磷酸钠(sodium hexametaphosphate,SH),在微波功率为160 W条件下提取60 s,测定原花青素提取率。固定其他条件,分别考察料液比(1∶10、1∶15、1∶20、1∶25、1∶30、1∶35,g/mL)、乙醇体积分数(30%、40%、50%、60%、70%、80%)、提取时间(10、30、50、70、90、110 s)、微波功率(160、320、480、640、800 W)、SH添加量(0%、0.1%、0.2%、0.3%、0.4%、0.5%)对原花青素提取率的影响。
1.2.4响应面试验设计
在单因素试验基础上,以原花青素提取率作为响应值,对提取时间、料液比、微波功率、乙醇体积分数进行条件优化,采用Box-Behnken试验设计,进行响应面分析,因素与水平见表1。

表1 Box-Behnken设计试验因素水平及编码Table1 Levels and codes of independent variables used for BoxBehnken design
1.3数据处理
数据采用SPSS 19.0软件对数据进行方差分析及LSD多重比较,SigmaPlot作图,Design-Expert 8.0软件进行响应面分析。
2 结果与分析
2.1刺玫籽中可提取的原花青素总含量
通过铁盐催化法测定刺玫籽中可提取原花青素总含量为(1.55±0.12) g/100 g。
2.2微波法提取刺玫籽原花青素单因素试验结果
2.2.1料液比对提取率的影响
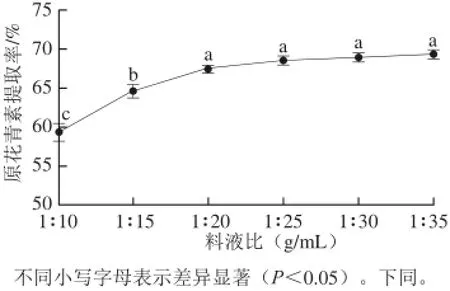
图1 料液比对原花青素提取率的影响Fig.1 Effect of liquid to material ratio on the extraction yield of proanthocyanidins
由图1可知,当料液比为1∶10时,溶剂挥发过多,不能充分浸提原料,原花青素提取率波动较大,随着溶剂提取量的增加,原花青素提取率逐渐增加,在料液比为1∶30时达到最大值,随后提取率呈稳定的趋势,说明此时原花青素已经接近析出完全。由图1可知,料液比从1∶20~1∶35差异不显著,且继续增加溶剂用量会造成后续步骤减压蒸馏时间的延长和溶剂的浪费,因此单次提取最佳料液比选择为1∶30。考虑加工中需多次提取,使浓缩时间延长,为降低提取成本,防止原花青素在浓缩过程中损失,料液比应控制在1∶25内为佳。
2.2.2乙醇体积分数对提取率的影响

图2 乙醇体积分数对原花青素提取率的影响Fig.2 Effect of ethanol concentration on the extraction yield of proanthocyanidins
由图2可知,随着乙醇体积分数的增大,溶剂对细胞壁的穿透作用逐渐增大,对氢键的破坏能力增强,且水在溶剂中也起到穿透细胞壁的作用,通过调节乙醇-水配比改变溶液极性[19],有利于原花青素的析出,在乙醇体积分数为60%时达到最大值。随后,随着乙醇体积分数的增大提取率呈下降趋势,这是由于一些醇溶性杂质、亲脂性强的成分与原花青素竞争[20],同乙醇-水分子结合,从而导致原花青素的提取率下降。因此最佳乙醇体积分数为60%。
2.2.3提取时间对提取率的影响
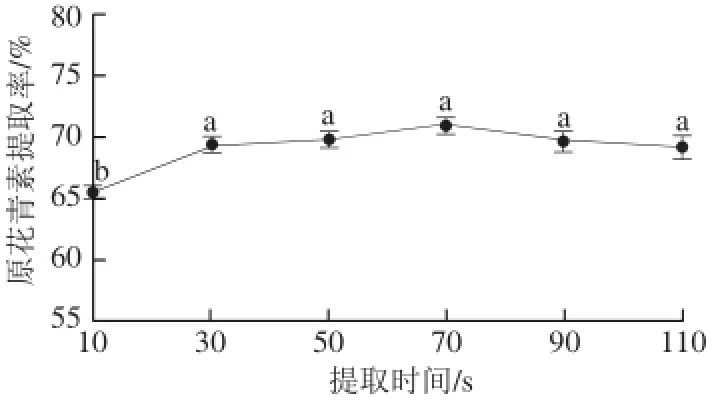
图3 提取时间对原花青素提取率的影响Fig.3 Effect of extraction time on the extraction yield of proanthocyanidins
由图3可知,提取率随时间的延长逐渐增加,在70 s时原花青素浸出率达到最大值,以后趋于稳定并逐渐下降。其原因可能是随着提取时间的延长,原花青素受高温影响结构发生改变,提取率降低。因此,选择最佳提取时间为70 s。
2.2.4微波功率对提取率的影响
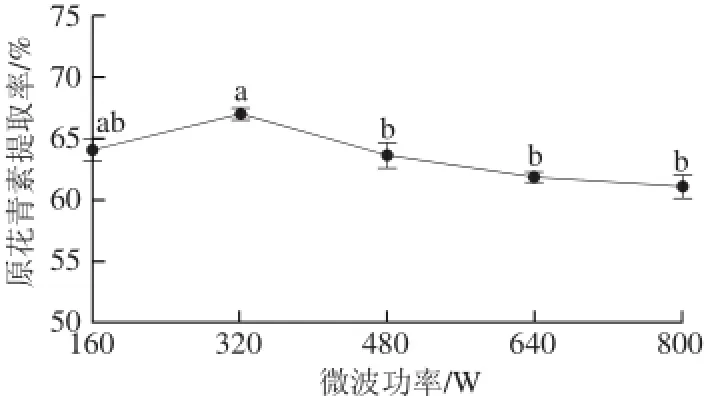
图4 微波功率对原花青素提取率的影响Fig.4 Effect of microwave power on the extraction yield of proanthocyanidins
由图4可知,原花青素提取率随着微波功率的增大呈现先增后降的趋势,原花青素提取率在320 W时达到最大值,随着微波功率的继续增加,提取率明显降低。原因是微波功率的增大释放出大量的热,造成溶液温度过高,导致原花青素结构被破坏,易发生氧化聚变,并且高温条件下固体原料本身会起化学变化[21],使杂质过多从而提取率降低。
2.2.5SH添加量对提取率的影响
从图5可知,SH添加量在0.2%之内时,原花青素得率随添加量增加而增加,原因是SH保护原花青素不被氧化,但过多的SH会改变提取液的极性[22],可能导致原花青素的提取率下降。所以选择0.2%作为SH添加量,可起到最佳稳定效果。
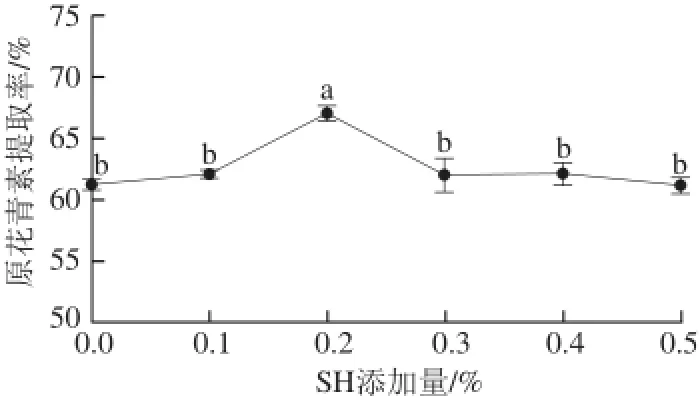
图5 SH添加量对原花青素提取率的影响Fig.5 Effect of SH concentration on the extraction yield of proanthocyanidins
2.3响应面试验结果
2.3.1响应面法分析数学模型的建立及显著性分析
在单因素的试验基础上,采用Box-Behnken试验设计原理,以原花青素提取率为响应值,选取提取时间(X1)、料液比(X2)、微波功率(X3)、乙醇体积分数(X4)为影响因素,进行四因素三水平的响应面分析。使用Design-Expert 8.0软件,对表2的数据进行处理、分析,得到表3回归方程方差分析表,利用软件进行非线性回归的二次多项式拟合,得到预测模型如下:


表2 Box-Behnken试验设计及结果Table2 Box-Behnken design with experimental results
对该模型进行显著性检验,如表3所示,可以看出该模型回归显著(P<0.000 1),失拟项不显著,且R2=0.927 2,=0.854 5,说明该模型与实际拟合度较好,自变参数与响应值之间关系显著,因此可以用于微波法提取刺玫籽原花青素的工艺预测。根据F检验可以得到各个因素影响的大小顺序为:X3>X2>X1>X4,即微波功率>料液比>提取时间>乙醇体积分数。
根据回归方程,做出响应面分析图,考察所拟合的响应曲面的形状,分析各因素之间的相互作用。

表3 方差分析Table3 Analysis of variance of regression model
2.3.2响应面曲面分析


图6 各两因素交互作用对原花青素提取率影响的响应面图Fig.6 Response surface plot showing the effects of four variables on the extraction rate of proanthocyanidins
响应面图曲面坡度陡峭、等高线密集成椭圆形表示两因素交互影响大,由图6c、d可以看出,提取时间与料液比、料液比与乙醇体积分数交互作用较大。图6a、e坡度相对平缓,等高线呈圆形,说明提取时间与乙醇体积分数、料液比与微波功率的交互作用对刺玫籽原花青素提取率影响相对较小。图6e、f中,随着微波功率增大,原花青素提取率明显增大,表明微波功率对原花青素提取率的影响较大,微波功率在320~400 W时,提取率最高。原因是微波功率在160 W时,对细胞膜破坏较小,原花青素析出较少,而微波功率为480 W时,温度过高,原花青素氧化损失,结构受到破坏[23]。
2.3.3验证实验结果
利用Design-Expert 8.0软件,分析得出微波法提取原花青素的最佳提取条件为:提取时间71.45 s、料液比1∶20.69(g/mL)、微波功率392.26 W、乙醇体积分数60%,此时原花青素提取率预测值为73.46%。考虑实际操作,选择提取时间(X1)70 s、料液比(X2)1∶20(g/mL)、微波功率(X3)360 W、乙醇体积分数(X4)60%,验证实验得到刺玫籽原花青素提取率为72.58%,与预测值相比,其相对误差为1.12%,说明试验优化得到的技术参数是可靠稳定的。
2.3.4提取次数确定

表4 不同提取次数条件下原花青素的提取效果Table4 Effect of extraction cycles on the extraction rate of proanthocyanidins
由表4可以看出,在响应面优化工艺条件基础上,当提取次数为2、3 次时提取率分别为87.42%、93.19%;当提取次数为4、5 次时,原花青素提取率为94.17%、94.89%,相比提取3 次提取率增长不明显。所以提取次数确定为3 次。
3 结 论
在植物籽中,除葡萄籽中原花青素含量(6.83%)较高,少见植物籽含有丰富的原花青素,个别不含原花青素[24]。据测定,本研究选用的刺玫籽中原花青素总含量为(1.55±0.12) g/100 g。通过单因素试验显示:添加0.2%的SH达到最佳稳定效果。以响应面分析法对微波法提取工艺继续优化,拟合了提取时间、料液比、微波功率、乙醇体积分数4 个因素对原花青素提取率影响的回归模型,得到优化的工艺条件为:提取时间70 s、料液比1∶20(g/mL)、微波功率360 W、乙醇体积分数60%。在此条件下,原花青素提取率为72.58%,与预测值相比,其相对误差为1.12%,说明试验优化得到的技术参数可靠。以响应面优化后的参数,提取3 次时刺玫籽的原花青素提取率可以达到93.19%。
实验结果表明,采用微波工艺提取刺玫籽中的原花青素,不仅较传统方法大大缩短了提取时间和加热时间[25],提取率较高,且操作简单,为刺玫籽原花青素的进一步开发提供了理论依据。
[1] 杨晓辉, 李国兴. 刺玫果的种源选择[J]. 中国林副特产, 2010, 21(2): 39-40. DOI:10.3969/j.issn.1001-6902.2010.02.017.
[2] 何媛媛, 陈凡, 孙爱东. 刺玫果功效及食品开发研究进展[J]. 中国食物与营养, 2015, 21(6): 25-28.
[3] GUO Z, XU L. Procyanidin: aplant medicine with many uses[J]. World Phytomed, 1996, 11(5): 196-205.
[4] 张国贞, 李芳兰. 野生刺玫瑰果营养成分分析及评价[J]. 食品研究与开发, 2001, 22(6): 38-40. DOI:10.3969/j.issn.1005-6521.2001.06.017.
[5] SZNTMIHALYI K, VINKLER P, LAKATOS B, et al. Rose hip(Rosa canina L.) oil obtained from waste hip seeds by different extraction methods[J]. Bioresource Technology, 2002, 82(2): 195-201. DOI:10.1016/S0960-8524(01)00161-4.
[6] 叶春皓. 超临界CO2萃取-大孔树脂吸附提取原花青素的研究[D].天津: 天津大学, 2005. DOI:10.7666/d.y848414.
[7] WU Zhaoxia, MENG X J, LI Xingxia, et al. Study on extracting of grape seed oil and procyanidins (OPC’s) by supercritical fluid extract-CO2[J]. Food Science and Technology, 2005, 7: 47-49. DOI:10.3969/ j.issn.1005-9989.2005.07.014.
[8] SUN C, MCINTYER K, SALEEM A, et al. The relationship betweenantiglycation activity and procyanidin and phenolic content in commercial grape seed products[J]. Canadian Journal of Physiology and Pharmacology, 2012, 90(2): 167-174. DOI:10.1139/y11-121.
[9] TAKAHATA Y, OHNISHI K M, FURUTA S, et al. Highly polymerized procyanidins in brown soybean seed coat with a high radical-scavenging activity[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 5843-5847. DOI:10.1021/jf010307x.
[10] DAUGHENBAUGHA K F, HOLEDMESS J, GRAFF J C, et al. Contribution of transcript stability to a conserved procyanidininducedcytokine response in γδT cells[J]. Genes and Immunity, 2011,12(5): 378-389. DOI:10.1038/gene.2011. 7.
[11] 任俊, 曹飞, 卢金珍. 微波辅助有机溶剂法提取葡萄籽中原花青素的工艺研究[J]. 保鲜与加工, 2010, 10(4): 44-47. DOI:10.3969/ j.issn.1009-6221.2010.04.013.
[12] 李瑞丽, 马润宇. 微波辅助提取葡萄籽原花青素的工艺研究[J]. 粮食与食品工业, 2008, 15(1): 33-35. DOI:10.3969/j.issn.1672-5026.2008.01.011.
[13] 刘丽萍, 赵祥颖, 刘建军. 葡萄籽原花青素的功能及提取工艺[J]. 食品与药品, 2006, 8(12): 17-21. DOI:10.3969/j.issn.1672-979X.2006.12.006.
[14] SPARR E C, BJORKLUND E. Analytical-scale microwave-assisted extraction[J]. Journal of Chromatography A, 2000, 902(1): 227-250. DOI:10.1016/S0021-9673(00)00921-3.
[15] 赵春艳, 张泽生, 刘海俊. 微波提取山楂果中原花青素工艺的研究[J]. 食品研究与开发, 2006, 26(6): 37-40. DOI:10.3969/ j.issn.1005-6521.2005.06.011.
[16] 李华, 肖付才, 袁春龙, 等. 铁盐催化比色法测定葡萄籽超微粉中的原花青素[J]. 食品研究与开发, 2007, 28(9): 114-117. DOI:10.3969/ j.issn.1005-6521.2007.09.036.
[17] 肖付才, 李华, 王华. 葡萄籽原花青素的提取和检测方法[J]. 食品研究与开发, 2007, 28(6): 165-169. DOI:10.3969/j.issn.1005-6521.2007.06.051.
[18] 李春阳. 葡萄籽中原花青素的提取纯化及其结构和功能研究[D].无锡: 江南大学, 2006. DOI:10.7666/d.y968311.
[19] 余红军, 李立祥, 倪媛, 等. 油茶籽壳中多糖和原花青素的超声波提取工艺[J]. 食品与发酵工业, 2010, 8(8): 194-197.
[20] 张力, 孙秀利, 王松青. 微波法提取葡萄籽中原花青素的工艺研究[J]. 中草药, 2008, 38(12): 1808-1811. DOI:10.3321/ j.issn:0253-2670.2007.12.015.
[21] 魏福祥, 韩菊, 王改珍. 低聚原花色素提取技术研究[J]. 食品工业科技, 2004, 24(9): 54-55. DOI:10.3969/j.issn.1002-0306.2003.09.024.
[22] 赵国建, 陈晓丹, 高海涛. 六偏磷酸钠辅助提取茄子多酚及其体外抗氧化研究[J]. 中国食品学报, 2012, 12(10): 56-61.
[23] 张佰清, 张艳艳, 李龙杰. 微波提取树莓籽中原花青素工艺[J]. 食品科学, 2011, 32(6): 25-28.
[24] 刘洪, 李淼, 冯静, 等. 成都地区市售水果中原花青素含量的分析比较[J]. 陕西农业科学, 2011, 57(4): 35-37. DOI:10.3969/ j.issn.0488-5368.2011.04.013.
[25] 张海晖, 李金凤, 段玉清, 等. 板栗壳原花青素提取及其稳定性研究[J].食品科学, 2011, 32(8): 5-9.
Optimization of Microwave-Assisted Extraction of Proanthocyanidins from Rosa davurica Pall. Seeds by Response Surface Methodology
RONG Chenxi1, ZHANG Xiuling1,*, LI Tiezhu2, HU Jimei3, ZHANG Jie2, LI Zhuolin2
(1. School of Food Science, Northeast Agricultural University, Harbin 150030, China; 2. Jilin Academy of Agricultural Sciences,Changchun 130033, China; 3. China International Engineering Consulting Corporation, Beijing 100048, China)
The microwave-assisted extraction of proanthocyanidins (PC) from Rosa davnrica Pall. seeds was optimized using the response surface methodology. The PC content of Rosa davnrica Pall. seeds was determined to be (1.55 ± 0.12) g/100 g by iron salt catalysis method. The results of one-factor-at-a-time experiments showed that the addition of 0.2% sodium hexametaphosphate (SH) provided the best stability for the proanthocyanidins. Extraction time, solid to liquid ratio,microwave power, and ethanol concentration were selected as independent variables, while the extraction yield of PC was taken as response variable. The optimization was carried out based on Box-Behnken experimental design by investigating the individual and combined effects of the four factors on the response variable. The optimum extraction conditions were determined as follows: extracting time, 70 s; material to liquid ratio, 1:20 (g/mL); microwave power, 360 W; and ethanol concentration, 60%. Under these conditions, the PC yield in one extraction cycle obtained was 72.58% with a relative error of 1.12% as compared with the model prediction of 73.46% indicating that these parameters are reliable. In first three cycles,93.19% of the measured PC were extracted.
Rosa davnrica Pall. seeds; proanthocyanidins; response surface methodology; extraction process
10.7506/spkx1002-6630-201618007
TS201.1
A
1002-6630(2016)18-0041-06
容晨曦, 张秀玲, 李铁柱, 等. 响应面试验优化微波法提取刺玫籽原花青素的工艺[J]. 食品科学, 2016, 37(18): 41-46. DOI:10.7506/spkx1002-6630-2011618007. http://www.spkx.net.cn
RONG Chenxi, ZHANG Xiuling, LI Tiezhu, et al. Optimization of microwave-assisted extraction of proanthocyanidins from Rosa davurica Pall. seeds by response surface methodology[J]. Food Science, 2016, 37(18): 41-46. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618007. http://www.spkx.net.cn
2015-12-04
吉林省科学技术厅重点科技攻关项目(20140204051YY)
容晨曦(1989—),女,硕士,研究方向为农产品加工与贮藏工程。E-mail:rongchenxi@126.com
张秀玲(1968—),女,教授,博士,研究方向为农产品贮藏加工。E-mail:1457945201@qq.com
