盐藻中叶绿素的提取方法比较及条件优化
2016-10-18杨代宇穆富香白飞妮杨海波
杨代宇,穆富香,白飞妮,于 媛,杨海波
(大连大学环境与化学工程学院,辽宁大连 116622)
盐藻中叶绿素的提取方法比较及条件优化
杨代宇,穆富香,白飞妮,于 媛,杨海波*
(大连大学环境与化学工程学院,辽宁大连 116622)
[目的]确定有效提取盐藻中叶绿素的提取方法并优化提取条件。[方法]在单因素考察乙醇提取盐藻叶绿素优化条件的基础上,通过正交试验确定乙醇提取盐藻叶绿素的最优条件。[结果]乙醇提取盐藻中叶绿素的最优条件为85%乙醇、提取时间12 min、提取温度40 ℃,总叶绿素的最高提取率为10.80 mg/g湿重,比丙酮提取盐藻中的叶绿素提高了15.5%。[结论]以乙醇为提取剂可从盐藻中提取更多的叶绿素,且安全、无污染、时间短。此结果可为利用乙醇提取和测定海生盐藻中的叶绿素含量或工业生产提取叶绿素提供试验依据和参考。
盐藻;叶绿素;提取条件;优化
盐藻(Dunaliella salina)是一类极端耐盐的单细胞真核绿藻,藻体无细胞壁,体型变化大,体内有一杯状色素体。由于富含独特而丰富的生命元素,被世界科学界誉为“细胞的动力源”、“生命的保护剂”。因此,盐藻不仅用作鱼、虾、贝等幼体的饵料,而且在食品、医药、基因工程、液体燃料等领域广泛应用,具有很好的开发前景[1]。
叶绿素是植物进行光合作用的主要色素,常用来快速估算种群生物量和浮游植物的增殖能力[2-3]。此外,叶绿素具有造血、提供维生素、解毒和抗病作用,在医疗、保健和食品行业广泛应用[4]。因此,最大限度地提取叶绿素对准确估算浮游植物的增殖能力或生产叶绿素产品均具有重要的现实意义。《水和废水监测分析方法》(第4版增补版)[5]中先研磨破碎细胞壁后再用丙酮提取叶绿素,在研磨过程中叶绿素容易发生光降解,从而导致结果偏低,且提取过程繁琐,人为误差较大。此外,提取过程中破碎细胞液与丙酮长时间接触,不利于操作人员的健康。张红等[6]比较了丙酮萃取法和乙醇-超声波法测定水体中叶绿素a的含量,发现乙醇-超声波法的萃取效率显著高于丙酮法。黄昌妙等[7]研究了不同过滤膜和不同提取剂对浮游植物叶绿素a测定结果的影响,发现使用不同滤膜对叶绿素a测定结果基本无影响;丙酮研磨法损耗率高,误差较大,而丙酮浸提法的结果明显高于其他3种方法。卢俊等[8]研究了盐藻细胞的破碎方法、丙酮及盐酸体积分数等对脱镁叶绿素含量的影响,发现盐酸体积分数对盐藻中脱镁叶绿素含量的影响最大。笔者参照目前已有的叶绿素提取方法,在比较丙酮和乙醇提取盐藻中叶绿素的效果的基础上,通过单因素试验和正交试验确定从盐藻提取叶绿素的优化条件,以最大限度地提取盐藻细胞内的叶绿素,促进盐藻资源的综合利用与开发。
1 材料与方法
1.1仪器和试剂
1.1.1仪器与耗材。试验仪器有EL204电子天平、80-2离心沉淀机、LD5-24台式离心机、UV-5200型紫外可见分光光度计、HH-S恒温水浴锅等。试验耗材有锥形瓶(5 L)等。
1.1.2试剂。无水丙酮和无水乙醇均为市售分析纯。
1.2试验方法
1.2.1盐藻培养及藻泥样品处理。取10个5 L锥形瓶,加入2 500 mL灭菌海水和500 mL处于对数生长期的盐藻藻液,再按1‰的比例加入3 mL的康威方营养液[9],在温度为25 ℃、光照强度为1 800 lx、光照周期为12 h∶12 h的环境条件下培养至对数生长期末期(7 d),转速3 000 r/min,离心盐藻培养液3 min,弃上层清液,藻泥用去离子水清洗3次后,冻融3次,备用。培养过程中,每天摇瓶2次,以促进瓶内培养液混合均匀和内部物质的交换。试验重复3次。
1.2.2丙酮和乙醇的提取效果比较。将离心冻融后的盐藻藻泥定量后分成4组,分别按0.15、0.20、0.26、0.38 g/mL的料液比加入不同体积的95%丙酮和95%乙醇溶液,充分混匀后置于冰箱冷藏12 h,然后置于离心机中转速3 200 r/min离心3 min,得到上清液。试验重复3次。将用丙酮提取的上清液用分光光度计于波长663、646和470 nm处测定吸光值。将用乙醇提取的上清液使用分光光度计于波长665、649和470 nm 处测定吸光值。参照王英典[10]的方法计算叶绿素浓度,其中丙酮提取叶绿素的计算公式为(1)~(3),乙醇提取叶绿素的计算公式为(4)~(6)。
Ca=12.21A665-2.81A646
(1)
Cb=20.13A646-5.03A663
(2)
Cc=(1 000A470-3.27Ca-104Cb)/229
(3)
(4)
(5)
(6)
式中,Ca、Cb、Cc分别为丙酮提取叶绿素a、叶绿素b、叶绿素c的浓度(mg/L);Ca′、Cb′、Cc′分别为乙醇提取叶绿素a、叶绿素b、叶绿素c的浓度(mg/L);A470、A646、A649、A663、A665分别为470、646、649、663、665 nm处的吸光度值。
按照以下公式计算叶绿素提取率:
叶绿素提取率(mg/g)=叶绿素浓度(mg/L)×藻液体积(L)/藻泥湿重(g)
(7)
1.2.3单因素试验。影响提取剂提取微藻中叶绿素的条件有提取温度、提取时间和料液比(g/mL)[11]。在按照“1.2.2”中方法确定提取叶绿素的提取剂后,改变其中一个条件,固定另外2个条件不变,通过单因素试验确定提取叶绿素的单因素优化条件。
为方便试验操作,对料液比的考察,改为固定藻泥质量,改变提取剂浓度,取0.150 0 g藻泥加入10 mL不同浓度的乙醇溶液(以下正交设计试验方案操作时相同)。单因素考察的具体条件为:乙醇浓度选择75%、80%、85%、90%、95%,提取时间选择6、9、12、15、18、21 min,提取温度选择25、30、35、40、45、50 ℃。考察不同因素对叶绿素浓度和提取率的影响。
1.2.4正交试验。在单因素试验的基础上,选择乙醇浓度(A)、提取时间(B)和提取温度(C)为影响因素,进行3因素3水平的正交试验。
2 结果与分析
2.1丙酮和乙醇提取叶绿素的比较从图1可以看出,随着料液比的增大,叶绿素的提取率先逐渐上升,此后变化趋缓,说明藻泥质量与提取剂体积有最佳的料液比。在相同的料液比下,乙醇的提取效果均比丙酮好,并且叶绿素a的提取率大于叶绿素b和叶绿素c的提取率,这与王玉芳[12]、杨彩根等[13]、徐彩平等[14]的研究结果基本相同,而翁笑艳等[15]用丙酮提取地表水浮游植物叶绿素a的含量高于乙醇提取的叶绿素含量,这可能是因为用乙醇提取时存在酸化从而导致吸收波长的偏移。这说明乙醇比丙酮更有利于提取盐藻中的叶绿素,因此进一步研究用乙醇提取叶绿素的优化条件,以最大限度地获取盐藻中的叶绿素。
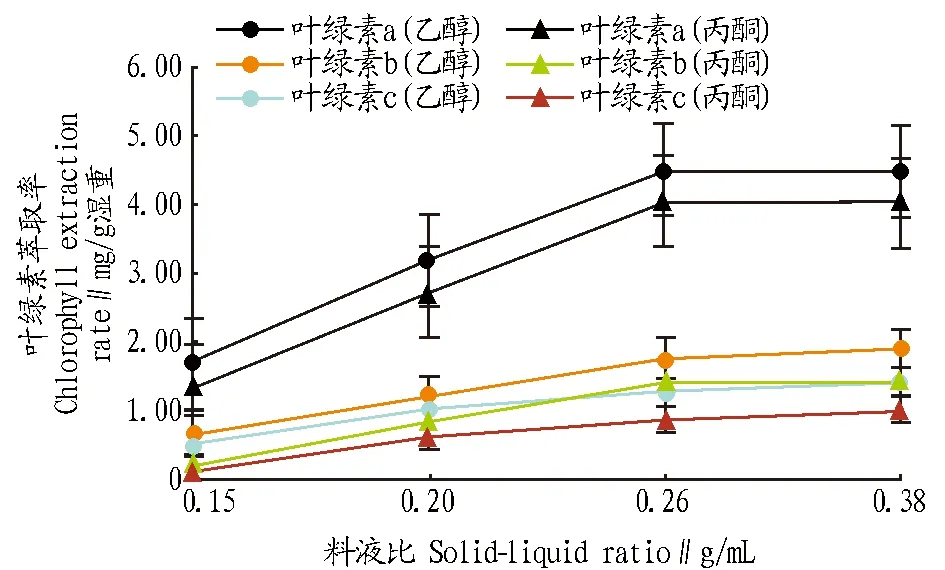
图1 乙醇和丙酮提取盐藻中叶绿素的效果比较Fig.1 Comparison of extracting chlorophyll from Dunaliella salina by ethanol and acetone
2.2单因素试验
2.2.1乙醇浓度。萃取时间为12 min,提取温度为35 ℃,乙醇浓度设置75%、80%、85%、90%、95%,考察不同乙醇浓度对叶绿素提取率的影响。从图2可以看出,随着乙醇浓度的上升,叶绿素a、叶绿素b和叶绿素c的提取率总体上呈先上升后下降的趋势。当乙醇浓度为85%时,叶绿素a、叶绿素b、叶绿素c的萃取率均达到最大值。因此,选择85%作为乙醇浓度,此时总叶绿素的最大提取率为9.66 mg/g湿重。

图2 不同乙醇浓度对叶绿素提取率的影响Fig.2 Effects of ethanol concentration on extraction rate of chlorophyll
2.2.2提取时间。乙醇浓度为85%,提取温度为35 ℃,提取时间设置为6、9、12、15、18和21 min,考察不同提取时间对叶绿素提取率的影响。从图3可以看出,随提取时间的延长,叶绿素a、b萃取率总体上呈先上升后下降的趋势。当提取时间为12 min时,叶绿素a、叶绿素b的萃取率均达到最大值;叶绿素c萃取率的变化趋势趋于平缓。因此,选择12 min作为提取时间,此时总叶绿素的最大提取率为10.44 mg/g湿重。

图3 不同提取时间对叶绿素提取率的影响Fig.3 Effects of time on extraction rate of chlorophyll
2.2.3提取温度。乙醇浓度为85%,提取时间为12 min,提取温度设置为25、30、35、40、45、50 ℃,考察不同温度对叶绿素提取率的影响。从图4可以看出,提取温度对叶绿素a和叶绿素b的影响较大。当提取温度为40 ℃时,叶绿素a、叶绿素b的提取率达到最大值;叶绿素c的萃取率受温度的影响很小。因此,选择40 ℃作为萃取温度,此时总叶绿素的最大提取率为8.16 mg/g湿重。
2.3正交试验结果以叶绿素提取率为指标,用乙醇提取叶绿素通过正交试验探讨叶绿素提取的优化条件。正交试验结果如表1所示。从表1可以看出,各因素对提取叶绿素a和b的影响的主次顺序依次为提取温度、乙醇浓度、提取时间。提取温度的影响最大,乙醇浓度次之,提取时间的影响最小。各因素对提取叶绿素c影响的主次顺序依次为乙醇浓度、提取时间、提取温度。乙醇浓度的影响最大,提取时间次之,提取温度的影响最小。由于叶绿素c的含量明显小于叶绿素a和叶绿素b的含量,因此可忽略3因素对叶绿素c的影响。
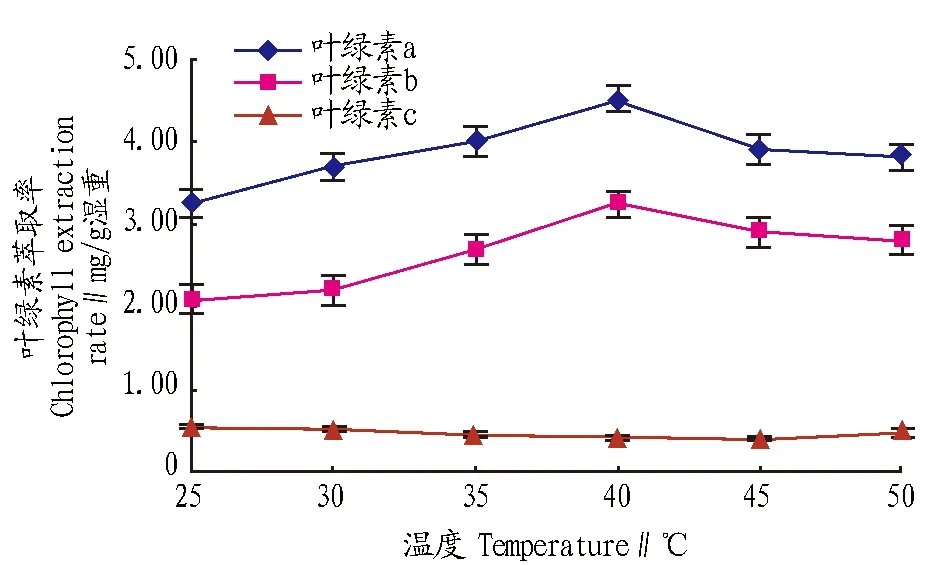
图4 不同提取温度对叶绿素提取率的影响Fig.4 Effects of temperature on extraction rate of chlorophyll

试验号TestNo.乙醇浓度(A)Ethanolconcentration∥%提取时间(B)Extractiontime∥min提取温度(C)Extractiontemperature∥℃叶绿素a含量Chlorophyllacontent∥mg/g叶绿素b含量Chlorophyllbcontent∥mg/g叶绿素c含量Chlorophyllccontent∥mg/g1809403.61413.10100.903728012304.24333.39351.186838015504.19033.42311.03194859304.83403.87171.420858512405.10944.03361.659768515504.09933.29471.15687909503.28432.73980.783789012403.52823.06290.835399015302.93852.35890.6040叶绿素ak14.01593.91084.0053Chlorophyllak24.68094.29364.0839k33.25033.74273.8580R1.43060.55090.2259叶绿素bk13.30593.23753.2080Chlorophyllbk23.73333.49673.3992k32.72053.02563.1525R1.01280.47110.2466叶绿素ck11.04080.93601.0705Chlorophyllck21.41241.23391.1329k30.74430.94090.9908R0.66810.29790.1421
因此,确定提取叶绿素的最优条件为:提取浓度为85%、提取时间为12 min、提取温度为40 ℃,总叶绿素的最大提取率为10.80 mg/g湿重,此结果与单因素试验确定的优化条件及其提取率相一致,增加了优化条件的可信度。杨洪芳等[16]用乙醇-超声法萃取小球藻叶绿素a的含量,确定的优化条件为:乙醇浓度95%、温度53 ℃、提取时间10 min。该试验确定的优化条件中萃取时间与其接近,而乙醇浓度和温度均低于杨洪芳等[16]的研究结果。这可能与提取对象和细胞破碎方式有关。
3 结论与讨论
该试验结果表明,用乙醇提取盐藻中的叶绿素比用丙酮提取叶绿素的效果更好。这与王玉芳等[12]的试验结果相一致。
丙酮毒性较大,易挥发,易燃烧,为防止丙酮挥发和叶绿素遇光分解,需在低温暗处提取较长时间(12~24 h),长期试验对操作者会造成严重伤害。此外,丙酮需要回收处理,这些不利条件导致利用丙酮提取叶绿素的成本较高。
该试验中采用冻融法破碎细胞,避免了研磨法[6]破碎过程中因研磨不充分导致细胞不能完全破碎、转移过程中样品损失的缺点。有机溶剂提取色素的能力与藻细胞的亲水性和渗透性有关。盐藻细胞无细胞壁,经冻融后易破碎,同时乙醇的化学极性大于丙酮,使得乙醇分子能与细胞内的叶绿素分子快速结合,从而在短时间内获得了较高的提取率,减
少了叶绿素的分解。
该试验确定的利用乙醇提取叶绿素的优化条件能够在短时间内完成叶绿素的提取,具有简便、经济、快速、重现性好等优点,不仅可以提高盐藻的综合利用价值,而且可为其他海洋微藻中叶绿素的提取提供参考。
[1]盐藻[EB/OL].[2016-05-04].http://baike.so.com/doc/5400776-5638377.html.
[2]杨彩根,宋学宏,孙丙耀.浮游植物叶绿素 a 含量简易测定方法的比较[J].海洋科学,2007,37(1):6-9.
[3]NUSCH E A.Comparison of different methods for chlorophyll and phaeopigments determination[J].Arch Hydrobiol Beih Ergebn Limnol,1980,14:14-36.
[4]叶绿素[EB/OL][2016-05-04].0http://baike.so.com/doc/2870698-3029319.html.
[5]国家环境保护总局.水和废水监测分析方法(增补版)[M].4版.北京:中国环境科学出版社,2009:670-671.
[6]张红,吕富,吕林兰,等.浮游植物叶绿素 a 含量测定方法的比较及优化[J].海洋科学,2012,36(10):1-4.
[7]黄昌妙,叶树才,王潮.浮游植物叶绿素a测定方法的比较分析[J].福建分析测试,2013,22(4):23-27
[8]卢俊,卢庆华,张冬艳,等.盐藻中测定脱镁叶绿素含量的影响因素研究[J].食品工业,2015,36(10):5-7
[9]王友利.氮磷交互作用对两种海洋微藻生长及细胞组分的影响[D].大连:大连大学,2015:13-14.
[10]王英典,刘宁.植物生物学指导[M].北京:高等教育出版社,2001.
[11]张丽彬,王启山,徐新惠,等.乙醇法测定浮游植物叶绿素a 含量的讨论[J].中国环境监测,2008,24(6):9-10.
[12]王玉芳,杨士斌,刘得银,等.浮游植物叶绿素a 含量不同方法测定比较[J].水文,2014,34(5):58-60.
[13]杨彩根,宋学宏,孙丙耀.浮游植物叶绿素a含量简易测定方法的比较[J].海洋科学,2007,31(1):6-9.
[14]徐彩平,刘霞,陈宇炜.浮游植物叶绿素a 浓度测定方法的比较研究[J].生态与农村环境学报,2013,29(4):438-442.
[15]翁笑艳,林美爱,严颖.地表水浮游植物叶绿素a测定方法比较研究[J].中国环境监测,2009,25(3):37-38.
[16]杨洪芳,丁峰元,陈德辉.乙醇-超声法在浮游植物叶绿素a含量测定中的应用[J].海洋渔业,2006,28(4):310-312.
Comparison and Optimization of the Methods for Extracting Chlorophyll from Dunaliella salina
YANG Dai-yu,MU Fu-xiang,BAI Fei-ni,YANG Hai-bo*et al
(Department of Environmental and Chemical Engineering,Dalian University,Dalian,Liaoning 116622)
[Objective]To determine the effective method and optimal conditions for extracting chlorophyll from Dunaliella salina.[Method]On the basis of the single factor investigation of optimal conditions for extracting chlorophyll from D.salina by ethanol,the whole optimal conditions were obtained by means of orthogonal design.[Result]The optimized conditions were 85% ethanol,12 min extraction time and 40 ℃ extraction temperature.The maximum extraction rate was 10.80 mg/g wet weight by ethanol,and it was 15.5% higher than that by acetone extract.[Conclusion]More chlorophyll could be extracted from D.salina by ethanol,and ethanol extraction was safe,non-polluting and less time consuming.This result will provide experimental basis and technology reference for using ethanol to extract and determine chlorophyll content or producing chlorophyll from marine D.salina in industrial manufacture.
Dunaliella salina;Chlorophyll;Extraction conditions;Optimization
2016年辽宁省大学生创新训练项目(201611258000010);2015年大连大学大学生创新创业训练计划项目(2015007)。
杨代宇(1993- ),男,贵州兴义人,本科生,专业:化学工程。*通讯作者,教授,博士,硕士生导师,从事海洋生物能源研究。
2016-07-12
S 985.4
A
0517-6611(2016)25-007-03
