吉西他滨联合顺铂与紫杉醇联合顺铂方案治疗晚期肺鳞癌的临床疗效及不良反应观察
2016-10-18穆晓攀杜晓明张泽群李芃
穆晓攀 杜晓明 张泽群 李芃
北京市结核病胸部肿瘤研究所首都医科大学附属北京胸科医院药剂科,北京 101149
吉西他滨联合顺铂与紫杉醇联合顺铂方案治疗晚期肺鳞癌的临床疗效及不良反应观察
穆晓攀#杜晓明张泽群李芃
北京市结核病胸部肿瘤研究所首都医科大学附属北京胸科医院药剂科,北京101149
目的探讨吉西他滨联合顺铂(GP)与紫杉醇联合顺铂(TP)方案治疗晚期肺鳞癌的疗效及不良反应。方法选取晚期肺鳞癌患者91例,其中接受GP方案治疗患者47例(GP组),TP方案治疗患者44例(TP组),评价两组患者临床疗效及不良反应。结果治疗2个周期后,GP组近期有效率为40.43%,高于TP组的20.45%,两组比较差异有统计学意义(P<0.05);GP组疾病控制率为85.11%,虽高于TP组的77.27%,但差异无统计学意义(P>0.05);GP组和TP组患者中位生存时间为9个月和8个月,1年生存率分别为28.00%和24.00%,2年生存率分别为12.50%和12.00%,两组比较差异无统计学意义(P>0.05);两组患者于第1次和第3次化疗前CEA、CA125和CA50比较差异无统计学意义(P>0.05),第3次化疗前CEA、CA125和CA50均较第1次化疗前有所降低(P<0.05);两组患者主要不良反应为骨髓抑制、肝肾功能异常、脱发等,且近期不良反应严重程度相似,其中TP组脱发的严重程度高于GP组,差异有统计学意义(P<0.01)。结论GP与TP方案治疗晚期肺鳞癌均有较好的临床疗效,且化疗不良反应相似,均可耐受。
肺鳞癌;GP方案;TP方案;临床疗效;不良反应
Oncol Prog,2016,14(4)
肺鳞癌也被称为肺鳞状上皮细胞癌,是肺癌的一种类型,由于其早期诊断较困难,故大部分患者出现临床症状时已属于晚期,因而失去了手术治疗的机会,该病治疗以化疗、分子靶向治疗、生物治疗与放疗为主[1]。紫杉醇联合顺铂(TP)方案是临床治疗晚期肺鳞癌的主要方法,紫杉醇为细胞毒类化合物,属于抗微管药物,联合铂类金属化合物,能够有效抑制肿瘤细胞有丝分裂,从而导致肿瘤细胞死亡。应用吉西他滨联合顺铂(GP)方案治疗能够抑制癌细胞DNA复制,损伤细胞膜结构,控制病情,缓解临床症状。关于采取以上两种化疗方案治疗的相关疗效对比的报道较少[2]。本研究对肿瘤科收治的91例晚期肺鳞癌患者分别采用GP方案与TP方案治疗,对比分析两种方案治疗的临床疗效及不良反应,从而为临床选择最佳治疗方案提供帮助。
1 资料与方法
1.1一般资料
选取2012年1月至2014年12月在北京市结核病胸部肿瘤研究所治疗的晚期肺鳞癌患者91例,接受GP方案治疗患者47例(GP组),TP方案治疗患者44例(TP组)。纳入标准:①均经细胞学或组织学确诊的ⅢB~Ⅳ期肺鳞癌;②接受GP或TP治疗;③入院前未接受任何抗肿瘤治疗;④无化疗禁忌证;⑤经患者及家属知情同意并签署知情同意书。排除标准:①预计生存期≤3个月;②依从性差,不配合治疗的患者。所有患者中男性68例,女性23例,年龄43~67岁,中位年龄57岁。GP组和TP组患者年龄、性别、肿瘤分期等临床特征比较差异无统计学意义(P>0.05),具有可比性。(表1)
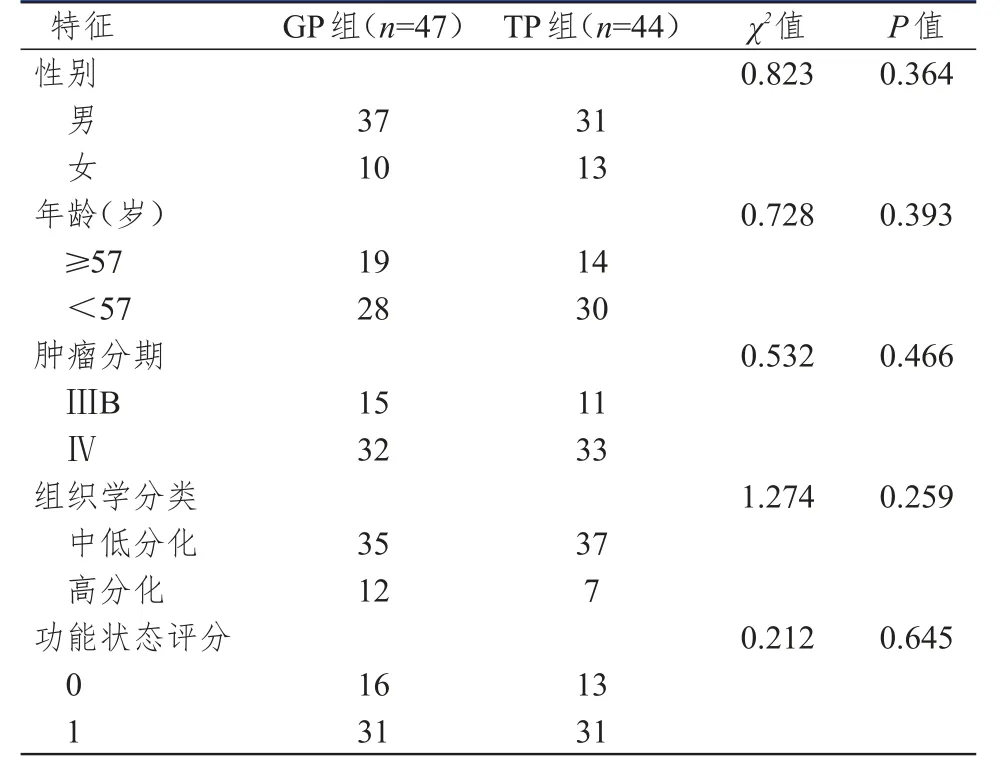
表1 两组患者临床特征比较
1.2治疗方法
GP组47例患者采用GP治疗方案,将剂量为25 mg/m2的顺铂溶入500 ml 0.9%氯化钠注射液中静脉滴注;将30 mg/m2剂量的吉西他滨溶入250 ml 5%葡萄糖注射液中静脉滴注。
TP组44例患者采用TP治疗方案,将30 mg紫杉醇注射液溶入500 ml 0.9%氯化钠注射液中静脉滴注。顺铂药物剂量、用法与GP组患者一致。
1.3评价标准
参照RECIST 1.1版标准[3],将治疗2个周期的疗效分为:完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD),有效率=(CR+PR)例数/总例数×100%,疾病控制率=(CR+PR+SD)例数/总例数×100%。不良反应参照1998年WHO抗癌药物急性或亚急性不良反应评价标准,分为0~Ⅳ级。生存时间指从化疗开始到死亡的时间。分别检测患者第1次和第3次化疗前CEA、CA125和CA50等肿瘤标志物水平。随访截止时间为2016年4月。
1.4统计学方法
采用SPSS19.0统计软件进行数据分析,计数资料采用频数或百分比(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法计算患者生存率,生存情况比较采用log-rank检验;计量资料采用均数±标准差(±s)表示,使用t检验;等级资料比较采用Mann-Whitney U检验。以P<0.05为差异具有统计学意义。
2 结果
2.1两组患者近期疗效比较
GP组治疗有效率为40.43%,高于TP组的20.45%,差异有统计学意义(χ2=4.255,P=0.039);GP组疾病控制率为85.11%,虽高于TP组的77.27%,但差异无统计学意义(χ2=0.918,P>0.05)。(表2)

表2 两组患者近期疗效[n(%)]
2.2两组患者生存时间比较
GP组和TP组患者中位生存时间为9个月和8个月,1年生存率分别为28.00%和24.00%,2年生存率分别为12.50%和12.00%,两组生存情况比较差异无统计学意义(χ2=0.081,P>0.05)。(图1)
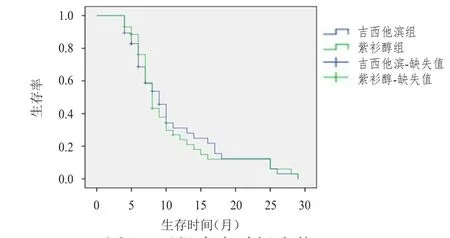
图1 两组生存时间比较
2.3两组患者肿瘤标志物水平变化情况比较
两组患者于第1次和第3次化疗前CEA、CA125和CA50比较差异均无统计学意义(P>0.05),但GP组和TP组于第3次化疗前CEA、CA125和CA50均较第1次化疗前有所降低,差异比较具有统计学意义(t=5.243、12.292、15.852,7.139、13.149、15.752,P<0.05)。(表3)
表3 两组患者肿瘤标志物水平变化情况(±s)

表3 两组患者肿瘤标志物水平变化情况(±s)
组别CEA CA125 CA50时间第1次化疗前第3次化疗前第1次化疗前第3次化疗前第1次化疗前第3次化疗前GP组(n=47)22.01±13.01 11.72±3.43 91.75±21.33 42.27±17.51 78.81±21.22 24.53±10.04 TP组(n=44)22.56±8.94 12.01±4.02 89.94±20.51 41.30±13.47 80.91±18.21 23.11±16.15
2.4两组患者不良反应比较
两组患者主要不良反应为骨髓抑制、肝肾功能异常、脱发等。两组近期不良反应严重程度相似,其中骨髓抑制、肝肾功能异常、恶心呕吐不良反应比较差异无统计学意义(P>0.05);但TP组脱发的严重程度高于GP组,两组比较差异有统计学意义(P<0.01),详见表4。

表4 两组患者不良反应情况比较
3 讨论
肺鳞癌是威胁人类生命健康的恶性肿瘤之一,具有较高的发病率与死亡率,其发病率约占肺癌的30%,以发热、咳嗽、痰中带血、胸痛为主要临床症状,对患者的生活质量造成严重影响[4]。肺鳞癌常病发于50岁左右的中老年人,其中80%患者出现严重临床症状时已处于晚期,因而失去了手术治疗的最佳时期,故化疗成为重要治疗措施[5]。顺铂是化疗常用药物,属于铂类金属化合物,可以快速与DNA结合形成交叉键,控制DNA复制,缓解临床症状,但单独使用该药物治疗肺鳞癌的有效率仅为20%~40%,不利于患者远期疗效[6-7]。因此,临床常在顺铂治疗基础上联合吉西他滨或紫杉醇药物治疗,但GP与TP两种方案的临床疗效尚未明确。
紫杉醇是一种抗微管药物,为短叶紫杉或红豆杉树皮中的提取物,属于细胞毒类化合物,其作用为通过诱导促肺癌细胞中微管形成,组织微管正常生理聚集,破坏癌细胞有丝分裂,抑制微管网的正常重组,阻断癌细胞增殖,从而诱导肿瘤细胞凋亡[8-9]。临床研究指出[10-11],紫杉醇化学结构为二萜类化合物,由含氧四环的紫杉烷环与脂侧链组成,难溶于水,进入患者机体后会出现不同程度的过敏反应,从而诱发不良反应。而紫杉醇联合顺铂治疗具有增效及协同作用,并可克服患者的耐药性,延长生存时间。
吉西他滨是一种新型的抗代谢药物,属于人工合成嘧啶类核苷类似物,进入机体后会经过代谢转化为二磷酸、三磷酸核苷,控制核苷酸还原酶活性,切断其对DNA供应,促进DNA细胞凋亡[12-13]。吉西他滨是一种细胞周期性抑制药物,联合顺铂治疗主要作用于DNA合成期即S期细胞,能够有效抑制G1期向S期发展,抑制细胞DNA复制及新血管增生,从而控制肺鳞癌肿瘤增生[14-15]。本研究中GP组患者的疾病控制率、中位生存时间均高于TP组患者,但两组患者的生存情况比较差异无统计学意义(P>0.05),这说明顺铂联合吉西他滨或紫杉醇治疗具有良好的协同作用,并能够有效阻断肿瘤细胞的有丝分裂,加强对DNA合成期的杀灭作用,延长患者生存时间。本研究发现,GP组患者接受治疗后的近期有效率高于TP组患者,且差异具有统计学意义(P<0.05),这表明吉西他滨联合顺铂治疗能够增强化疗作用,有效阻止癌细胞的分裂和增殖,减少肿瘤复发,增强癌细胞杀伤敏感性,提高治疗效果。本研究还发现,GP组和TP组患者第3次化疗前CEA、CA125和CA50均较第1次化疗前有所降低,差异具有统计学意义(P<0.05);两组主要的不良反应为骨髓抑制、肝肾功能异常、脱发等,其中TP组脱发的严重程度高于GP组,差异具有统计学意义(P<0.01)。以上亦表明晚期肺鳞癌患者应用GP与TP方案治疗的临床疗效相似,均能够改善患者机体肿瘤标志物水平,抑制DNA复制与纺锤体的有丝分裂,使细胞停滞于G2/M期,从而促进细胞凋亡,且化疗产生的不良反应均可耐受。
[1]姜莹.肺鳞癌的分子靶向治疗研究现状及进展[J].山东医药,2015,3(44):104-107.
[2]田涛,杨禹娟,阮之平,等.紫杉醇脂质体联合卡铂对比吉西他滨联合卡铂一线治疗老年晚期肺鳞癌的疗效观察[J].陕西医学杂志,2015,4(6):740-741.
[3]李倩,袁冬梅,孙文逵,等.表皮生长因子受体-酪氨酸激酶抑制剂在肺鳞癌中的应用[J].中华医学杂志,2014,94(46):3685-3687.
[4]张丹,杨光,张曙光.吉非替尼对肺鳞癌患者免疫功能的影响及其近期临床疗效[J].安徽医药,2015,4(7):1367-1370.
[5]王武明,刘玉珍,刘翼军,等.中央型肺鳞癌沿支气管壁侵犯的临床与病理研究[J].中华临床医师杂志:电子版,2015,7(4):147-149.
[6]马克威,李恩喜,郭晔,等.核糖核苷酸还原酶M1表达与非小细胞肺癌术后吉西他滨联合顺铂辅助化疗患者预后的关系[J].中华肿瘤杂志,2014,36(7):505-510.
[7]杜军华,尹宜发.吉西他滨或多西他赛联合顺铂治疗晚期非小细胞肺癌的近远期疗效观察[J].河北医药,2014,8(11):1671-1672.
[8]冯艳杰.多西他赛对比吉西他滨联合顺铂方案治疗非小细胞肺癌临床疗效探讨[J].海峡药学,2015,9(2):169-170.
[9]敬秀清.多西紫杉醇联合顺铂辅助化疗治疗非小细胞肺癌的临床效果[J].山西医科大学学报,2014,45(8):740-742.
[10]李小峰,张亚华.顺铂联合吉西他滨与联合紫杉醇治疗晚期非小细胞肺癌疗效分析[J].现代肿瘤医学,2014,2(5):1087-1089.
[11]王婧雅,龙锐,王红梅,等.紫杉醇联合奥沙利铂对比紫杉醇联合顺铂治疗中晚期非小细胞肺癌疗效和安全性评价的Meta分析[J].重庆医科大学学报,2014,3(6): 870-877.
[12]孙银萍,王福立,田玮,等.紫杉醇脂质体联合顺铂对比紫杉醇联合顺铂治疗晚期非小细胞肺癌的临床观察[J].泰山医学院学报,2015,36(8):871-874.
[13]曹军,何阳,刘洪强,等.吉西他滨联合顺铂不同给药途径对人肺癌A549细胞的抑制作用[J].天津医药,2014,4(12):1180-1182.
[14]崔洪霞,李玉权,马丽霞,等.吉西他滨联合顺铂与紫杉醇联合顺铂方案一线治疗晚期肺鳞癌临床比较[J].中国老年学杂志,2015,7(20):5811-5813.
[15]沈凡,李会萍.吉西他滨联合顺铂治疗晚期非小细胞肺癌临床观察[J].中华肿瘤防治杂志,2015,7(11):100-101.
Clinical efficacy and adverse reaction of GP and TP regimen in the treatment of advanced lung squamous cell carcinoma
MU Xiao-pan#DU Xiao-ming ZHANG Ze-qun Li Peng
Beijing Tuberculosis and Thoracic Tumor Research Institute,Department of Pharmacy,Beijing Chest Hospital of Capital Medical University,Beijing 101149,China
ObjectiveTo investigate the efficacy of gemcitabine plus cisplatin(GP)and paclitaxel plus cisplatin(TP)in the treatment of advanced lung squamous cell carcinoma.Method91 cases of advanced lung squamous cell carcinoma were enrolled in this study,in which 47 patients were given GP regimen(GP group),and 44 patients were administered with TP regimen(TP group),and the clinical efficacy and adverse reactions of the two groups were compared.ResultAfter two cycles of treatment,the short-term response rate of GP group was 40.43%,which was significantly higher than that of TP group at 20.45%(P<0.05);the disease control rate was statistically similar between GP group at 85.11% and TP group at 77.27%(P>0.05);as for survival in GP the TP group,the median survival time were 9 months and 8 months,the 1 year survival rates were 28.00%and 24.00%,the 2 year survival rates were 12.50%and 12.00%,all were similar between the two groups(P>0.05);the CEA,CA125 and CA50 levels were comparable in both groups before the first and third chemotherapy(P>0.05),while those measures before third chemotherapy were decreased as compared with that before first chemotherapy(P<0.05);the major adverse reactions were myelosuppression,liver and kidney dysfunction,and alopecia,etc,and the recent adverse reactions were similar in severity,except the severity of alopecia which was significantly higher in TP group(P<0.01).ConclusionGP and TP regimen were both effective in the treatment of advanced lung squamous cell carcinoma,with similar yet tolerable adverse reactions.
lung squamous cell carcinoma;GP;TP;clinical efficacy;adverse reaction
R734.2
A
10.11877/j.issn.1672-1535.2016.14.04.27
2016-04-24)
(corresponding author),邮箱:mulovedu520@sina.com
