外周血T淋巴细胞亚群检测在胃癌病情监测及预后评价中的意义
2016-10-18王展梅曹芳丽曲琳莉王欢
王展梅 曹芳丽 曲琳莉 王欢
山东大学齐鲁医院(青岛)化疗科,山东 青岛 266000
外周血T淋巴细胞亚群检测在胃癌病情监测及预后评价中的意义
王展梅曹芳丽曲琳莉#王欢
山东大学齐鲁医院(青岛)化疗科,山东青岛266000
目的探讨外周血T淋巴细胞亚群检测在胃癌病情监测及预后评价中的价值。方法选择100例胃癌患者作为胃癌组,患者采用mFOLFOX6方案,2周为1个疗程,每位患者化疗4个疗程以上。另选择同期在医院体检的健康人群80例作为对照组,采用流式细胞仪技术检测两组外周血T淋巴细胞亚群水平。结果化疗前胃癌组外周血CD3+、CD4+、CD4+/CD8+显著低于对照组,CD8+显著高于对照组,差异有统计学意义(P<0.01)。Ⅰ~Ⅱ期胃癌患者外周血CD3+、CD4+、CD4+/CD8+显著高于Ⅲ~Ⅳ期,CD8+显著低于Ⅲ~Ⅳ期,差异有统计学意义(P<0.01)。不同疗效的胃癌患者化疗前外周血T淋巴细胞亚群水平比较差异无统计学意义(P>0.05),化疗后CR+ PR组、SD组、PD组外周血CD3+、CD4+、CD4+/CD8+显著降低,CD8+显著上升,差异有统计学意义(P<0.01),且CR+ PR组外周血CD3+、CD4+、CD4+/CD8+显著高于SD组和PD组,CD8+显著低于SD组和PD组,差异有统计学意义(P<0.01)。结论通过检测血清外周血T淋巴细胞亚群水平能够有助于评估胃癌的病情和预后。
T淋巴细胞;胃癌;临床分期;预后
Oncol Prog,2016,14(4)
胃癌是临床上常见的消化系统肿瘤[1],化疗是治疗胃癌的主要手段之一。然而临床上依然存在部分患者对化疗不敏感或疗效不佳,若能在此时及时调整治疗方案对临床治疗具有重要的指导意义。目前用于评价胃癌临床疗效及预后的指标较多,包括癌胚抗原、糖类抗原等血清生物标志物,但是这些指标均存在敏感性不高等缺点[2-3],限制了其临床应用。目前研究证实胃癌的发生、发展与免疫功能密切相关,当机体免疫功能失调可以在一定程度上预测肿瘤的预后及进展。国外研究显示,宿主对肿瘤组织存在自然抵抗作用,机体的免疫应答能够部分清除肿瘤细胞;其中由T淋巴细胞所介导的细胞免疫在抗肿瘤方面发挥着重要作用[4]。鉴于此,本研究对拟行化疗的胃癌患者化疗前后外周血T淋巴细胞亚群水平进行检测,评估外周血T淋巴细胞亚群在胃癌的疗效、预后评价中的价值,现将研究结果报道如下。
1 资料与方法
1.1一般资料
选择2011年3月至2013年5月医院收治的100例胃癌患者作为胃癌组,男57例,女43例,年龄27~82岁,平均(59.3±7.5)岁;按照国际抗癌联盟肿瘤TNM分期[5]:Ⅰ~Ⅱ期38例,Ⅲ~Ⅳ期62例。纳入标准:①经病理学证实为原发性胃癌初治患者;②患者拟行新辅助化疗,对于有手术指征者,待4个疗程化疗结束后再择期行手术切除;③化疗前卡氏评分≥60分,预计生存期≥3个月;④告知患者及家属治疗目的、方案及不良反应,经患者同意并签署知情同意书。排除标准:①合并代谢性疾病或自身免疫性疾病者;②患者入组前1个月内使用免疫抑制剂者;③肝、肾功能严重衰竭或其他重要脏器疾病者;④合并全身严重感染或治疗中途自愿放弃治疗者。另选择同期在医院体检的健康人群80名作为对照组,纳入标准:①体格检查正常;②告知受试者研究目的,并取得受试者知情同意。排除标准:①凝血功能异常,长期服用糖皮质激素或免疫抑制剂;②肝肾功能损害或其他脏器疾病。对照组男43名,女37名,年龄22~85岁,平均(60.1±8.3)岁。胃癌组与对照组性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1治疗方法胃癌组采用mFOLFOX6方案:奥沙利铂85 mg/m2,d1,静脉滴注;亚叶酸钙400 mg/m2,d1,静脉滴注2 h;氟尿嘧啶400 mg/m2,d1,静脉推注,后2400 mg/m2,加入Baxter输液泵持续静脉输注46 h;每2周为1个疗程,每位患者化疗4个疗程以上。患者化疗前常规进行止吐等预处理,化疗后门诊定期检查血常规、肝肾功能。
1.2.2检查方法胃癌组分别于化疗前与化疗4个疗程后抽取肘静脉血3 ml,对照组于体检时抽取肘静脉血3 ml,置于抗凝管中;分离单个核细胞,并用PBS缓冲液将细胞悬液配制成2×105/ml;1500 r/min离心5min后再分别滴加鼠抗人CD3+、CD4+、CD8+单克隆抗体;加入1 ml PBS缓冲液混匀后于2 h内上机检测,采用贝克曼CytoFLEX流式细胞仪检测外周血CD3+、CD4+、CD8+水平。
1.3评价标准
参考实体瘤疗效评价标准RECIST1.1版[6]进行评价。完全缓解(CR):瘤体完全消失并持续4周以上;部分缓解(PR):瘤体最大单径之和减少30%以上并保持4周以上,病灶周围未发现新病灶;稳定(SD):肿瘤最大单径之和减少不超过30%或增加不超过20%并保持4周以上;疾病进展(PD):肿瘤最大单径之和增加20%以上或出现新病灶。其中客观有效率=(CR+PR)例数/总例数×100%。
1.4统计学方法
采用SPSS19.0统计-学软件进行检验,计量资料采用均数±标准差(±s)表示,治疗前后比较采用配对t检验,两组间比较采用成组t检验,多组间比较采用one-way ANOVA单因素方差分析,两两比较采用SNK-q检验,计数资料采用χ2检验,相关性分析采用Pearson检验,P<0.05为差异有统计学意义。
2 结果
2.1化疗前两组外周血T淋巴细胞亚群水平比较
化疗前胃癌组外周血CD3+、CD4+、CD4+/CD8+显著低于对照组,CD8+显著高于对照组,差异有统计学意义(P<0.01),详见表1。
表1 化疗前两组外周血T淋巴细胞亚群水平比较(±s)

表1 化疗前两组外周血T淋巴细胞亚群水平比较(±s)
组别胃癌组(n=100)对照组(n=80)t值P值CD3+(%)0.81±0.17 1.60±0.34 20.033<0.01 CD4+(%)0.52±0.12 0.88±0.23 13.525<0.01 CD8+(%)0.85±0.21 0.54±0.14 11.338<0.01 CD4+/CD8+0.63±0.21 1.58±0.52 16.658<0.01
2.2胃癌组不同临床分期外周血T淋巴细胞亚群水平比较
Ⅰ~Ⅱ期胃癌患者外周血CD3+、CD4+、CD4+/CD8+显著高于Ⅲ~Ⅳ期,CD8+显著低于Ⅲ~Ⅳ期,差异有统计学意义(P<0.01),详见表2。
表2 胃癌组不同临床分期外周血T淋巴细胞亚群水平比较(±s)

表2 胃癌组不同临床分期外周血T淋巴细胞亚群水平比较(±s)
临床分期Ⅰ~Ⅱ期(n=38)Ⅲ~Ⅳ期(n=62)t值P值CD3+(%)1.05±0.32 0.56±0.11 13.805<0.01 CD4+(%)0.69±0.22 0.48±0.10 7.906<0.01 CD8+(%)0.73±0.31 1.19±0.21 11.349<0.01 CD4+/CD8+0.98±0.21 0.46±0.10 20.369<0.01
2.3胃癌组化疗疗效
化疗4个疗程后,胃癌组CR 3例,PR 34例,SD 37例,PD 26例,客观有效率为37.0%(37/100)。
2.4胃癌组不同临床疗效外周血T淋巴细胞亚群水平比较
不同疗效的胃癌患者化疗前外周血T淋巴细胞亚群水平比较差异无统计学意义(P>0.05),化疗后CR+PR组、SD组、PD组外周血CD3+、CD4+、CD4+/CD8+显著降低,CD8+显著上升,差异有统计学意义(P<0.01);且CR+PR组外周血CD3+、CD4+、CD4+/CD8+显著高于SD组和PD组,CD8+显著低于SD组和PD组,差异有统计学意义(P<0.01),详见表3。
3 讨论
我国是胃癌的高发区域,其病死率居各类恶性肿瘤的第2位[7]。在胃癌的综合治疗中,化疗发挥着重要作用,目前已经将化疗应用于联合手术、放射治疗等。Schumacher等[8]证实对于中晚期胃癌患者,在根治性切除后联合化疗能够显著提高患者的生存期,并降低肿瘤局部复发和转移的风险。但是由于化疗的个体差异较大,且随着化疗方案的不断更新,选择敏感的化疗方案对提高患者预后具有重要意义。虽然目前临床上用于评估化疗疗效的生化指标较多,然而大多数肿瘤标志物敏感性不高,或特异性较低,当临床证实化疗效果不佳时常已是几个疗程之后,部分患者甚至因此而错过最佳的治疗时机。
表3 胃癌组不同临床疗效外周血T淋巴细胞亚群水平比较(±s)
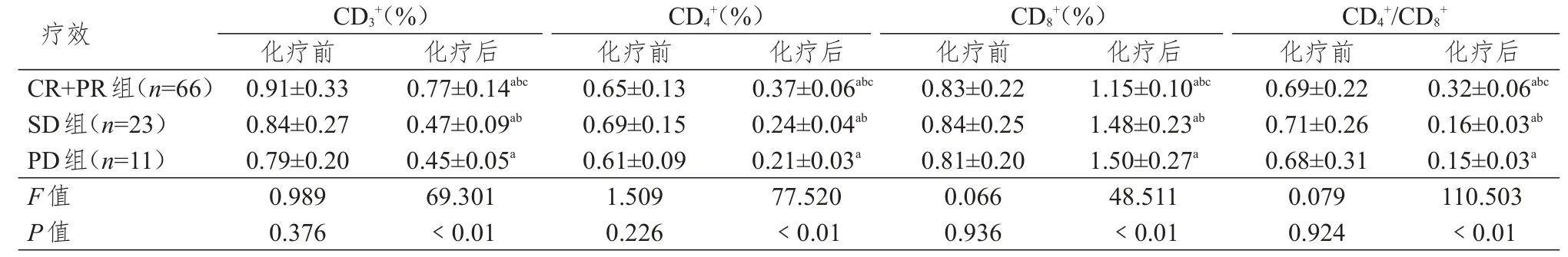
表3 胃癌组不同临床疗效外周血T淋巴细胞亚群水平比较(±s)
注:a与化疗前比较,P<0.01;b与PD组比较,P<0.01;c与SD组比较,P<0.01
疗效CR+PR组(n=66)SD组(n=23)PD组(n=11)F值P值CD3+(%)化疗前0.91±0.33 0.84±0.27 0.79±0.20 0.989 0.376化疗后0.77±0.14abc0.47±0.09ab0.45±0.05a69.301<0.01 CD4+(%)化疗前0.65±0.13 0.69±0.15 0.61±0.09 1.509 0.226化疗后0.37±0.06abc0.24±0.04ab0.21±0.03a77.520<0.01 CD8+(%)化疗前0.83±0.22 0.84±0.25 0.81±0.20 0.066 0.936化疗后1.15±0.10abc1.48±0.23ab1.50±0.27a48.511<0.01 CD4+/CD8+化疗前0.69±0.22 0.71±0.26 0.68±0.31 0.079 0.924化疗后0.32±0.06abc0.16±0.03ab0.15±0.03a110.503<0.01
目前研究已证实,肿瘤前期,机体自身免疫系统会通过特异性免疫作用将肿瘤突变细胞杀灭或清除;而恶性肿瘤的发生、发展、复发、转移均与机体免疫功能降低、肿瘤细胞从机体免疫监控中逃逸有关[9-10]。在机体众多免疫细胞中,T淋巴细胞所介导的细胞免疫在肿瘤细胞的免疫监控中起着重要作用。Aizawa等[11]报道存在浸润的肿瘤周围淋巴细胞中,CD3+、CD4+、CD8+等T淋巴细胞亚群水平出现异常,并认为T淋巴细胞在抗肿瘤免疫效应中起到主要作用。T淋巴细胞的免疫调节作用主要由CD4+、CD8+参与完成,其中CD4+能够诱导B细胞分化,并产生相应抗体;而CD8+则主要抑制B细胞抗体的合成和T淋巴细胞的增殖。正常情况下CD4+、CD8+保持平衡,共同维持机体正常的免疫应答反应;当细胞发生恶变时,CD4+、CD8+平衡被打破,导致肿瘤细胞逃脱免疫监控,进而形成恶性肿瘤。本研究中,化疗前胃癌组外周血CD3+、CD4+、CD4+/CD8+显著低于对照组,CD8+显著高于对照组,提示相比较于正常人群,胃癌患者的免疫功能显著减退,其机制可能与肿瘤在形成过程中产生大量免疫抑制因子有关。此外本研究还显示Ⅰ~Ⅱ期胃癌患者外周血CD3+、CD4+、CD4+/CD8+显著高于Ⅲ~Ⅳ期,CD8+显著低于Ⅲ~Ⅳ期,说明随着病情的不断加重,患者的免疫功能进一步降低,患者体内淋巴细胞的活化和增殖受到明显抑制,机体对突变的肿瘤细胞清除能力也受到抑制。Ubukata等[12]亦证实随着肿瘤TNM分期的升高,其免疫功能明显减退,导致对肿瘤的抑制作用也降低,最终疾病不断恶化。
在疗效评估方面,化疗后CR+PR组、SD组、PD组外周血CD3+、CD4+、CD4+/CD8+显著降低,CD8+显著上升,说明化疗药物在发挥抗肿瘤治疗的同时也会抑制机体的免疫系统,导致免疫细胞受到损伤。刘骅等[13]报道称胃癌患者化疗3周后CD3+、CD4+会显著降低,患者免疫功能受到抑制。然而本研究中化疗后CR+PR组外周血CD3+、CD4+、CD4+/CD8+依然显著高于SD组和PD组,CD8+显著低于SD组和PD组,说明不同疗效患者外周血T淋巴亚群水平依然存在差异,化疗效果越好,免疫损伤程度越低。这亦说明通过检测外周血T淋巴亚群水平能在一定程度上反映出化疗的疗效。当然本研究仅对外周血T淋巴细胞亚群水平进行初步分析,本指标的检测效能以及与其他指标联合检测能够提高其临床价值,尚需要深入研究。
综上所述,通过检测血清外周血T淋巴细胞亚群水平能够有助于监测胃癌的病情和预后,T淋巴细胞亚群检测有望成为肿瘤评估的一项简单、易操作的检查项目。
[1]Elingarami S,Liu M,Fan J,et al.Applications of nanotechnology in gastric cancer:detection and prevention by nutrition[J].J Nanosci Nanotechnol,2014,14(1):932-945.
[2]朱昱冰,葛少华,张连海,等.肿瘤标志物在胃癌患者中的诊断及预后价值[J].中华胃肠外科杂志,2012,15(2):161-164.
[3]高洪宇,薛英威,张明,等.联合检测癌胚抗原和CA19-9对Ⅳ期胃癌腹膜转移的诊断价值[J].中华胃肠外科杂志,2011,14(1):68-69.
[4]Oertli M,Noben M,Engler DB,et al.Helicobacter pylori γglutamyltranspeptidase and vacuolatingcytotoxin promote gastric persistence and immune tolerance[J].Proc Natl Acad Sci U S A,2013,110(8):3047-3052.
[5]方文涛.第7版国际抗癌联盟食管鳞癌TNM分期解读[J].上海交通大学学报(医学版),2011,31(3):265-270.
[6]Sohaib A.RECIST rules[J].Cancer Imaging,2012,12:345-346.
[7]邹小农,孙喜斌,陈万青,等.2003—2007年中国胃癌发病与死亡情况分析[J].肿瘤,2012,32(2):109-114.
[8]Schumacher MA,Donnelly JM,Engevik AC,et al.Gastric Sonic Hedgehog acts as a macrophage chemoattractant during the immune response to Helicobacter pylori[J].Gastroenterology,2012,142(5):1150-1159,e6.
[9]赵得新,朱甲明,陈云波.免疫增强型肠内营养对胃癌根治病人术后免疫功能和炎症反应的影响[J].中国实验诊断学,2011,15(3):428-430.
[10]黄彪,王琦三.早期肠内和肠外营养对胃癌病人术后免疫功能影响的系统评价[J].肠外与肠内营养,2014,21(1):35-38,42.
[11]Aizawa M,Gotohda N,Takahashi S,et al.Predictive value.
[6]杨学宁,吴一龙.实体瘤治疗疗效评价标准-RECIST[J].循证医学,2004,4(2):85-111.
[7]邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,34(4):408-415.
[8]孙益红.外科手术在晚期胃癌治疗中的价值与合理选择[J].腹部外科,2015(1):8-11.
[9]徐瑞华,滕开原.晚期胃癌化疗进展[J].癌症,2009,28(10):1108-1113.
[10]夏永欣,张萌,张向东,等.奥沙利铂联合亚叶酸钙和替加氟治疗晚期胃癌的临床疗效和安全性[J].中国临床药理学杂志,2015(11):902-904.
[11]习羽,牛建华,梁学奇,等.SP方案与FOLFOX4方案治疗晚期胃癌的效果比较[J].广东医学,2015(5):780-781.
[12]Koizumi W,Narahara H,Hara T,et al.S-1 plus Cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer(SPIRITS trial):A phaseⅢtrial[J].Lancet Oncol,2008,9(3):215-221.of baseline neutrophillymphocyte ratio for T4 disease in wall-penetrating gastric cancer[J].World J Surg,2011,35(12):2717-2122.
[12]Ubukata H,Konishi S,Nagata H,et al.Significance of preoperative evaluations of tumor necrosis factor-alpha,the granulocyte/lymphocyte ratio and their correlation with regard to outcome in gastric cancer patients[J].Dig Surg,2010,27(4):324-330.
[13]刘骅,凌伟,曹晖,等.免疫强化肠内与肠外营养对老年胃癌患者全胃切除术后营养和免疫功能的影响[J].上海交通大学学报(医学版),2011,31(7):1000-1004.
(收稿日期:2015-09-24)
Clinical significance of peripheral blood T lymphocyte subsets as prognostic markers in patients with gastric cancer
WANG Zhan-mei CAO Fang-li QU Lin-li#WANG Huan
Department of Oncology,Qilu Hospital of Shandong University,Qingdao 266000,Shandong,China
ObjectiveTo explore the clinical value of peripheral blood T lymphocyte subsets as markers for surveillance and prognosis in patients with gastric cancer(GC).MethodA total of 100 cases of gastric cancer patients were enrolled as GC group,treated with mFOLFOX6 regimen,with 2 weeks as 1 cycle,and each patient was given 4 cycles of chemotherapy at least.Another 80 cases of healthy adults in clinic during the same period were included as the control group,and the level of T lymphocyte subsets in peripheral blood of the two groups were detected by flow cytometry.ResultBefore chemotherapy,the CD3+,CD4+,and CD4+/CD8+were significantly lower,and CD8+was higher in GC group compared with that of control group(P<0.05);The CD3+,CD4+,and CD4+/CD8+in GC patients of I-II stage were significantly higher than those of III-IV stage,while the CD8+in the former was significantly lower than that in the latter(P<0.01). There was no significant difference in T lymphocyte subsets level in peripheral blood of GC patients with different response before chemotherapy(P>0.05),After treatment,the CR+PR group,SD group,PD group had decreased peripheral blood CD3+,CD4+,and CD4+/CD8+,and increased CD8+(P<0.01),CD3+,CD4+,and CD4+/CD8+in CR+PR group were significantly higher than,while CD8+was significantly lower than those in SD group and PD group(P<0.01).ConclusionDetecting the T lymphocyte subsets in peripheral blood is beneficial in monitoring disease condition and predicting prognosis.
T lymphocytes;gastric cancer;clinical staging;prognosis
R735.2
A
10.11877/j.issn.1672-1535.2016.14.04.22
2016-01-13)
(corresponding author),邮箱:qulinli77@163.com
