IL-17A和G-CSF在炎症相关结肠癌中的作用△
2016-10-18刘建成张兴华袁伟王晓童马洁北京协和医学院中国医学科学院肿瘤医院分子肿瘤学国家重点实验室北京000首都医科大学附属北京友谊医院消化科北京00050
刘建成 张兴华 袁伟 王晓童 马洁#北京协和医学院中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京 000首都医科大学附属北京友谊医院消化科,北京 00050
IL-17A和G-CSF在炎症相关结肠癌中的作用△
刘建成1张兴华2袁伟1王晓童1马洁1#
1北京协和医学院中国医学科学院肿瘤医院分子肿瘤学国家重点实验室,北京1000212首都医科大学附属北京友谊医院消化科,北京100050
目的探索在小鼠结肠炎相关结肠癌(CAC)发展过程中IL-17A和G-CSF的调控关系。方法采用氧化偶氮甲烷和葡聚糖硫酸钠联合诱导建立CAC动物模型,得到了从结肠炎发展到结肠癌三个阶段的小鼠模型(分别为AD1、AD2、AD3),免疫组化检测各阶段小鼠结直肠部位IL-17A和G-CSF表达;重组小鼠IL-17A体外刺激流式分选得到的结直肠上皮细胞,实时PCR和ELISA方法检测G-CSF基因转录和蛋白表达水平。结果CAC模型经历了从隐窝病灶—腺瘤—腺癌疾病发展过程,与人CAC病程相似。免疫组化结果显示,IL-17A和G-CSF在CAC小鼠结直肠部位的表达均高于健康对照组;IL-17A作用于小鼠结直肠上皮细胞,G-CSF在处理组转录(10.34±0.8)ng/m l和蛋白表达水平(3.5±0.24)ng/m l的表达均高于对照组转录(0.94±0.04)ng/m l和蛋白水平(0.05±0.008)ng/m l的表达,差异均有统计学意义(P<0.001)。结论随着小鼠CAC的发展,IL-17A和G-CSF在结直肠组织中均上调表达,且体外实验证实IL-17A促进了结直肠上皮细胞G-CSF表达。
结肠炎相关结肠癌;IL-17A;G-CSF
Oncol Prog,2016,14(4)
结肠炎相关结肠癌(colitis-associated cancer,CAC)与炎症性肠病(inflammatory bowel disease,IBD)密切相关,如克罗恩病和溃疡性结肠炎,是IBD死亡的主要原因,IBD患者发展成为结直肠癌的风险是普通人的6倍[1]。由于CAC的发病原因复杂,调控机制尚不清楚,因此有必要对其发病机制进行研究。IBD患者的结直肠组织在经历了长达数十年的周期性黏膜溃疡、坏死、修复等病理过程后发展成为结直肠癌。在CAC发展过程中许多细胞因子参与炎症反应,具有代表性的炎症性细胞因子有IL-17A[2],以及参与调控炎症细胞增殖和分化的G-CSF[3]。这两个炎症因子在CAC发展过程中是否有一定的调控关系,通过什么类型细胞发挥调控作用已成为研究热点。本研究通过诱导能模拟人CAC发展的AOM/DSS动物模型,以揭示IL-17A与G-CSF的调控关系,为CAC的免疫干预治疗提供理论依据。
1 材料与方法
1.1实验材料
氧化偶氮甲烷(azoxymethane,AOM)购自美国Sigma公司;葡聚糖硫酸钠(dextran sodium sulfate,DSS)购自美国MP生物医药公司。重组小鼠IL-17A和EGF细胞因子购自美国PeproTech;小鼠G-CSF ELISA检测试剂盒购自美国R&D公司;G-CSF山羊抗小鼠多抗和IL-17A山羊抗小鼠多抗购自美国Santa Cruz公司;过氧化物封闭液、一抗稀释液、山羊超敏二步法检测试剂盒、哈瑞苏木素染液、中性快干胶、内源性过氧化物酶阻断剂(3%H2O2)、DAB显色液均购自北京中杉金桥生物技术有限公司;牛血清白蛋白(BSA)购自美国Am resco公司;抗小鼠CD324(E-cadherin)A lexa Fluor®488和抗小鼠CD45 APC购自于美国eBioscience公司;Triozl购自美国Invitrogen公司;反转录试剂盒和SYBR Green荧光定量PCR试剂盒购自日本TaKaRa公司;70 μm细胞滤网和Matrigel Basement Membrane Matrix购自美国BD公司;胶原酶XI和DNaseI均购自瑞士Roche公司。
无特定病原体级(specific pathogen free,SPF)雌性C57BL/6小鼠,7~9周龄,体质量19~20 g,购自北京华阜康生物科技股份有限公司,实验动物许可证编号:SCXK(京)2014-0004,饲养于中国医学科学院肿瘤医院SPF级动物房。
1.2实验仪器
采用BD流式细胞分选仪、Eppendorf荧光定量PCR仪、nanodrop 2000紫外分光光度仪、三洋CO2培养箱、美国宝特(Bio-Tek)ELx-800自动酶标仪、LEICA倒置显微镜进行实验。
1.3实验方法
1.3.1诱导小鼠CAC动物模型[2]将7~9周龄,体质量为19~20 g的雌性C57BL/6小鼠随机分成健康对照组和给药组,健康对照组不做任何处理(n=5),给药组小鼠第一天腹腔注射致癌剂AOM(12.5 mg/kg),休息10 d,给予第一次喂食含致炎剂DSS(2.5%)的饮用水5 d,该阶段诱导结束后命名为AD1(n=5);休息14 d,第二次饲喂含致炎剂DSS(2.5%)的饮用水5 d,该阶段诱导结束后小鼠命名为AD2(n=5);休息14 d,第三次饲喂含致炎剂(DSS)(2.5%)的饮用水5 d,该阶段诱导结束后命名为AD3(n=5)。
1.3.2免疫组化10%甲醛固定组织,常规石蜡包埋,组织蜡块进行4 μm厚的连续切片,用二甲苯、梯度浓度酒精脱蜡至水,柠檬酸盐缓冲液抗原修复,冷却至室温,3%H2O2室温孵育30 m in,PBS冲洗,3%BSA封闭1 h,一抗4℃孵育过夜,PBS冲洗,二抗孵育30 m in,PBS冲洗;DAB显色,苏木素染核,酒精盐酸分色,氨水返蓝,脱水,透明,封片。每组选取5只小鼠结直肠组织玻片进行免疫组化染色,每张免疫组化片子随机取4个视野进行观察。
1.3.3小鼠结直肠上皮细胞的分离和培养用预冷的PBS将小鼠结直肠组织清洗干净,放入4 m l离心管中,加入2 m l含5%牛血清的PBS,用手术剪刀将组织剪成糜状,转入50 m l烧杯,加入10 m l DMEM培养基,胶原酶XI终浓度为100 U/m l,DN-aseI终浓度为0.22 mg/m l,37℃低速搅拌30 min,200目不锈钢筛网过滤,去除杂物,再用细胞筛(70 μm滤膜)过滤细胞,获得结直肠单细胞悬液,将细胞数调整至1×107m l,加1 μl CD45流式抗体,4℃避光孵育30 m in,PBS洗掉未结合流式抗体,用流式细胞术分选CD45-细胞。
用DMEM培养基重悬CD45-细胞,接种于含2%Matrigel的6孔板中,加入10 ng/m l的EGF,置于CO2培养箱中培养。培养6 d后,流式细胞术检测上皮细胞的E-cadherin阳性率,取5×105个上皮细胞转入六孔板,加入重组小鼠IL-17A(终浓度100 ng/m l)细胞因子,培养24 h,收取培养上清和细胞。
1.3.4实时PCR检测按照TRIzol试剂说明书提取细胞总的mRNA,nanodrop 2000紫外分光光度仪测核酸浓度,逆转录制备cDNA,1 μg mRNA、1 μl Oligo dT、1 μl AMV逆转录酶、RNase Free dH2O补足20 μl。反应条件:37℃、15 min(反转录反应),85℃、5 (s反转录酶的失活反应),4℃、10 m in。实时PCR引物及其序列见下:
20μl实时PCR体系SYBR Premix Ex Taq II(2×)10 μl、PCR Forward Primer(10 μm)0.4 μl、PCR Reverse Primer(10 μm)各0.4 μl、cDNA溶液2 μl、补足20 μl反应体系。反应条件,第一步预示变性95℃、30 s,第二步95℃、5 s,第三步退火60℃、30 s,第二步至第三步循环40次。
1.3.5ELISA检测按照R&D公司小鼠G-CSF ELISA检测试剂盒方法,96孔板每孔加入50 μl捕获抗体,4℃过夜。弃去孔板液体,每孔加入50 μl G-CSF标准品、阴性对照和待测样品,室温孵育2 h;弃去孔中液体,用PBST洗板。每孔加入100 μl抗小鼠G-CSF二抗,室温孵育2 h,PBST洗板。每孔加入100 μ DAB显色液,避光孵育30 m in,加50 μl终止液,酶标仪450 nm波长检测吸收值。
1.4实验所用软件
Flow Jo 7.6软件分析流式细胞术结果,Graph-Pad Prism 5.0制作图表,SPSS 19软件分析统计结果,以均数±标准差(±s)表示计量资料数据,计量资料数据的比较采用t检验,以P<0.05为差异有统计学意义。
2 实验结果
2.1小鼠CAC动物模型的建立
观察结果显示,小鼠饮用第一轮DSS水后,出现精神不振、怠倦、体质量减轻、腹泻和便血症状。饲喂普通水后,小鼠大便、精神状态和体质量逐步恢复正常。第二、三循环期内,小鼠表现与第一循环期相似。在AD小鼠诱导结束后,解剖小鼠结直肠,可观察到3组AD小鼠结直肠内多有血便和血便黏附,粪便恶臭,并且结直肠长度较健康组短,肠壁增厚,AD3有肉眼可见腺瘤。
结直肠HE病理结果显示,AD1小鼠结直肠有大量淋巴细胞浸润,表明诱导初期有炎性肠病症状,AD2小鼠结直肠有大量的不典型增生和腺瘤病变组织,AD3小鼠结直肠部位有原位癌。
综合观察和结直肠病理结果分析,小鼠CAC发展过程经历由正常隐窝变为异常隐窝,异常隐窝增殖形成微腺瘤,逐渐形成腺瘤、腺癌,与人的CAC发展病程相似。
2.2IL-17A在CAC发展过程中的表达
免疫组化检测结果显示,IL-17A在AD1、AD2、AD3小鼠结直肠中的表达均高于健康对照组(n=5)。IL-17A在健康小鼠结肠组织中几乎检测不到,在AD1组小鼠结直肠肠道黏膜有少量IL-17A表达,在AD2和AD3组小鼠结直肠黏膜和固有层均有IL-17A表达,但AD3组表达较AD2组IL-17A降低。(图1)
2.3G-CSF在CAC发展过程中的表达
免疫组化检测结果显示,与健康对照组相比,AD1、AD2、AD3小鼠结直肠中G-CSF表达上调。G-CSF在健康小鼠组几乎检测不到,在AD1和AD2小鼠结直肠组织主要表达在肠黏膜和固有层,G-CSF在AD3小鼠结直肠组织中主要表达在肠道固有层。与IL-17A表达类似,AD3组较AD2组的G-CSF表达也呈现降低趋势。(图2)
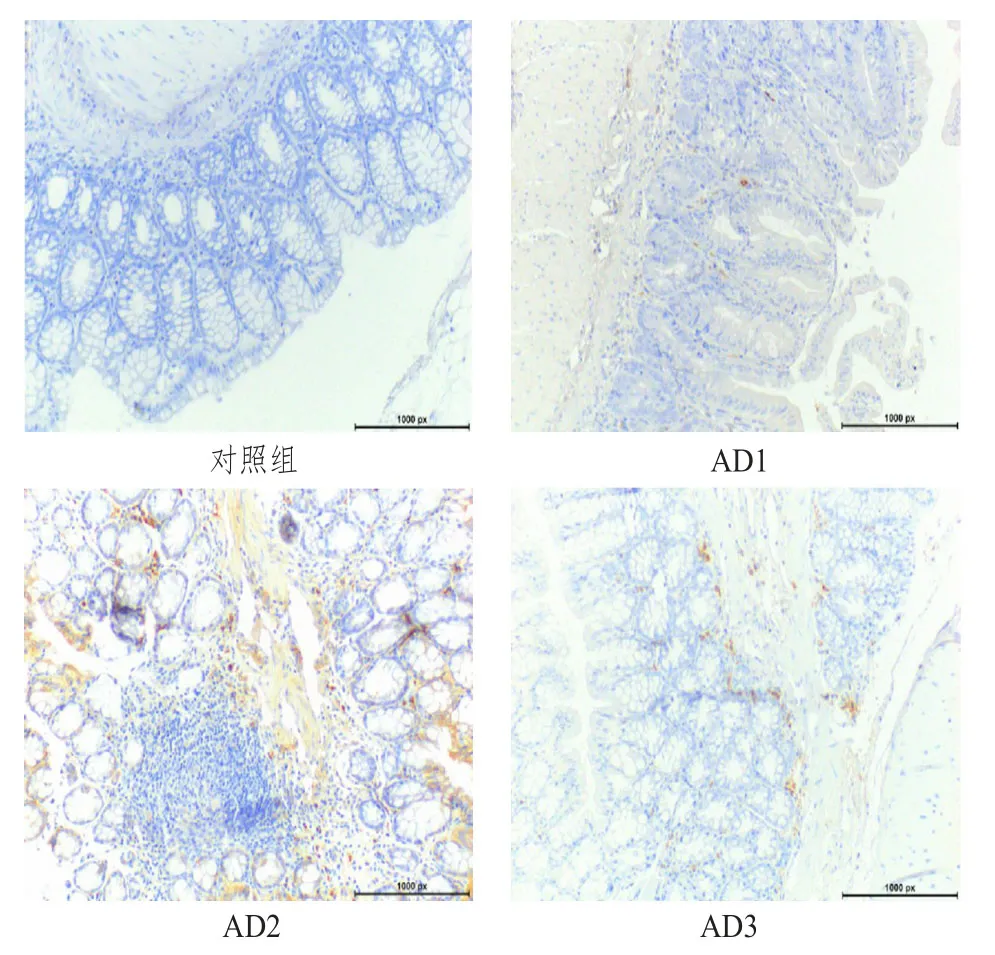
图1 对照组和CAC组小鼠结直肠IL-17A表达典型结果(免疫组化法,10×40)
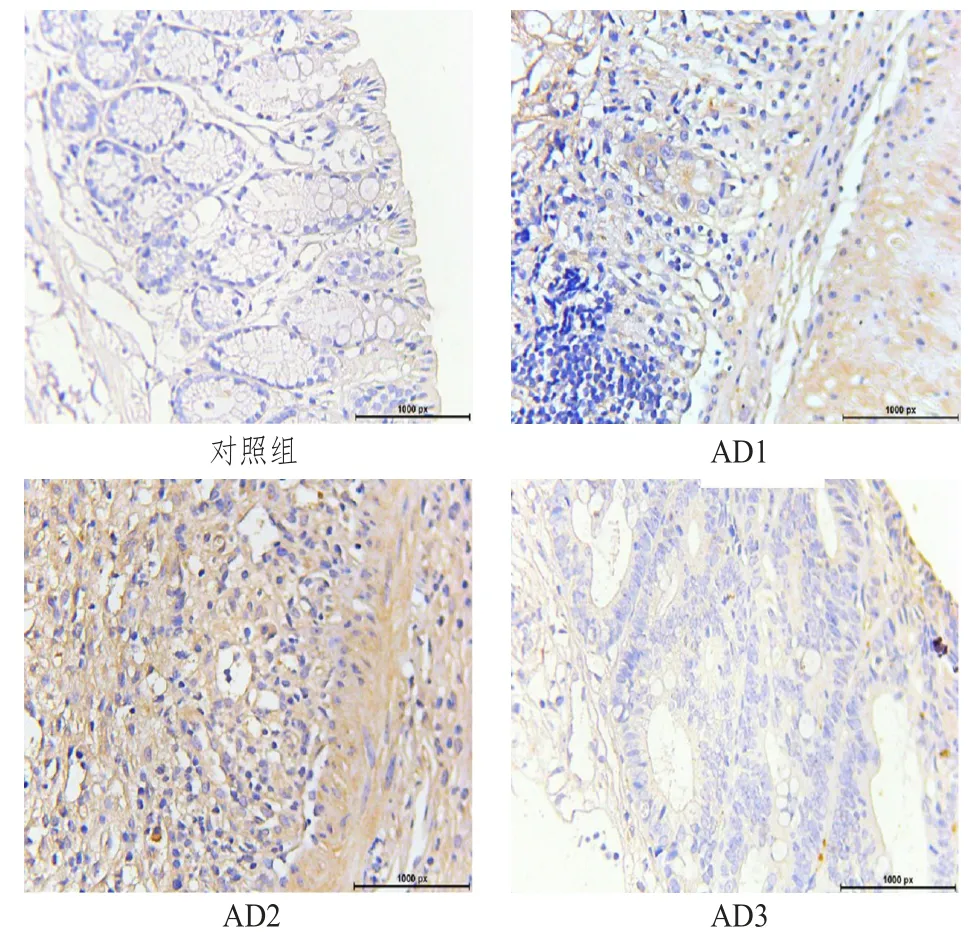
图2 对照组和CAC组结直肠组织G-CSF表达典型结果(免疫组化法,10×40)
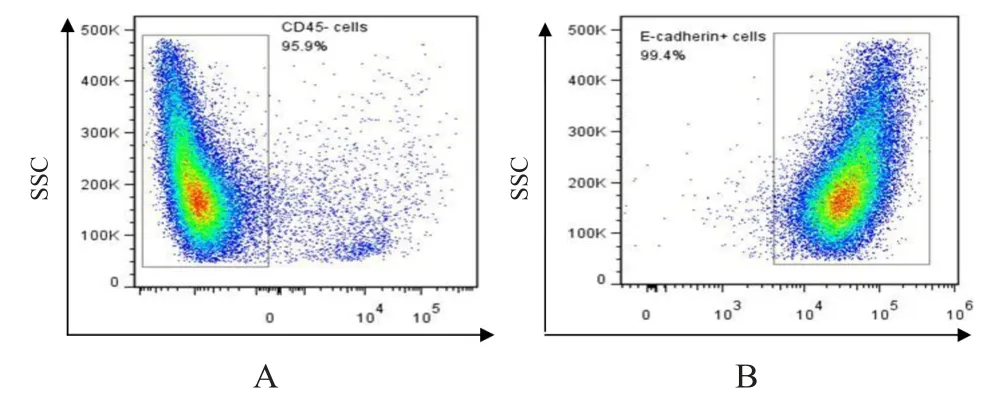
图3 小鼠结直肠上皮细胞的富集
2.4IL-17A对结直肠上皮细胞G-CSF表达的影响
先利用流式细胞术分选获得结直肠CD45-(95.9%)细胞,然后将分选的细胞用上皮细胞原代培养的方法进行富集,培养6 d,流式细胞术分析结直肠上皮细胞的纯度,结果显示,约99%的细胞为E-cadherin+上皮细胞。(图3)
将上皮细胞转到6孔板,IL-17A刺激24 h,检测结直肠上皮细胞G-CSF转录水平和培养上清液中的G-CSF表达水平,结果显示,IL-17A处理组G-CSF转录水平[(10.34±0.8)ng/m l,n=3]和蛋白水平[(3.5± 0.24)ng/m l,n=3]的表达均高于对照组转录水平[(0.94±0.04)ng/m l,n=3]和蛋白水平[(0.05±0.008)ng/m l,n=3]的表达,差异有统计学意义(P<0.001)。(图4)
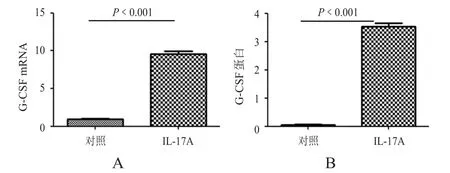
图4 IL-17A刺激后小鼠结直肠上皮细胞的G-CSF表达
3 讨论
近些年越来越多研究表明,炎症与肿瘤的关系密切。慢性炎症持续存在时,炎性细胞产生大量的活性氧自由基(reactive oxygen species,ROS)和活性氮中间体(reactive nitrogen intermediates,RN),可引起DNA损伤和基因组不稳定,介导致癌效应,如幽门螺旋杆菌感染的慢性胃炎与胃癌,乙肝病毒感染的慢性肝炎与肝癌,以及IBD与结直肠癌等[4]。而CAC是IBD最严重的并发症,IBD患者在10年、20年、30年发展为CAC的概率分别为2%、8%、18%[5]。虽然炎症是导致肿瘤的一个明确危险因素,但IBD向CAC发展过程中的调控机制尚不明确。炎症发生的机制是炎症组织内微血管的舒张,血细胞的渗入和大量炎性细胞因子的释放[6]。炎性细胞因子IL-17A和G-CSF在介导炎性调控和肿瘤发生发展中发挥关键作用。
IL-17A主要是由Th17细胞分泌的一种较强的炎症性细胞因子,具有募集中性粒细胞和促进多种细胞进一步释放炎性细胞因子的作用,可通过诱导IL-6、TNF-α、MMP参与炎症反应,在自身免疫性疾病(类风湿性关节炎、硬化症)和肿瘤的发生、发展中起重要作用。
IL-17A通过作用于肿瘤成纤维细胞和肿瘤基质细胞,诱导血管内皮生长因子在内的大量促血管生长因子的产生,大大促进了炎症和肿瘤血管的生成。现在普遍观点认为,IL-17A可以诱导肿瘤微环境的形成,促进血管生成和肿瘤的迁移,加速肿瘤的生长[7]。IL-17A能上调结直肠癌细胞系EGFR的表达,促进结直肠癌的恶性发展[8]。近期有研究报道在诱导IL-17A基因敲除小鼠CAC模型中,结直肠上皮增生减慢,肿瘤减少,CAC的发展受到抑制[9]。本研究结果显示,IL-17A在健康小鼠结肠组织中难以检测到,但随着CAC的发展,IL-17A在结直肠组织中表达上调,但AD3组较AD2组IL-17A表达降低,说明IL-17A在CAC发展过程中发挥重要作用,且主要作用于早期阶段。
G-CSF是造血因子家族的一员,在促进中性粒细胞的增殖和分化、动员骨髓细胞向外周和组织迁移、维持免疫微环境的稳态发挥重要作用。近期研究发现,G-CSF在多种肿瘤中表达上调,促进肿瘤的增殖和转移。体外实验表明,结直肠癌和胃癌细胞的增殖能力对G-CSF的处理具有浓度和时间依赖性[10]。G-CSF可通过STAT3信号通路促进脑胶质瘤细胞的生长、转移和侵袭[11]。肺癌高表达肿瘤相关的G-CSF与肿瘤的淋巴侵袭转移和不良预后有关[12]。本实验前期研究结果证实,G-CSF在CAC发展过程中发挥重要作用,结直肠组织的G-CSF通过募集MDSC,介导小鼠CAC的发展,抗G-CSF治疗能干预CAC的发展[13]。本研究结果显示,G-CSF和IL-17A在健康小鼠结直肠组织低表达,随着CAC的发展,G-CSF和IL-17A均表达上调,在AD2阶段达峰值。AD3阶段较AD2阶段炎症程度下降,可观察到IL-17A及G-CSF表达的下调。由于肠道炎症微环境复杂,细胞因子变化机制还有待进一步研究。
有研究报道IL-17A能促进肺脏上皮细胞GCSF的表达[14],本实验室前期实验证实,结直肠上皮细胞表达G-CSF[15],推测IL-17A可能作用于结直肠上皮细胞,调控G-CSF的表达。本研究亦发现IL-17A和G-CSF在CAC发展过程中表达变化趋势一致,但IL-17A与G-CSF的表达是否有一定的调控关系?为了验证该设想,本实验利用重组小鼠IL-17A处理结直肠上皮细胞,从转录水平和蛋白水平均检测到G-CSF在IL-17A处理组表达上调,证实IL-17A促进了结直肠上皮细胞G-CSF的表达。但是,IL-17家族的其他成员如IL-17B、IL-17C、IL-17D、IL-17E、IL-17F是否影响G-CSF的表达及作用机制,结直肠组织中其他类型细胞的GCSF表达是否也受IL-17家族影响,需要进一步深入研究。
综上所述,本研究通过建立CAC动物模型,模拟人CAC的发展过程,不仅检测到IL-17A和GCSF在CAC发展过程中协同上调表达,而且证明了IL-17A可通过作用于结直肠上皮细胞促进GCSF表达。
[1]Mattar MC,Lough D,Pishvaian MJ,et al.Current management of inflammatory bowel disease and colorectal cancer[J].Gastrointest Cancer Res,2011,4(2):53-61.
[2]Hyun YS,Han DS,Lee AR,et al.Role of IL-17A in the development of colitis-associated cancer[J].Carcinogenesis,2012,33(4):931-936.
[3]Semerad CL,Liu F,Gregory AD,et al.G-CSF is an essential regulator of neutrophil trafficking from the bone marrow to the blood[J].Immunity,2002,17(4):413-423.
[4]Colotta F,A llavena P,Sica A,et al.Cancer-related inflammation,the seventh hallmark of cancer:links to genetic instability[J].Carcinogenesis,2009,30(7):1073-1081.
[5]Jess T,Rungoe C,Peyrin-Biroulet L.Risk of colorectal cancer in patients w ith ulcerative colitis:a meta-analysis of population-based cohort studies[J].Clin Gastroenterol Hepatol,2012,10(6):639-645.
[6]Rock KL,Latz E,Ontiveros F,et al.The sterile inflammatory response[J].Annu Rev Immunol,2010(28):321-342.
[7]Charles KA,Kulbe H,Soper R,et al.The tumor-promoting actions of TNF-alpha involve TNFR1 and IL-17 in ovarian cancer in m ice and humans[J].J Clin Invest,2009,119(10): 3011-3023.
[8]Straus,DS.TNFalpha and IL-17 cooperatively stimulate glucose metabolism and grow th factor production in human colorectal cancer cells[J].Mol Cancer,2013(12):78.
[9]Oshiro K,Kohama H,Umemura M,et al.Interleukin-17A is involved in enhancement of tumor progression in murine intestine[J].Immunobiology,2012,217(1):54-60.
[10]Morris KT,Khan H,Ahmad A,et al.G-CSF and G-CSFR are highly expressed in human gastric and colon cancers and promote carcinoma cell proliferation and m igration[J].Br J Cancer,2014,110(5):1211-1220.
[11]Wang J,Yao L,Zhao S,et al.Granulocyte-colony stimulating factor promotes proliferation,migration and invasion in glioma cells[J].Cancer Biol Ther,2012,13(6):389-400.
[12]Yokoyama T,Hyodo M,Hosoya Y,et al.Aggressive GCSF-producing gastric cancer complicated by lung and brain abscesses,mimicking metastases[J].Gastric Cancer,2005,8(3):198-201.
[13]Li W,Zhang X,Chen Y,et al.G-CSF is a key modulator of MDSC and could be a potential therapeutic target in colitis-associated colorectal cancers[J].Protein Cell,2016,7(2):130-140.
[14]Chang SH,M irabolfathinejad SG,Katta H,et al.T helper 17 cells play a critical pathogenic role in lung cancer[J]. Proc Natl Acad Sci U S A,2014,111(15):5664-5669.
[15]石新英,袁伟,唐万燕,等.G-CSF在结肠炎相关结直肠癌中的表达[J].癌症进展,2016,14(2):168-174.
The association between IL-17A and G-CSF in murine colitis-associated cancer△
LIU Jian-cheng1ZHANG Xing-hua2YUAN Wei1WANG Xiao-tong1MA Jie1#
1State Key Laboratory of Molecular Oncology,Cancer Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100021,China
2Department of Gastroenterology,Beijing Friendship Hospital,Capital Medical University,Beijing l00050,China
Objective To investigate the correlation between IL-17A and G-CSF during the development of colitis-associated cancer(CAC).Method A murine colitis-associated colon cancer(CAC)model was established using azoxymethane(AOM)and dextran sulfate sodium(DSS).The three stages from colitis to colon cancer were named as ADl,AD2 and AD3,respectively.The expression of IL-17A and G-CSF in rectum were detected by immunohistochem istry.Recombinant mouse IL-17A was used to stimulate the colorectal epithelial cells sorted by flow cytometry.The transcription and protein expression level of G-CSF were detected by Real-time PCR and ELISA.Result The CAC mouse model underwent a normal development process of mucosa—dysplasia—adenoma—carcinoma,which was sim ilar to the development of human CAC.Immunohistochem istry results indicated that the expression of IL-17A and G-CSF in CAC model was higher than that in normal m ice.A fter IL-17A stimulation,the level of IL-17A and G-CSF were up-regulated in epithelial cells compared w ith control[(10.34±0.8)ng/m l vs(0.94±0.04)ng/m l]and[(3.5±0.24)ng/m l vs(0.05±0.008)ng/m l],P<0.001,respectively.These findings were statistically significant.Conclusion IL-17A and G-CSF are up-regulated in colorectal tissue as the murine CAC develops,and it is demonstrated that IL-17A promotes the expression of G-CSF in colorectal epithelial cells.
colitis-associated cancer;IL-17A;G-CSF
R735.3
A
10.11877/j.issn.1672-1535.2016.14.04.08
2016-03-04)
国家自然科学基金(81541154);国家重点基础研究发展计划(2014CB542103);科技北京百名领军人才培养工程(Z131107000513001);北京市科技新星计划(Z131107000413066)
(corresponding author),邮箱:majie1965@163.com
