C-肽及胰岛素抵抗水平与结直肠癌发病风险的相关性研究△
2016-10-18冯滢滢刘泉龙张斌尹淑慧张涛赵玉涓丁建华
冯滢滢 刘泉龙 张斌 尹淑慧 张涛 赵玉涓 丁建华
解放军第二炮兵总医院结直肠肛门外科,北京 100088
C-肽及胰岛素抵抗水平与结直肠癌发病风险的相关性研究△
冯滢滢刘泉龙张斌尹淑慧张涛赵玉涓丁建华#
解放军第二炮兵总医院结直肠肛门外科,北京100088
目的探讨C-肽及胰岛素抵抗(insulin resistance,IR)与结直肠癌发病的相关性。方法选取结直肠癌患者(n=50)、结直肠腺瘤患者(n=27)以及经过肠镜检查正常的对照组者(n=36),共113例,应用统计学分析比较其空腹血清胰岛素(FINS)、C-肽、空腹血糖水平以及胰岛素抵抗指数的差异。结果结直肠癌组患者空腹血清胰岛素、胰岛素抵抗指数、C-肽、空腹血糖均高于对照组,差异有统计学意义(P<0.01)。结直肠腺瘤组患者C-肽和空腹血糖高于对照组,差异有统计学意义(P<0.05)。多因素Logistic回归分析发现年龄、C-肽、空腹血糖与结直肠癌发病有关;C-肽、胰岛素抵抗与结直肠息肉发病有关。结论C-肽及胰岛素抵抗与结直肠息肉、结直肠癌发病相关。
胰岛素抵抗;胰岛素;C-肽;结直肠癌;结直肠腺瘤性息肉
Oncol Prog,2016,14(3)
结直肠癌是世界上最常见的肿瘤之一[1],近年来结直肠癌在亚洲发病率与日俱增,高脂低纤维饮食,缺乏运动,结直肠癌家族史等都是导致结直肠癌高发的原因。除此之外肥胖以及胰岛素抵抗、高胰岛素血症、糖尿病、代谢综合征也是结直肠癌的发病因素[2]。“结直肠腺瘤癌变”的序贯学说提出多数结直肠癌是由腺瘤到腺癌逐渐演变而来,因此鉴别出结直肠腺瘤的风险因素对预防和监测结直肠癌非常重要[3-6]。“高胰岛素血症结直肠癌学说”已被很多流行病学以及体外研究支持[4-6],国外学者报道血胰岛素水平以及稳态模式评估胰岛素抵抗指数(HOMA-insulin resistance,HOMAIR)与结直肠癌、腺瘤的发生有相关性,但结果并不一致[7-10],国内目前此类研究尚少。本研究通过收集113例结直肠癌、结直肠腺瘤以及经过肠镜检查正常患者的临床资料,回顾性分析其空腹血清胰岛素水平(fasting plasma insulin,FINS)、C-肽、血糖水平、胰岛素抵抗(insulin resistance,IR),体质量指数(body mass index,BMI)的差异,旨在探讨其与结直肠癌发生发展过程的相关性。
1 资料与方法
1.1一般资料
选取2013年10月至2014年10月解放军第二炮兵总医院肛肠科收治的结直肠癌患者50例,结直肠腺瘤性息肉患者27例,经肠镜检查为非肠道肿瘤和息肉的正常者36例。所有肿瘤、腺瘤性息肉患者经手术或肠镜下切除并有病理报告证实。患者术前均未接受过化疗,排除存在其他部位肿瘤患者以及之前曾经接受过结肠切除手术患者。正常组排除急性炎症、贫血、恶液质,肠易激综合征,未完全通过肠镜检查者,另外高血压、肝功能损害、肾功能损害者也被排除。患者入院第二天清晨抽血查空腹血糖、胰岛素、C-肽,禁食均在10 h以上。结直肠癌组糖尿病患者9例,非糖尿病患者41例;腺瘤性息肉组糖尿病患者7例,非糖尿病患者20例;正常对照组中糖尿病患者4例,非糖尿病患者32例。3组患者的年龄、性别、糖尿病患病率、体质量指数比较,差异均无统计学意义(P>0.05),详见表1。
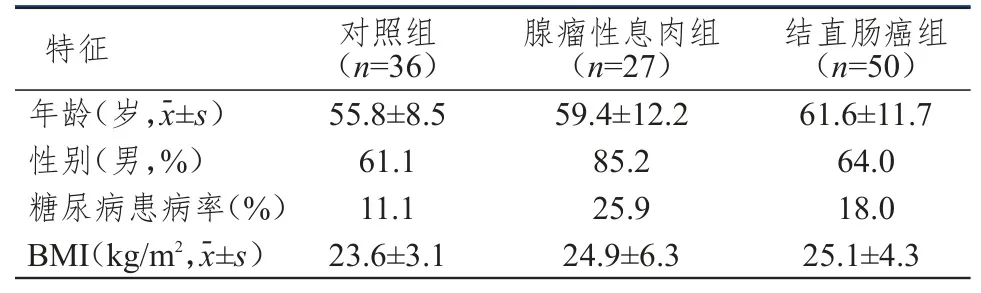
表1 3组患者年龄、性别、糖尿病患病率及体质量指数
1.2研究方法
所有受测对象均在入院第二天清晨6:00—7:00,禁食10 h以上,空腹安静状态下采血;置于肝素抗凝干燥灭菌试管,低温冰箱保存。胰岛素浓度采用放射免疫试剂盒按照操作说明进行检测,空腹血糖以己糖激酶法用自动分析仪测定(胰岛素放射免疫试剂盒由北京海科锐生物技术中心提供);采用稳态模型胰岛素抵抗指数来评估胰岛素抵抗。HOMAIR=空腹血糖×空腹胰岛素/22.5,HOMA-IR>2.6为胰岛素抵抗。
1.3统计学方法
应用SPSS17.0软件进行统计学分析,满足正态分布的计量资料采用均数±标准差(±s)表示,不满足正态分布的用中位数(最小值,最大值)方法表示,组间比较采用单因素方差分析、t检验或K组独立样本的秩和检验(Kruskal-Wallis Test);多组频数之间比较采用pearson chi-square χ2检验。结直肠癌患病相关的因素采用多因素的Logistic回归分析;P<0.05为差异有统计学意义。
2 结果
2.13组患者血清胰岛素、C-肽、空腹血糖、胰岛素抵抗指数的比较
3组患者血清空腹胰岛素、C-肽、空腹血糖、胰岛素抵抗指数的比较,差异均有统计学意义(P<0.05),两两比较显示对照组和结直肠癌组患者的胰岛素、胰岛素抵抗指数、C-肽、空腹血糖相比差异均有统计学意义(P<0.05);且对照组和腺瘤性息肉组患者的C-肽、空腹血糖相比差异有统计学意义(P<0.05),胰岛素、胰岛素抵抗水平差异无统计学意义(P>0.05)。腺瘤性息肉和结直肠癌组胰岛素、胰岛素抵抗指数、C-肽、空腹血糖相比差异均无统计学意义(P>0.05),详见表2。
2.2体质量指数与血清胰岛素、C-肽、空腹血糖及胰岛素抵抗指数的关系
将所有患者按超重(BMI≥25 kg/m2)和不超重(BMI<25 kg/m2)分成两组,比较两组患者血清空腹胰岛素、C-肽、空腹血糖及胰岛素抵抗水平的差异,如表3所示,超重患者的血清胰岛素、C-肽、空腹血糖及胰岛素抵抗水平均高于不超重患者,且差异有统计学意义(P<0.01)。
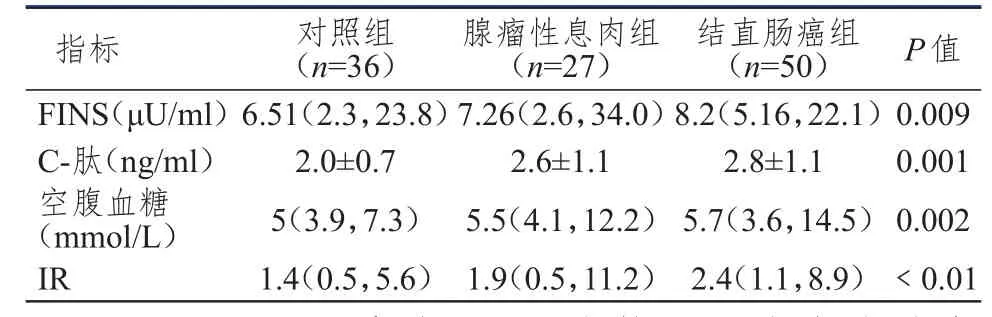
表2 3组患者空腹胰岛素、C-肽、空腹血糖及胰岛素抵抗指数的比较
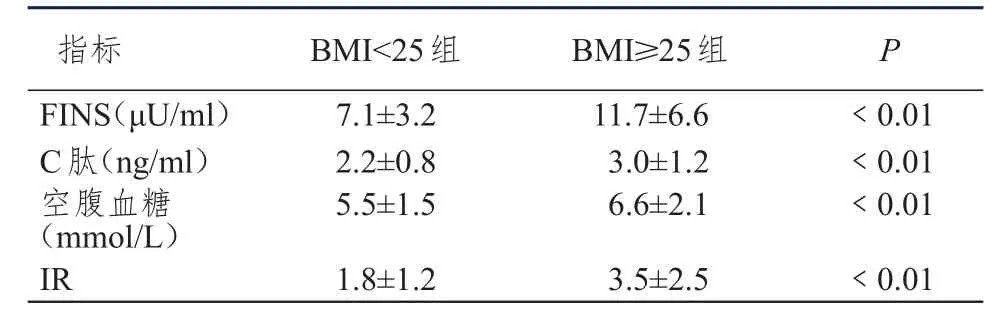
表3 体质量指数与血清胰岛素、C-肽、空腹血糖及胰岛素抵抗水平的关系
2.3糖尿病与非糖尿病患者血清胰岛素、C-肽、空腹血糖、胰岛素抵抗指数的比较
将3组患者按糖尿病和非糖尿病划分,分别比较糖尿病组和非糖尿病组中,3组患者组间的血清胰岛素、C-肽、空腹血糖、胰岛素抵抗指数,如表4、5所示。糖尿病组中,3组患者血清胰岛素、C-肽、空腹血糖、胰岛素抵抗水平比较差异均无统计学意义(P>0.05)。非糖尿病组中,3组患者血清胰岛素、C-肽、空腹血糖比较差异均有意义(P<0.05),胰岛素抵抗水平比较接近有意义(P=0.05),两两比较发现对照组与结直肠癌组患者的血清胰岛素、C-肽、空腹血糖、胰岛素抵抗水平差异均有意义(P<0.05),对照组与腺瘤性息肉组,腺瘤性息肉与结直肠癌组患者血清胰岛素、C-肽、空腹血糖、胰岛素抵抗水平差异均无统计学意义(P>0.05)。
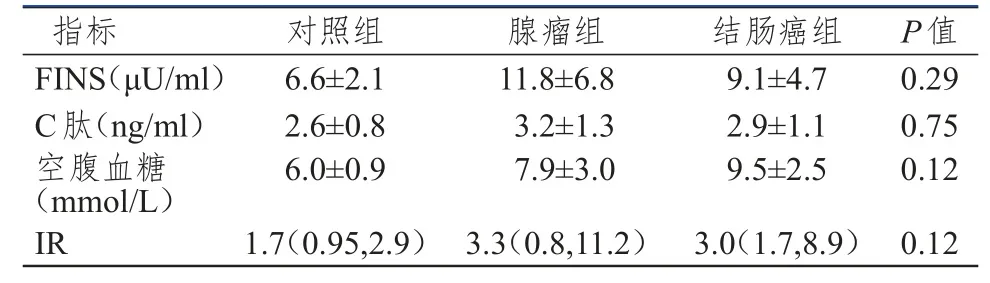
表4 糖尿病组患者血清胰岛素、C-肽、空腹血糖、胰岛素抵抗指数的比较
表5 非糖尿病组患者血清胰岛素、C-肽、空腹血糖、胰岛素抵抗指数的比较
2.4结直肠癌患病风险相关因素的多因素Logistic回归分析
以结直肠癌形成为因变量,以糖尿病、性别、年龄、血清C-肽、血清空腹胰岛素、空腹血糖、胆固醇、甘油三脂、胰岛素抵抗为自变量,运用Logistic多因素回归分析,计算反映各因素相对危险度的近似估计值比数比(OR),结果如表6所示,年龄、C-肽、空腹血糖的OR>1,且P<0.05。血清胰岛素的OR>1,但P值接近小于0.05。基本可以说明年龄、C-肽、空腹血糖、胰岛素水平是结直肠癌患病风险的影响因素。
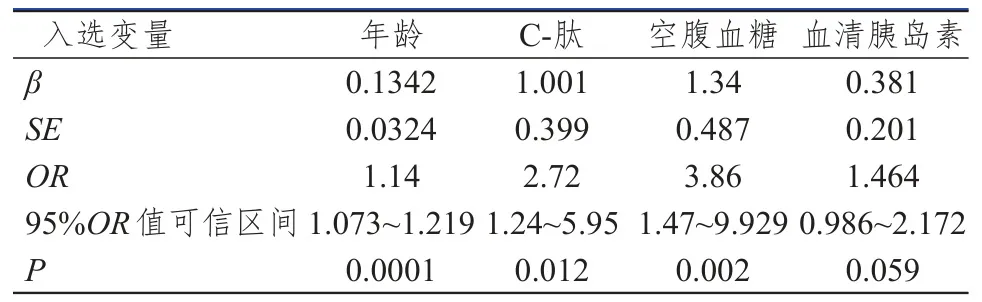
表6 结直肠癌患病风险多因素Logistic分析
2.5结直肠息肉患病风险相关因素的多因素Logistic回归分析
以结直肠息肉为因变量,以糖尿病、性别、年龄、C-肽、血清空腹胰岛素、空腹血糖、胆固醇、甘油三脂、胰岛素抵抗为自变量,运用Logistic多因素回归分析,计算OR值,结果如表7所示,C-肽、胰岛素抵抗的OR>1,且P<0.05。说明C-肽、胰岛素抵抗水平是结直肠腺瘤性息肉患病风险的影响因素。
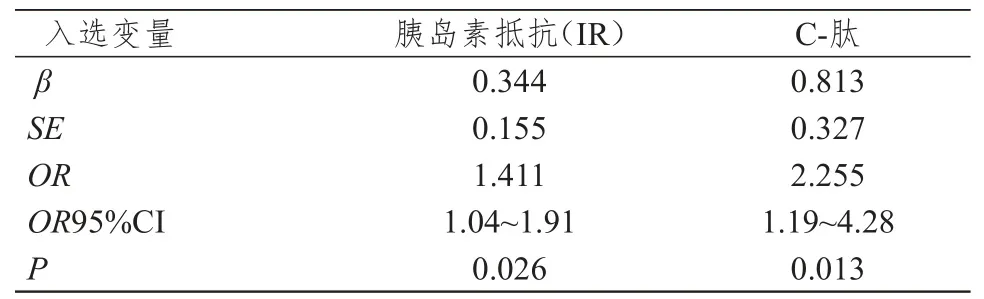
表7 结肠息肉患病风险多因素Logistic分析
3 讨论
胰岛素抵抗、慢性高胰岛素血症、2型糖尿病、高脂血症、代谢综合征已经越来越被认识到是肠癌发病的高风险因素。国外流行病学和体内外实验研究支持肠癌发病机制中的“胰岛素假说”[4-6],也有研究报道肠癌和胰岛素以及胰岛素抵抗的关系,但结论不完全一致[7-12],目前国内尚未有针对肠癌的类似临床队列研究。
本研究通过对比结直肠癌患者、结肠腺瘤性息肉患者与正常患者,发现3组患者的血清空腹胰岛素、C-肽、空腹血糖、胰岛素抵抗水平确有差异(P<0.05),除此以外我们发现随着体质量指数的增加,超重患者比不超重患者的血清胰岛素、C-肽、空腹血糖及胰岛素抵抗水平均高,说明肥胖确实能导致胰岛素抵抗和高胰岛素血症、高血糖状态。非糖尿病患者3组的血清胰岛素、C-肽、空腹血糖、胰岛素抵抗水平比较差异均有统计学意义(P<0.05),两两比较发现组内对照组与结直肠癌组患者的血清胰岛素、C-肽、空腹血糖、胰岛素抵抗水平差异均有统计学意义(P<0.05)。排除糖尿病患者影响后的结果更加说明了结直肠癌患者与正常人相比存在胰岛素抵抗和高胰岛素血症、高C-肽、高血糖状态。最后,通过Logistic逐步回归分析,得出年龄、C-肽、空腹血糖水平是结直肠癌患者患病风险的影响因素(OR:1.14,P<0.01;OR:2.72,P=0.012;OR:3.86,P=0.002)。此组临床数据经多因素分析未得出空腹胰岛素水平是肠癌高风险因素。这一结果与Schoen等[13]的研究相一致,他认为相比较于空腹胰岛素水平,标准饮食2 h后的胰岛素水平与结直肠癌发病风险关系更加密切,提示胰腺对碳水化合物摄入后的高反应可能是比空腹胰岛素水平更重要的肠癌患病风险之一。而Giovannucci[4]也推测胰岛素在体内影响细胞增殖,抑制凋亡仅仅发生在高水平餐后状态时,因此建议检测餐后2 h胰岛素水平。本研究只检测了空腹胰岛素水平,而没有测餐后2 h胰岛素水平,而空腹胰岛素在我们进行多因素分析时,其影响并不显著。但是C-肽仍然能呈现出敏感性,这与C-肽的特性有关。C-肽与胰岛素同是胰岛素原释放出来,并且等分子释放,所以测定C-肽的量能反应胰岛素的量;并且C-肽分子比胰岛素稳定,半衰期长,血液里的胰岛素只有很短的半衰期,很快因结合胰岛素受体而被清除,而且胰腺一旦分泌胰岛素,大部分在进入外周血之前就已经被肝脏摄取,所以C-肽是反映胰岛素水平的一个很可靠指标,更加体现禁食和食后的平均血清胰岛素水平,更能反映自身胰腺胰岛分泌能力[14]。在进食后C-肽水平升高,并且维持的时间长于胰岛素,这可以解释本研究中C-肽取代空腹胰岛素水平成为有意义的结直肠癌高风险因素之一的原因。
本组研究结果提示结直肠癌患者确实存在高血糖、高胰岛素、C-肽和胰岛素抵抗状态,与国外很多文献报道相一致[15-16]。研究认为胰岛素和胰岛素抵抗,在肿瘤的形成和发展过程中起重要作用。高胰岛素血症可通过多种途径促进肠癌的发生,胰岛素抵抗状态所呈现的代谢异常如高血糖、高血脂和细胞因子水平的改变,构筑了一种有利于肿瘤发生的环境,并最终导致肠癌发生。具体机制目前尚不完全清楚,但目前最主要的学说是“胰岛素-胰岛素样生长因子(IGF)轴”学说[6],胰岛素生长因子IGF-1通过与其受体IGF-1R结合,发挥抑制细胞凋亡、促进细胞增殖、影响细胞周期进程、促进VEGF分泌从而促进血管生长等作用,高胰岛素水平能反射性地抑制胰岛素结合蛋白(IGFBPⅠ/Ⅱ)的表达,而IGFBPⅠ/Ⅱ本身可以通过与IGF-1结合抑制IGF-1的生物学功能,IGFBP Ⅰ/Ⅱ的下降促进了IGF-1与IGF-1R结合并激活下游一系列信号转导通路如MAPK/Ras,PI3K/AKT等并最终促进肿瘤形成。除此以外胰岛素本身作为一种多功能蛋白质激素,除了调节人体物质代谢之外、也是细胞生长因子家族成员,有促进细胞增殖、抑制凋亡的作用[17-18]。
本研究还发现腺瘤性息肉组患者与对照组相比C-肽、空腹血糖水平高,差异有统计学意义(P<0.05),Logistic多因素回归分析得出结肠息肉患病风险与C-肽、胰岛素抵抗水平正相关,国外学者做过胰岛素和胰岛素抵抗与结直肠腺瘤相关性的研究,但结论不一致,本研究结果与大多数学者结果一致,土耳其学者Demir等[19]得出结直肠腺瘤患者的空腹血胰岛素和IR明显高于正常组(P=0.02,P= 0.02)。韩国学者Kim等[12]得出胰岛素表达最高组是最低组患结肠息肉风险的1.42倍(OR:1.42,P<0.05);胰岛素抵抗最高组患结肠息肉的风险是最低组的1.45倍(OR:1.45,P<0.05)。Ortiz等[20]也报道IR最高组患结肠腺瘤性息肉的风险是IR最低组的2.11倍。当然Nishii等[21]并未发现结肠腺瘤人群与正常人群的空腹血胰岛素水平有不同;而Yamamoto等[8]的小样本研究未发现IR和结肠腺瘤性息肉之间有任何相关性。究其原因与研究的实验设计不同,纳入的样本量不同,对照患者是否全部通过结肠镜检查以及是否有家族遗传史等等因素有关。而我们的研究对照患者全部通过肠镜检查,并且为排除糖尿病对检查结果的影响进行了糖尿病患者和非糖尿病患者的亚组分析,另外,我们分析检测的项目除了胰岛素、空腹血糖外,还检测了C-肽,它比胰岛素更加稳定,更能反映胰岛的分泌能力,所以取代空腹胰岛素水平成为了我们这项研究中可靠的、有意义的结直肠癌风险因素之一。据文献检索,这是国内第一个同时比较肠癌、癌前病变、正常患者3组的代谢相关数据,分析其与结直肠肿瘤相关性的研究报道。
综上所述,本研究显示高血清C-肽、空腹血糖水平以及胰岛素抵抗明显增加了结肠腺瘤性息肉和结肠癌的患病风险。所以改善胰岛素敏感性,减少糖尿病患病率对于预防结直肠癌具有重要意义。
[1]Kang HW,Kim D,Kim HJ,et al.Visceral obesity and insulin resistance as risk factors for colorectal adenoma:a crosssectional,case-control study[J].Am J Gastroenterol,2010,105(1):178-187.
[2]Fung T,Hu FB,Fuchs C,et al.Major dietary patterns and the risk of colorectal cancer in women[J].Arch Intern Med,2003,163(3):309-314.
[3]Vogelstein B,Fearon ER,Hamilton SR,et al.Genetic alterations during colorectal tumor development[J].N Engl J Med,1988,319(9):525-32.
[4]Giovaimucci E.Insulin and colon cancer[J].Cancer Cause Control,1995,6(2):164-179.
[5]Tran TT,Naigamwalk D,Oprescu AI,et al.Hyperinsulinemia,but not other factors associated with insulin resistance,acutely enhances colorectal epithelial proliferation in vivo[J].Endocrinology,2006,147(4):1830-1837.
[6]Sridhar SS,Goodwin PJ.Insulin-insulin-like growth factor axis and colon cancer[J].J Clin Oncol,2009,27(2):165-167.
[7]Ortiz AP,Thompson CL,Chak A,et al.Insulin resistance,central obesity,and risk of colorectal adenomas[J].Cancer,2012,118(7):1774-1781.
[8]Yamamoto S,Nakagawa T,Matsushita Y,et al.Visceral fat area and markers of insulin resistance in relation to colorectal neoplasia[J].Diabetes Care,2010,33(1):184-189.
[9]Oh TH,Byeon JS,Myung SJ,et al.Visceral obesity as a risk factor for colorectal neoplasm[J].J Gastroenterol Hepatol,2008,23(3):411-417.
[10]Sasaki Y,Takeda H,Sato T,et al.Serum Interleukin-6,insulin,and HOMA-IR in male individuals with colorectal adenoma[J].Clin Cancer Res,2012,18(2):392-399.
[11]Renehan AG,Tyson M,Egger M,et al.Body-mass index and incidence of cancer:a systematic review and metaanalysis of prospective observational studies[J].Lancet,2008,371(9612):569-578.
[12]Kim EH,Kim HK,Bae SJ,et al.Fasting serum insulin levels and insulin resistance are associated with colorectal adenoma in Koreans[J].J Diabetes Invest,2014,5(3):297-304.
[13]Schoen RE,Tangen CM,Kuller LH,et al.Increased blood glucose and insulin,bodysize,and incident colorectal cancer[J].J Natl Cancer Inst,1999,91(13):1147-1154.
[14]Palmqvist R,Stattin P,Rinaldi S,et al.Plasma insulin,igfbinding proteins-1 and-2 and risk of colorectal cancer:a prospective study in northern sweden[J].Int J Cancer,2003,107(1):89-93.
[15]Giovannucci E.Metabolic syndrome,hyperinsulinemia,and colon cancer:a review[J].Am J Clin Nutr,2007,86 (3):836-842.
[16]Gonullu G,Kahraman H,Bedir A,et al.Association between adiponectin,resistin,insulin resistance,and colorectal tumors[J].Int J Colorectal Dis,2010,25(2):205-212.
[17]Kelesidis I,Kelesidis T,Mantzoros CS.Adiponectin and cancer:a systematic review[J].Br J Cancer,2006,94(9):1221-1225.
[18]Sikalidis AK,Varamini B.Roles of hormones and signaling molecules in describing the relationship between obesity and colon cancer.Pathol Oncol Res,2011,17(4):785-790.
[19]Demir N,Ahshal E,Dolapcioglu C,et al.The relationship between serum adiponectin and resistin levels,insulin resistance and colorectal adenomas[J].Turk J Gastroenterol,2015,26(1):20-24.
[20]Ortiz AP,Thompson CL,Chak A,et al.Insulin resistance,central obesity,and risk of colorectal adenomas.Cancer,2012,118(7):1774-1781.
[21]Nishii T,Kono S,Abe H,et al.Glucose intolerance,plasma insulin levels,and colon adenomas in Japanese men [J].Jpn J Cancer Res,2001,92(8):836-840.
The role of C-peptide and insulin resistance in predicting colorectal cancer△
FENG Ying-ying LIU Quan-long ZHANG Bin YIN Shu-hui ZHANG Tao ZHAO Yu-juan DING Jian-hua#
Department of Colorectal Surgery,Second Artillery General Hospital,Beijing 100088
ObjectiveTo investigate the correlation between C-peptide,insulin resistance(IR)and colorectal carcinoma(CRC).MethodCRC patients(n=50),colorectal adenoma patients(n=27),and healthy control confirmed by colonoscopy(n=36)were enrolled in this study,the fasting serum insulin(FINS),C-peptide,fasting plasma glucose(FPG)and IR were statistically compared.ResultThe FINS,IR,C-peptide,and FPG were higher in CRC patients compared with those in control group(P<0.01);While the C-peptide and FPG in colorectal adenoma patients were significantly higher than that of the control group(P<0.05);Logistic regression analysis showed that,age,C-peptide,and FPG were associated with increased risk of colorectal cancer,while C-peptide and IR were correlated with the incidence of colorectal adenoma.ConclusionThere was a positive correlation between C-peptide,insulin resistance and the incidence of colorectal cancer or adenoma.
serum fasting insulin;insulin;C-peptide;colorectal carcinoma;colorectal adenoma
R735.3
A
10.11877/j.issn.1672-1535.2016.14.03.10
2015-11-25)
中国老年学学会,老年肿瘤专业委员会科研课题(CGOS-03-2013-1-1-01400)
(corresponding author),邮箱:jianhuading75@163.com
