KLF4基因沉默对大鼠肝星状细胞HSC-T6胶原代谢的影响及机制研究
2016-10-18李涛牛丽娟刘文宣杨磊李曼曹丹丹彭乱顺
李涛 牛丽娟 刘文宣 杨磊 李曼 曹丹丹 彭乱顺
·论著·
KLF4基因沉默对大鼠肝星状细胞HSC-T6胶原代谢的影响及机制研究
李涛牛丽娟刘文宣杨磊李曼曹丹丹彭乱顺
目的探讨大鼠KLF4基因沉默,对大鼠肝星状细胞HSC-T6胶原代谢的影响及其机制。方法设计并构建针对大鼠KLF4基因的3个干扰质粒(pGPU6-1,pGPU6-2,pGPU6-3)以及阴性对照。采用实时荧光定量RT- PCR(Real-time RT- PCR )和western blot的方法分析KLF4 mRNA和蛋白的表达情况,筛选出沉默最好的干扰质粒,将筛选出来的干扰质粒pGPU6-3,转染大鼠HSC-T6细胞。转染24 h和48 h后分别采用Real-time RT-PCR法和western blot的方法检测Ⅰ型胶原、Ⅲ型胶原、基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)、基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)mRNA和蛋白的表达。Real-time RT-PCR法以GAPDH为内参照,用2-ΔΔCt法进行分析计算。western blot的方法以β-actin蛋白为内参照,进行分析。结果Real-time RT- PCR结果显示,pGPU6-3转染大鼠HSC-T6细胞后,Ⅰ型胶原、Ⅲ型胶原和TIMP-1相对于对照组的mRNA表达分别下降为0.358±0.038,0.298±0.041和0.478±0.048; 而MMP-13 mRNA的表达则上升为1.712±0.034。Western Blot检测中,pGPU6-3转染大鼠HSC-T6细胞后,以β-actin为内参照,Ⅰ型胶原蛋白,Ⅲ型胶原蛋白和TIMP-1蛋白的表达分别下降为0.326±0.051,0.283±0.074和0.331±0.039;而MMP-13蛋白的表达则上升为1.273±0.038。结论KLF4基因沉默可以显著减少大鼠HSC-T6细胞Ⅰ型胶原和Ⅲ型胶原的表达,其机制与增加MMP-13表达,而抑制TIMP-1的表达有关。
人肝星状细胞;KLF4;Ⅰ型胶原;Ⅲ型胶原;MMP-13
肝纤维化的本质是由于细胞外基质(extracellular matrix,ECM)的合成与降解不平衡所导致ECM的过度沉积。正常肝脏中ECM的主要成份是Ⅰ型胶原(collagen Ⅰ,Col Ⅰ)和Ⅲ型胶原(collagen Ⅲ,Col Ⅲ),其他胶原所占比例较少[1]。而肝星状细胞(hepatic stellate cells, HSCs) 是肝脏中的ECM的主要合成细胞,同时,HSCs还能分泌多种胶原酶和基质金属蛋白酶(matrix metalloproteinase,MMP)以降解ECM,同时分泌基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)防止胶原过度降解,使肝脏ECM的合成和分解处在一个动态平衡中[2]。KLF4是Krüppel样因子(Krüppel-like factors,KLFs)家族的重要成员,具有调节某些细胞的增殖、分化以及凋亡等重要功能[3]。那么,KLF4基因沉默是否会对HSCs的胶原的代谢产生影响?本研究将筛选出沉默效果最好的干扰质粒,转染大鼠HSC-T6细胞,观察KLF4沉默是否可以对HSCs的胶原代谢及其相关酶类产生影响。
1 材料与方法
1.1主要试剂大鼠肝星状细胞HSC-T6购自中南大学湘雅医院细胞中心;DMEM培养基、胎牛血清、胰蛋白酶、青链霉素购自美国GIBCO公司;Liprofectamine 2000、Trizol reagent购自美国Invitrogen公司;SYBR Green Real-Time试剂盒购自北京百泰克公司;M-mlV Reverse Transcriptase试剂盒购自美国GeneCopoeia公司;无内毒素质粒大提试剂盒 购自北京天根公司;兔抗大鼠TIMP-1多克隆抗体购自美国abcam公司;兔抗大鼠MMP-13、兔抗大鼠Ⅰ型胶原多克隆抗体购自美国GeneTex公司、兔抗大鼠Ⅲ型胶原多克隆抗体购自美国Santa Cruz公司;兔抗大鼠KLF4、β-actin单克隆抗体购自美国epitomics公司;IRDye800 Anti-Rabbit IgG购自美国Rockland公司。
1.2方法
1.2.1参考Genbank中的大鼠KLF4的基因序列,依据siRNA设计原则,分别设计3对siRNA序列,使用BLAST将选定的序列和相应的大鼠基因组数据库进行比较,排除与其他编码序列同源的序列。同时,设计一条阴性对照dsRNA。利用含U6启动子的pGPU6/GFP/Neo表达质粒,构建其RNA干扰重组体。交由上海吉玛制药技术有限公司构建。干扰质粒pGPU6-1靶序列:GGACCTAGACTTTATCCTTTC;干扰质粒pGPU6-2靶序列:GGTCATCAGTGTTAGCAAAGG;干扰质粒pGPU6-3靶序列:GGAACTCTCTCACATGAAGCG;干扰质粒pGPU6阴性对照靶序列: GTTCTCCGAACGTGTCACGT。
1.2.2细胞培养:在37℃,5% CO2培养箱中,用含12%胎牛血清的DMEM培养基常规培养HSC-T6细胞。当细胞生长至合适汇合度时用0.25%胰蛋白酶消化细胞,进行传代培养,待细胞处于对数生长期时用于实验。
1.2.3干扰质粒瞬时转染大鼠HSC-T6细胞:用天根公司质粒抽提试剂盒将构建好的干扰载体重组质粒从保存菌DH5a中抽提出来,根据试剂说明,转染前1 d将细胞接种至6孔板,在转染前6 h更换为无抗生素的Opti-MEM培养基,至70%汇合度时转染。根据lipofectamine 2000的Protocol分别配置A, B液,溶液A:用Opti-MEM培养基稀释干扰质粒到总体积50 μl。溶液B:用Opti-MEM培养基稀释4 μl脂质体到总体积50 μl,室温孵育5 min。混合溶液A和B,室温孵育20 min,将100 μl脂质体/DNA混合物加入6孔培养板内,置于5% CO2,37℃培养箱孵育6 h,然后更换为2 ml含10%小牛血清的新鲜DMEM生长培养基。于转染后24 h和48 h提取RNA和蛋白进行检测。
1.2.4Real time RT-PCR检测HSC-T6中KLF4、Col Ⅰ、Col Ⅲ、MMP-13、TIMP-1mRNA的表达转染干扰质粒24 h后用PBS清洗细胞,每孔加入1 ml Trizol,充分裂解,将裂解液转至EP管中,加入200 μl氯仿;4℃,12 000 r/min离心15 min,把上层无色液相移入新的EP管,加入等体积异丙醇,颠倒混匀,室温静置30 min;4℃,12 000 r/min离心10 min,弃上清;加入1 ml 75%乙醇,洗涤沉淀;4℃,5 000 r/min离心3 min,倒出液体;室温晾干,加入DEPC水20 μl溶解。将细胞总RNA 2 μg,采用M-mlV Reverse Transcriptase试剂盒进行反转录,使用SYBR Green Real-Time试剂盒,对反转录所获得的cDNA进行Real time RT-PCR检测,选取2 μl cDNA于20 μl反应体系中进行反应,反应在Rotor-GeneTM6000(Corbett)中进行,循环条件为94℃ 5 min,94℃ 15 s,55℃ 15 s,72℃ 15 s共35个循环。以GAPDH作为内参基因,采用Primer3.0软件,设计所需片段的扩增引物,由华大基因公司合成与纯化,序列如下: 大鼠KLF4上游引物序列:5’-GAACTGACCAGGCACTACCG-3’下游引物序列:5’-CTTGCTGGGAACTTGACCAT-3’;大鼠Col Ⅰ上游引物序列:5’- ATCTTTCTCCACGTTCGCGT-3’下游引物序列:5’- GGAAGTCGCTTCATGTGGGA-3’;大鼠Col III上游引物序列:5’- TGGTATCGTGGAAGGACTCA-3’下游引物序列:5’- CCAGTAGAGGCAGGGATGAT-3’;大鼠MMP-13上游引物序列:5’-AGGAGCATGGCGACTTCTAC-3’下游引物序列:5’-AGACCTAAGGAGTGGCCGAA-3’;大鼠TIMP-1上游引物序列:5’-CAAGTTCAACGGCACAGTCA-3’下游引物序列:5’-CCATTTGATGTTAGCGGGAT-3’;大鼠GAPDH上游引物序列:5’-CAAGTTCAACGGCACAGTCA-3’下游引物序列:5’-CCATTTGATGTTAGCGGGAT-3’,每个样本重复三次,取平均值为Ct值,用仪器自带软件进行荧光定量分析,计算出△Ct值,采用相对定量2-ΔΔCt法比较目的基因mRNA的表达变化。
1.2.5Western blot法检测HSC-T6中KLF4、Col Ⅰ、Col Ⅲ、MMP-13、TIMP-1及对照β-actin蛋白表达:转染干扰质粒 48 h后用PBS清洗细胞,加入适量RIPA裂解液,用细胞刮收获细胞裂解物,移入EP管;离心,12 000 g,15 min,取上清液加入2×loading buffer,100℃煮沸5 min,取上清待用。取细胞总蛋白80 μg,经10% SDS-PAGE凝胶120V电压进行电泳分离,之后电转移至PVDF膜上,将PVDF膜置于5%脱脂奶粉(0.05%TBST配制)中封闭1 h,分别加入兔抗大鼠KLF4 (1∶500稀释),兔抗大鼠TIMP-1(1∶1 000稀释),兔抗大鼠MMP-13(1∶1 000稀释)、兔抗大鼠Col Ⅰ(1∶1 500稀释)、兔抗大鼠Col Ⅲ(1∶500稀释)、兔抗大鼠β-actin(1∶3 000稀释)孵育PVDF膜,4℃过夜。TBST洗膜3次,每次10 min。利用TBS配制的红外染料标记的二抗 IRDye800 Anti-Rabbit IgG (1∶15 000 稀释)孵育PVDF膜,室温1 h。TBS洗膜3次,每次10 min。利用Odyssey扫描仪对PVDF膜进行扫描显影并保存图像。
2 结果
2.1干扰质粒对HSC-T6细胞KLF4的沉默效果3种干扰质粒(pGPU6-1,pGPU6-2,pGPU6-3)以及阴性对照分别转染HSC-T6细胞24 h后,应用Real-time RT-PCR检测HSC-T6中KLF4的mRNA表达情况。应用2-ΔΔCt法结果显示,pGPU6-1组、pGPU6-2组和pGPU6-3组相对于对照组的KLF4 mRNA的表达分别是0.601±0.043,0.548±0.051和0.282±0.027(P<0.05)。可见,pGPU6-3组对KLF4 mRNA的沉默效果最好。3种干扰质粒转染HSC-T6细胞后48h,应用western blot法检测HSC-T6中KLF4的蛋白表达情况。与内参蛋白β-actin相比, pGPU6-1组,pGPU6-2组和pGPU6-3组KLF4 蛋白表达分别是0.513±0.032,0.475±0.042和0.305±0.035(P<0.05)。与mRNA的结果类似,pGPU6-3组对KLF4 蛋白的沉默效果最好。故后续试验均采用干扰质粒pGPU6-3沉默KLF4的表达。见表1,图1。
2.2Real time RT-PCR检测HSC-T6中Col、Col Ⅲ、

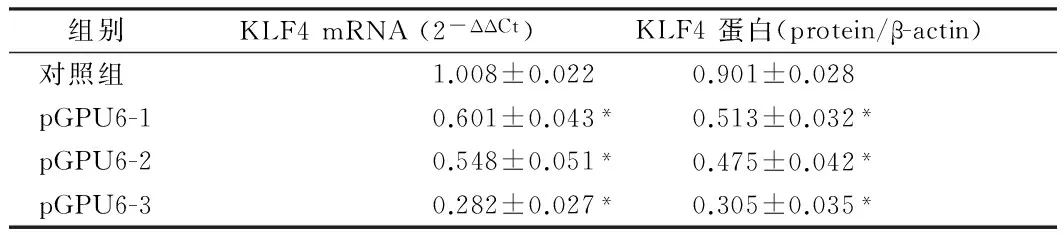
组别KLF4mRNA(2-ΔΔCt)KLF4蛋白(protein/β-actin)对照组1.008±0.0220.901±0.028pGPU6-10.601±0.043*0.513±0.032*pGPU6-20.548±0.051*0.475±0.042*pGPU6-30.282±0.027*0.305±0.035*
注:与对照组比较,*P<0.05
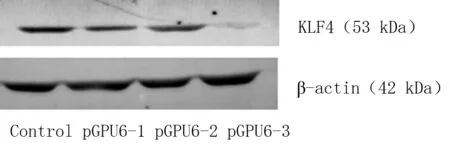
图1western blot检测转染三种干扰质粒 48 h后HSC-T6中KLF4的蛋白表达结果
mRNA以及western blot技术检测相应蛋白的表达 干扰质粒pGPU6-3转染HSC-T6细胞后24h,应用Real time RT-PCR检测HSC-T6中Col Ⅰ、Col Ⅲ的mRNA表达情况。以Control组为对照组,Col Ⅰ、Col Ⅲ相对于Control组的mRNA的表达分别是0.358 ±0.038,0.298±0.041(P<0.05)。与mRNA的结果类似,pGPU6-3转染HSC-T6细胞后48 h,应用western blot法检测HSC-T6中Col Ⅰ、Col Ⅲ的蛋白表达情况。以β-actin为内参照,Col Ⅰ,Col Ⅲ型胶原蛋白的表达分别下降为0.326±0.051和0.283±0.074(P<0.05)。见表2,图2。


组别ColⅠmRNAlevel(2-ΔΔCt)ColⅠ蛋白(protein/β-actin)ColⅢmRNAlevel(2-ΔΔCt)ColⅢ蛋白(protein/β-actin)对照组1.007±0.0130.998±0.0121.003±0.0120.995±0.023pGPU6-30.358±0.038*0.326±0.051*0.298±0.041*0.283±0.074*
注:与对照组比较,*P<0.05
2.3Real time RT-PCR检测HSCs中MMP-1、TIMP-1、MMP-13 mRNA以及Western blot技术检测相应蛋白的表达。pGPU6-3转染HSC-LX2细胞后24h,应用Real time RT-PCR检测HSC-T6中MMP-13、TIMP-1的mRNA表达情况。应用2-ΔΔCt法结果显示,以Control组为对照组,MMP-13、TIMP-1相对于Control组的mRNA的表达分别是1.712 ±0.034,0.478±0.048(P<0.05)见表3。与mRNA的结果类似,pGPU6-3转染HSC-T6细胞后48 h,应用western blot法检测HSC-T6中MMP-1、TIMP-1的蛋白表达情况,以β-actin为内参照,则MMP-1蛋白表达上升为1.273±0.038,而TIMP-1蛋白的表达下降为0.331±0.039(P<0.05)见表3,图3。

图2western blot检测转染pGPU6-3 48h后HSC-T6中ColI I、ColI III蛋白的表达结果

图3western blot检测转染pGPU6-3 48h后HSC-T6中MMP-13、TIMP-1蛋白的表达


组别MMP-13mRNAlevel(2-ΔΔCt)MMP-13proteinlevel(protein/β-actin)TIMP-1mRNAlevel(2-ΔΔCt)TIMP-1proteinlevel(protein/β-actin)对照组0.991±0.0130.812±0.0411.005±0.0170.791±0.044pGPU6-31.712±0.034*1.273±0.038*0.478±0.048*0.331±0.039*
注:与对照组比较,*P<0.05
3 讨论
肝纤维化过程中,一个重要的特征就是新合成的ECM增加速度超过了ECM的降解速度。实际上,肝纤维化的本质就是由于 ECM合成与降解不平衡所导致ECM的过度沉积[1]。正常肝脏中ECM的主要成份是Col Ⅰ和Col Ⅲ,且以Col I的增加为主,Col Ⅰ的含量可以达到60%~70%,其他胶原所占比例较少。另外也包含一些非胶原成分,例如纤连蛋白,层连蛋白等成分[4]。这些ECM不断地被基质降解蛋白酶类分解,维持动态的平衡。肝星状细胞HSCs是正常及纤维化肝脏中的ECM的主要合成细胞,其合成量是肝细胞的10倍、内皮细胞的20倍以上[5]。同时,HSCs还能够分泌多种酶类来调节ECM的代谢。这些蛋白酶中最重要的是MMP。MMP能够降解除多糖外的所有ECM。按其结构和功能的差异,MMP共可分为四类[6]:第一类是间质胶原酶(MMP-1,MMP-13等),主要水解Col Ⅰ和Col Ⅲ等纤维类胶原,在维持ECM的平衡中起着关键作用;第二类是明胶酶(MMP-2,MMP-9),主要水解明胶蛋白和变性胶原蛋白;第三类是基质水解酶(MMP-3,MMP-10等),主要水解糖蛋白和Col IV等。第四类是基膜型酶(MMP-7,MMP-12,MMP-12等),具有激活其他MMP的作用。MMP的活性受三个水平的调节,即转录水平、胶原激活以及基质金属蛋白酶抑制剂(tissue inhibitor of metalloproteinase,TIMP)的调节。TIMP家族共有四个成员TIMP-1,TIMP-2,TIMP-3,TIMP-4,而肝脏中只有TIMP-1和TIMP-2,且TIMP-1 活力最强。TIMPs以1∶1的比例与MMPs形成高亲和力复合物,抑制MMPs的活性,从而增加ECM的沉积[7]。研究表明,在大鼠肝纤维化自发恢复的模型中,MMP-13的表达水平是升高的,而TIMP-1的表达水平是逐渐下降的。相反,研究发现如果提高TIMP-1的表达,减少MMP-13的表达,可以使大鼠的纤维化程度加深[8]。所以,如何在纤维化的肝脏中增加MMP-1以及大鼠中的MMP-13的表达,或者减少TIMP-1的表达,来减少肝纤维化中胶原的产生,减轻肝纤维化,已经成为肝纤维化研究中的热点问题。例如,Hu等采用腺病毒载体将针对纤溶酶原激活物抑制剂-1基因的shRNA转导入纤维化大鼠体内,发现与对照组相比,肝纤维化程度明显减轻。进一步研究发现其作用机制可能是通过上调MMP-13水平,而下调TIMP-1水平[9]。Ozaki等将肝细胞生长因子加入人HSC-LI90细胞中,发现ColI表达量明显减少,其机制可能是由于MMP-1表达量增加,促进了胶原的降解[10]。
与上述研究类似,因为KLF4是Krüppel样因子(Krüppel-like factors,KLFs)家族的重要成员,具有调节某些细胞的增殖、分化以及凋亡等重要功能[3],故本研究设计合成了针对大鼠靶向KLF4的RNA干扰质粒载体,并筛选出沉默效果最好的干扰质粒载体,通过沉默KLF4表达,使大鼠HSC-T6细胞的Col I和ColIII的表达明显下降,同时MMP-13的表达增高以及TIMP-1的表达下调。综上所述,KLF4是通过上调MMP-13以及下调TIMP-1的表达来调节HSC-T6的胶原合成与代谢,降低了肝纤维化的程度,为肝纤维化的防治提供了新的研究方向。
1Lade A, Noon LA, Friedman SL. Contributions of metabolic dysregulation and inflammation to nonalcoholic steatohepatitis, hepatic fibrosis, and cancer.Curr Opin Oncol,2014,26:100-107.
2Puche JE, Saiman Y, Friedman SL. Hepatic Stellate Cells and Liver Fibrosis.Compr Physiol,2013,3:1473-1492.
3Wang C,Han M,Zhao XM, et al. Krüppel-like factor 4 is required for the expression of vascular smooth muscle cell differentiation marker genes induced by all-trans retinoic acid. J Biochem,2008,144: 313-321.
4Bittnerová1 L, Jiroutová1 A, Rudolf E, et al. Effect of collagen I gel on apoptosis of rat hepatic stellate cells. Acta Medica,2013,56: 73-79.
5Kordes C, Sawitza I, Götze S, et al. Hepatic stellate cells contribute to progenitor cells and liver regeneration. J Clin Invest,2014,124:5503-5515.
6Murphy FR, Issa R, Zhou X, et al. Inhibition of apoptosis activated hep atic stellate cells by tissue inhibitor of metalloproteinase-1 is mediated via effects on matrix metalloproteinase inhibition: implications for reversibility of liver fibrosis.J Biol Chem,2002,277:11069-11076.
7Hasegawa-Baba Y, Doi K. Changes in TIMP-1 and -2 expression in the early stage of porcine sennn-indncedliver fibrosis in rats.Exp Toxicol Patbol,2011,63 :357-361.
8Yoshiji H, Kuriyanta S, Miyamoto Y,et al.Tissuc inhibitor mctalloprotcinasc-1 promotes liver fibrosis development a transonic mouse model.Hepatology 2000,32:1248-1254.
9Hu PF, Chen H, Zhong W, et al. Adenovirus-mediated Transfer of siRNA against PAI-1 mRNA ameliorates hepatie fibrosis in rats. Journal of Hepatology,2009,51:102-113.
10Ozaki I, Zhao G, Mizuta T, et al. Hepatocyte growth factor induces collagenase (matrix metalloproteinase-1) via the transcription factor Ets-1 in human hepatic stellate cell line.Journal of Hepatology,2002,36:169-178.
Effects and action mechanism of KLF4 gene silence on collagen metabolism in hepatic stellate cells of rats
LITao*,NIULijuan,LIUWenxuan*,etal.
*DepartmentofEpidemiologyandHealthStatistics,SchoolofPublicHealth,HebeiMedicalUniversity,Shijiazhuang050017,China
ObjectiveTo investigate the effects of silencing KLF4 expressions on collagen metabolism in hepatic stellate cells-T6 (HSC-T6) of rats.MethodsThe three interference plasmids (pGPU6-1,pGPU6-2,pGPU6-3) targeting at KLF4 gene of rats and negative control plasmid were designed and established.The expression levels of KLF4 mRNA and protein were detected by real time fluorescent quantitation RT- PCR (Real-time RT- PCR) and Western Blot to select out the interference plasmid that had the best silencing effects. Then the interference plasmid (pGPU6-3) was transfected into HSC-T6 cells of rats.On 24h and 48h after transfection, the expression levels of typeⅠcollagen,type Ⅲ collagen,matrix metalloproteinase-13 (MMP-13), tissue inhibitor of metalloproteinase-1 (TIMP-1) mRNA and protein were detected by Real-time RT- PCR and Western Blot,respectively. Real-time RT-PCR data were analyzed and calculated by 2-ΔΔCtmethod by taking GAPDH as an internal reference,however, Western Blot examination results were analyzed by using β-actin as internal reference protein.ResultsThe examination results by Real-time RT- PCR showed that after HSC-T6 cells of rats were transfected by pGPU6-3, the expression levels of typeⅠcollagen,type Ⅲ collagen and TIMP-1 were decreased by 0.358±0.038,0.298±0.041, 0.478±0.048, respectively, however, the expression levels of MMP-13 mRNA were increased by 1.712±0.034. The Western Blot showed that after HSC-T6 cells of rats were transfected by pGPU6-3, the expression levels of typeⅠcollagen,type Ⅲ collagen and TIMP-1 were decreased by 0.326±0.051,0.283±0.074,0.331±0.039,respectively,however, the expression levels of MMP-13 were increased by 1.273±0.038.ConclusionThe KLF4 gene silencing can significantly decrease the expression levels of typeⅠcollagen and type Ⅲ collagen in HSC-T6 cells of rats,and its action mechanism may be correlated to increasing the expressions of MMP-13 and inhibiting the expressions of TIMP-1.
rat hepatic stellate cells; KLF4;typeⅠcollagen;type Ⅲ collagen;MMP-13
10.3969/j.issn.1002-7386.2016.20.009
050017石家庄市,河北医科大学公共卫生学院流行病与卫生统计学教研室(李涛、刘文宣、杨磊、李曼、曹丹丹);河北省石家庄市第三医院肿瘤科(牛丽娟);河北省石家庄市第三医院老年病科(彭乱顺)
彭乱顺,050011河北省石家庄市第三医院老年病科;
E-mail:litao771018@163.com
R 575.2
A
1002-7386(2016)20-3080-05
2016-03-29)
项目来源:河北省医学科学研究重点课题计划(编号:20150627)
