应用RNA干扰技术下调ANXA3表达的MDA-MB-231乳腺癌细胞株的建立
2016-10-18周涛杨丽刘亮巨英超
周涛 杨丽 刘亮 巨英超
·论著·
应用RNA干扰技术下调ANXA3表达的MDA-MB-231乳腺癌细胞株的建立
周涛杨丽刘亮巨英超
目的建立针对膜联蛋白A3(Annexin A3, ANXA3)的shRNA稳定转染的乳腺癌细胞株MDA-MB-231,为后续进一步研究奠定基础。方法荧光定量RT-PCR及western blot方法检测两种乳腺癌细胞株(MDA-MB-231及MCF-7)中ANXA3 mRNA及蛋白表达水平。构建沉默ANXA3基因的shRNA质粒3个(ANXA3-sh1-3)及阴性对照质粒,脂质体法转染人乳腺癌细胞MDA-MB-231;选出ANXA3沉默效果最好的干扰质粒做后续实验。嘌呤霉素筛选出稳定转染细胞;Western blot方法检测转染后细胞中ANXA3蛋白表达水平。结果MDA-MB-231细胞中ANXA3 mRNA 及蛋白表达水平显著高于MCF-7中的表达(P<0.05);成功构建3个针对ANXA3基因的shRNA质粒;转染ANXA3-sh1~3及阴性对照质粒后MDA-MB-231细胞中ANXA3 mRNA表达水平分别为(0.0196±0.0002)、(0.0085±0.0002)、(0.0220±0.0035)、(0.0661±0.0057),未转染的MDA-MB-231细胞中ANXA3 mRNA表达水平为(0.0692±0.0050),脂质体组MDA-MB-231细胞中ANXA3 mRNA表达水平为(0.0652±0.0118),ANXA3-sh2对MDA-MB-231细胞中ANXA3 mRNA沉默效率最高,达87.72%,因此后续实验选择ANXA3-sh2;嘌呤霉素筛选出稳定转染细胞分别命名为MDA-MB-231-Sh及MDA-MB-231-NC细胞。Western blot检测结果显示,MDA-MB-231-Sh细胞中ANXA3蛋白显著低于MDA-MB-231及MDA-MB-231-NC细胞中的表达(P<0.01)。结论MDA-MB-231细胞较MCF-7细胞高表达ANXA3,成功的建立了稳定下调ANXA3表达的乳腺癌细胞株MDA-MB-231,为后续进一步研究ANXA3的表达及特性打下基础。
乳腺癌;RNA干扰;膜联蛋白A3;转染
乳腺癌是女性最常见的恶性肿瘤之一,其发病率逐年上升,在欧美国家乳腺癌占女性恶性肿瘤的25%~30%,在我国乳腺癌发病率已上升为女性恶性肿瘤第一位。乳腺癌的侵袭转移及复发是影响患者生存期及生活质量的重要因素,探讨乳腺癌发生发展、浸润转移及复发机制,对治疗乳腺癌和提高患者生存率具有决定性的意义。膜联蛋白家族属于Ca2+调节的磷脂和膜结合蛋白[1,2]。在细胞中参与膜转运及膜表面一系列依赖于钙调蛋白的活动,并调控炎症反应、细胞分化和细胞骨架蛋白间的相互作用,其表达失调与人类疾病相关,膜联蛋白在肿瘤的发生发展中可介导细胞信号通路、细胞运动、肿瘤的侵袭转移、细胞凋亡及抗药性[3-6]。膜联蛋白A3(Annexin A3, ANXA3)在肿瘤的形成、细胞增殖、凋亡、侵袭转移及耐药方面起着重要的作用[7,8]。但ANXA3在乳腺癌中的作用及功能仍未阐明,本研究主要采用RNAi技术筛选针对ANXA3的高效shRNA序列,并将其转染乳腺癌细胞株MDA-MB-231,建立稳定下调ANXA3表达的乳腺癌细胞株MDA-MB-231,为阐明ANXA3在乳腺癌发生发展及侵袭转移机制提供实验基础。
1 材料与方法
1.1材料
1.1.1细胞株:MDA-MB-231及MCF-7细胞株本实验室传代培养。接种细胞于含10%胎牛血清的PRMI1640培养基中(补充青霉素、链霉素各100 U/L),培养器皿置于37℃含5%CO2的细胞培养箱中。
1.1.2主要试剂及仪器:LipofectamineTM2000(Invintrogen,美国);PVDF膜、琼脂糖(Bio-Rad,美国);RPMI-1640培养基、BSA (Sigma,美国);引物(上海生工,中国); 高纯度质粒小提中量试剂盒(天根生化科技有限公司,中国);RNA isolater total RNA extraction reagent、HiScript Ⅱ 1st Strand cDNA Synthesis Kit、qPCR SYBR Green Master mix试剂(Vazyme,中国);Annexin V-PE/7-AAD试剂盒、MatrigelTM Matrix Basement Membrane(BD公司,美国);Transwell 3422(Corning公司,美国);Epics-XL型流式细胞仪(Beckman Coulter公司,美国);PCR仪(Eppendorf,德国);Mx3000P荧光定量PCR仪(Agilent,美国)。
1.2方法
1.2.1荧光定量RT-PCR检测MDA-MB-231及MCF-7细胞中ANXA3 mRNA表达水平:取生长状态良好处于对数生长期的MDA-MB-231及MCF-7细胞,冷PBS洗涤2次,加入1ml RNA isolater试剂,常规一步法提取总RNA。按照说明书进行反转录为cDNA,以cDNA为模板进行PCR扩增。Human GAPDH作为内参,进行标准化。按照标准的real-time PCR流程执行,采用SYBR-Green Ⅰ作为荧光染料,每个样品重复3次。ANXA3 上游引物5’-TCC GAA ACA TCT GGT GAC-3’, ANXA3 下游引物3’-TCA AGT TCT TCG TAA TAC CGA T-5’。内参GAPDH上游引物3’-CACTACCGTACCTGACACCA-5’,GAPDH下游引物 3’-ATGTCGTTGTCCCACCACCT-5’。应用2-ΔCt值法计算ANXA3 mRNA的相对表达量,ΔCt= ANXA3 CT值-GAPDH CT值。
1.2.2western blot方法检测MDA-MB-231及MCF-7细胞中ANXA3 蛋白表达水平:取生长状态良好处于对数生长期的MDA-MB-231及MCF-7细胞,冷PBS洗涤2次,用细胞裂解液提取细胞总蛋白,BCA方法检测蛋白浓度。10% SDA-PAGE 分离,上样量为 50 μg/孔,转移蛋白质至PVDF膜上,5%脱脂奶粉4℃封闭过夜,加入1∶500稀释的鼠抗人ANXA3单抗或 1∶4 000稀释的兔抗人β-actin单抗室温孵育1 h,膜洗3次,加入1∶20 000稀释的荧光标记的二抗,室温孵育2 h,用红外成像显影,以β-actin为内参照分析ANXA3蛋白相对表达量。实验重复3次。
1.2.3慢病毒干扰载体构建:RNAi慢病毒载体使用pGmlV-SC5,通过限制性内切酶 BamH I(GGATCC)和EcoR I(GAATTC)使载体线性化,连接入目的RNAi sequence,构建为带有目的RNAi序列的慢病毒载体。①shRNA靶点的选择:针对ANXA3基因序列,利用公用网站中提供的RNA干扰序列设计原则,设计多个RNA干扰靶点序列,根据设计经验和设计软件进行评估测定,选择最佳的动力学参数靶点进入后续实验流程。②shRNA引物的设计:据基因序列分别设计并合成shRNA寡聚单链DNA,oligo序列见表2。③RNAi慢病毒重组质粒的构建:将寡聚单链DNA退火成双链,将双链的shRNA oligo分别插入到shRNA慢病毒载体中,构建shRNA慢病毒重组质粒,并转化至感受态细胞DH5。挑取若干个单菌落,进行小量摇菌培养。测序鉴定阳性克隆。测序证实重组质粒构建成功后,摇菌抽提质粒,测定质粒浓度后,-20℃保存备用。见表1。
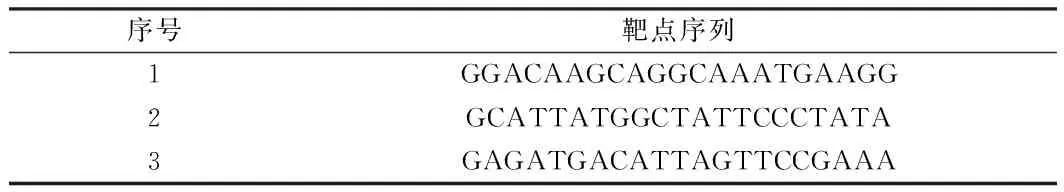
表1 ANXA3基因的shRNA靶点
1.2.4表达小发夹RNA(small hairpin RNA, shRNA)的质粒转染乳腺癌MDA-MB-231细胞沉默ANXA3基因:①细胞转染液配制:A试剂1∶6 μl Lipofectamine TM 2000脂质体与244 μl无牛清及抗生素的RPMI1640 培养液混合,室温放置5 min。B试剂2∶10 μl shRNA质粒(含4 μg质粒;ANXA3-sh1~3及阴性对
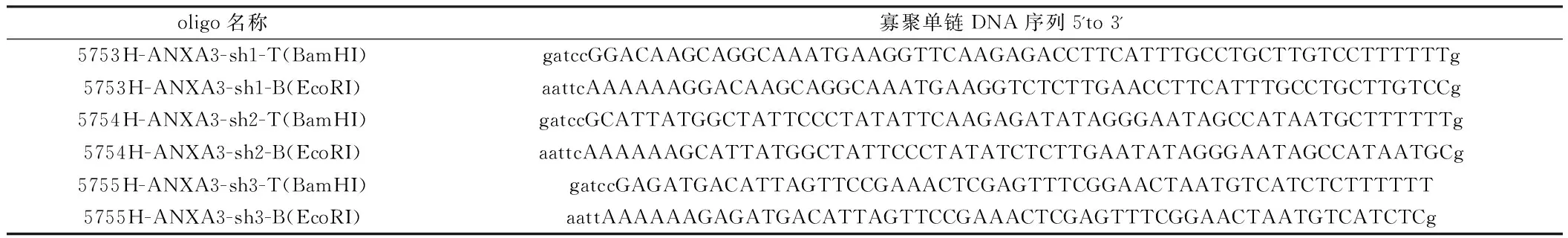
表2 shRNA oligo序列
照质粒)与240 μl无牛清及抗生素的RPMI1640 培养液混合,室温放置5min。②细胞转染步骤如下:取对数生长期的MDA-MB-231细胞4×105个/孔接种于6孔板中,细胞贴壁后待融合度达到85%~90%时,进行细胞转染,加转染试剂前用无血清及抗生素的RPMI-1640,培养液冲洗细胞2遍,每孔加2 ml无牛清及抗生素的RPMI-1640培养液,试剂1与试剂2混合(动作轻柔),室温放置20 min后加入6孔板每孔中,6 h后换全培养基,转染48 h后用荧光显微镜观察。同时设置未转染的空白组细胞及只加脂质体的脂质体组。
1.2.5qRT-PCR检测转染细胞中ANXA3 mRNA表达:细胞转染48 h后,收集细胞,PBS洗涤细胞2次,具体操作步骤同1.2.1,应用2-ΔCt值法计算ANXA3 mRNA的相对表达量,ΔCt= ANXA3 CT值-GAPDH CT值,评估siRNA ANXA3表达质粒转染后对ANXA3基因的沉默效果,选出沉默效果最佳的干扰质粒。实验重复3次。
1.2.6嘌呤霉素筛选稳定转染细胞:经过实验验证,ANXA3-sh2质粒沉默ANXA3表达效果最佳,因此后续的siRNA实验选择ANXA3-sh2质粒。MDA-MB-231细胞转染ANXA3-sh2重组质粒及阴性对照质粒48 h后,将细胞用RPMI1640培养液按1∶10比例稀释,以5×104/孔细胞加入6孔板中,向6孔板中加入筛选浓度的嘌呤霉素(600 ng/ml)。未转染的MDA-MB-231细胞作为对照组。培养14 d,存活的细胞即为稳定转染的细胞。转染ANXA3-sh2的细胞命名为MDA-MB-231-sh,转染阴性对照(Negative control,NC)质粒的细胞命名为MDA-MB-231-NC。MDA-MB-231-sh 及MDA-MB-231-NC细胞在含300 ng/ml嘌呤霉素的全培养基中培养。
1.2.7western blot 方法检测转染细胞中ANXA3蛋白表达:取生长状态良好处于对数生长期的MDA-MB-231、MDA-MB-231-NC及MDA-MB-231-sh 细胞,冷PBS洗涤2次后如方法1.2.2进行western blot检测。

2 结果
2.1荧光定量RT-PCR及Western blot检测MDA-MB-231及MCF-7细胞中ANXA3 mRNA及蛋白表达水平MDA-MB-231细胞ANXA3 mRNA相对表达量为(0.0696±0.0248)与MCF-7细胞ANXA3 mRNA相对表达量(0.0236±0.0149)相比显著增高(P<0.01)。MDA-MB-231细胞ANXA3 蛋白相对表达量显著高于MCF-7细胞中ANXA3蛋白相对表达量(P<0.01)。基因及蛋白表达趋势相一致。见图1、2。
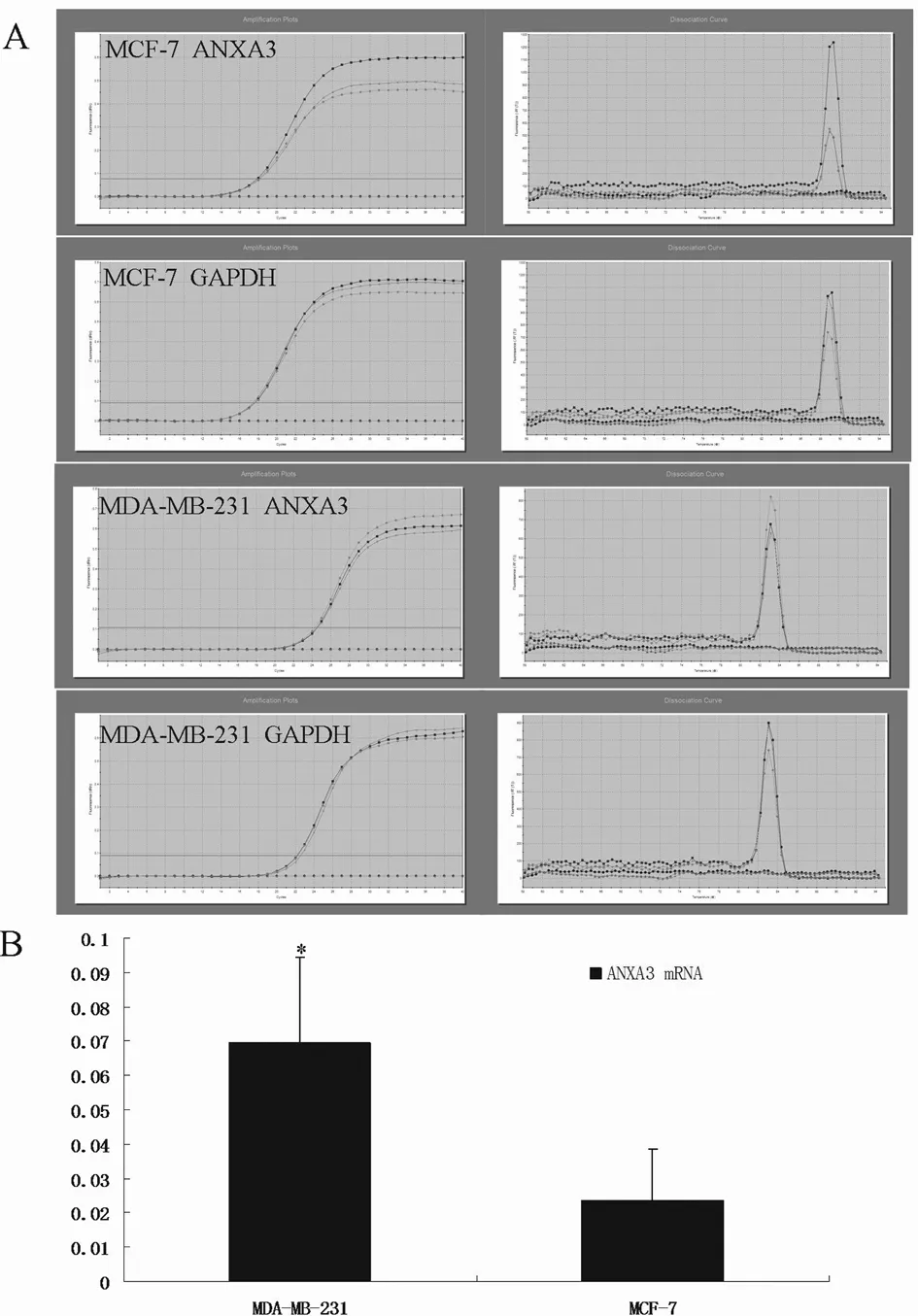
图1荧光定量RT-PCR检测MDA-MB-231及MCF-7细胞中ANXA3 mRNA表达水平
注:A:荧光定量RT-PCR检测MDA-MB-231及MCF-7细胞ANXA3及GAPDH的扩增曲线及溶解曲线。B:与MCF-7细胞中ANXA3 mRNA表达水平比较,*P<0.05
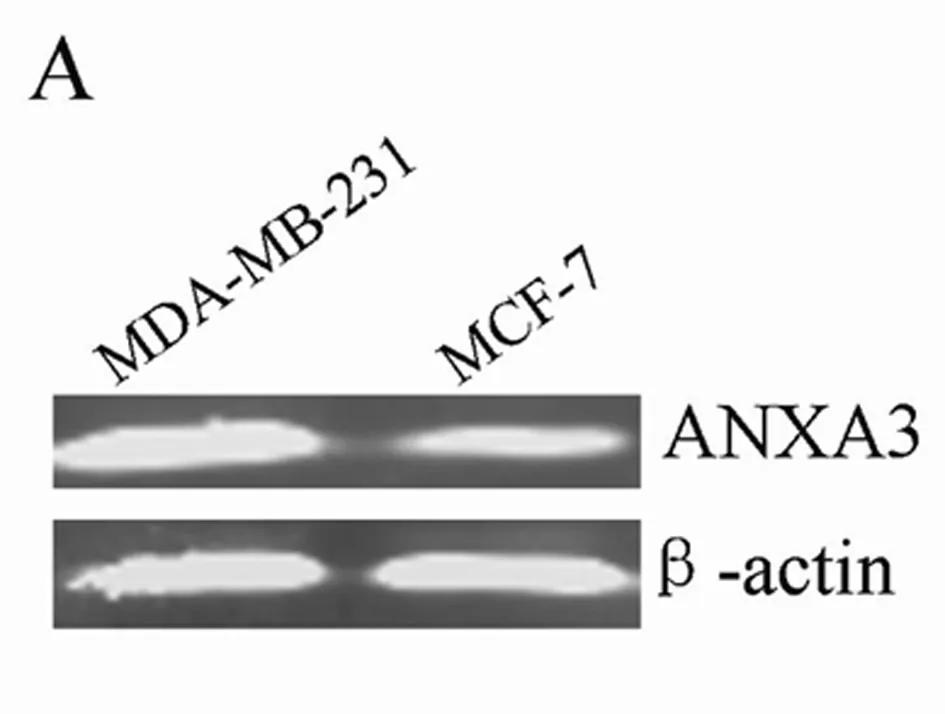
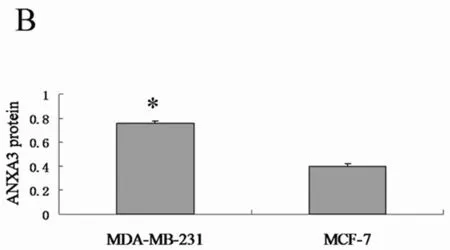
图2Western blot 检测MDA-MB-231及MCF-7细胞中ANXA3 蛋白表达水平
注:A:Western blot 检测乳腺癌细胞中ANXA3 蛋白表达,显示,MDA-MB-231细胞中ANXA3 蛋白表达高于MCF-7细胞中的表达;B:与MCF-7细胞中ANXA3 mRNA表达水平比较,*P<0.05
2.2shRNA慢病毒干扰载体构建成功构建了慢病毒干扰载体。shRNA干扰载体的测序结果经过比对,重组克隆中插入片段序列与设计的oligo序列完全一致,因此慢病毒载体构建成功。见表3,图3。
2.3荧光定量RT-PCR检测转染细胞中ANXA3 mRNA表达水平转染H_ANXA3-sh1、H_ANXA3-sh2、H_ANXA3-sh3及阴性对照质粒的MDA-MB-231细胞ANXA3 mRNA表达水平分别为,(0.0196±0.0002)、(0.0085±0.0002)、(0.0220±0.0035)、(0.0661±0.0057)ANXA3 mRNA表达水平分别为(0.0692±0.0050)、(0.0652±0.0118)。转染H_ANXA3-sh2的MDA-MB-231细胞ANXA3 mRNA表,空白组及脂质体组MDA-MB-231细胞达水平显著低于其他组中ANXA3 mRNA表达水平(P<0.05)提示,H_ANXA3-sh2对MDA-MB-231细胞ANXA3沉默效果最后,后续实验选用H_ANXA3-sh2进行细胞转染。见图4。
2.4嘌呤霉素筛选稳定转染细胞600 ng/ml嘌呤霉素筛选细胞14 d后,空白组细胞全部死亡,转染ANXA3-sh2及阴性对照(Negative control,NC)质粒的细胞中有大量细胞存活,存活的细胞即为筛选出来的稳定转染细胞,转染ANXA3-sh2的细胞命名为MDA-MB-231-Sh,转染NC质粒的细胞命名为MDA-MB-231-NC。见图5。
2.5western blot 检测转染细胞中ANXA3 蛋白表达水平检测结果显示,MDA-MB-231-Sh细胞中高于ANXA3 蛋白表达量显著低于MDA-MB-231-NC及MDA-MB-231细胞中的表达量(P<0.01)。见图6。
3 讨论
Annexin A3是Annexins家族成员之一。研究表明,Annexin A3基因定位于人染色体4q13~q22,由323个氨基酸残基组成[9,10]。Annexin A3表达水平的改变,对肿瘤发生发展、耐药性、转移有重要影响。关于ANXA3与恶性肿瘤的相关研究目前开展并不广泛,其深入程度也远不如ANXA家族ANXA1、ANXA2等的相关研究。Liu等[7]应用荧光双向差异凝胶电泳(2D-DIGE)与液相色谱质谱(LC-MS)技术对胃癌分化相关蛋白质进行了筛选,结果发现ANXA3与胃癌分化关系密切。Xie等[11]研究60例直肠癌患者中ANXA3表达情况。采用了免疫组化的方法分析这些患者直肠癌组织中ANXA3蛋白表达情况发现,ANXA3在直肠癌组织中表达上调,且ANXA3过表达是预后较差的预后因素。国内朱利芹等[12]报道ANXA3在耐药细胞株中RNA基因水平和蛋白水平表达显著高于亲本细胞株HT-29的结论。但这些研究还比较零散,有待进一步深入研究。Madoz-Gurpide等[13]研究发现在结直肠癌中ANXA3高表达率为63%,显著高于正常组织。Liang等[14]报道Annexin A3在高淋巴道转移肝癌细胞株Hca-F中表达明显上调,其表达水平是低淋巴道转移肝癌细胞株Hca-P的2.3倍,从而说明ANXA3直接参与了肝癌的转移过程。Zeng等[15,16]均报道ANXA3表达与腋淋巴结转移呈正相关性。以上研究均提示ANXA3可能参与恶性肿瘤的发生、增值、迁移和转移。这与我们研究的在乳腺癌中ANXA3表达结果相一致。有关ANXA3在乳腺癌方面的研究报道较少。我们的研究首先采用荧光定量RT-PCR及western blot方法检测了两株乳腺癌细胞(MDA-MB-231及MCF-7)中ANXA3 mRNA及蛋白表达水平。结果发现MDA-MB-231细胞中ANXA3 mRNA及蛋白表达水平显著高于MCF-7中的表达,提示在高侵袭性乳腺癌细胞中ANXA3表达增高。我们成功构建了3个针对ANXA3基因的shRNA质粒;经脂质体法转染人乳腺癌MDA-MB-231细胞48h观察,ANXA3-sh2对MDA-MB-231细胞中ANXA3 mRNA沉默效率最高,达87.72%。经嘌呤霉素筛选出稳定转染细胞;应用了Western blot方法检测转染后细胞中ANXA3蛋白表达水平显著低于MDA-MB-231细胞中的表达水平。本项研究,通过RNA干扰沉默乳腺癌MDA-MB-231细胞中ANXA3基因,从而建立稳定下调ANXA3表达的乳腺癌细胞株MDA-MB-231,为进一步研究ANXA3在乳腺癌发生发展及侵袭转移机制提供实验基础。

表3 shRNA干扰载体的测序结果
图3 shRNA干扰载体的部分测序
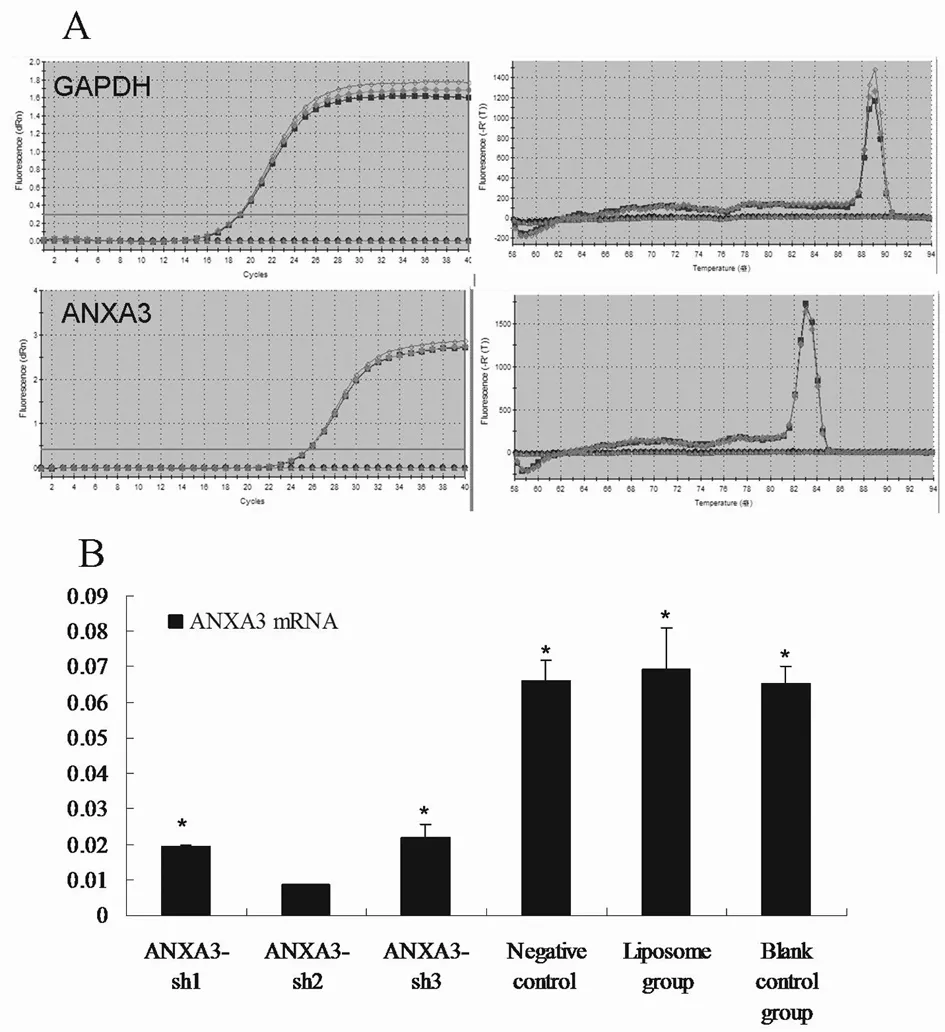
图4 荧光定量RT-PCR检测转染细胞中ANXA3 mRNA表达水平
注:A:荧光定量RT-PCR检测细胞ANXA3及GAPDH的扩增曲线及溶解曲线;B:与转染H_ANXA3-sh2的MDA-MB-231细胞ANXA3 mRNA表达水平比较,*P<0.05
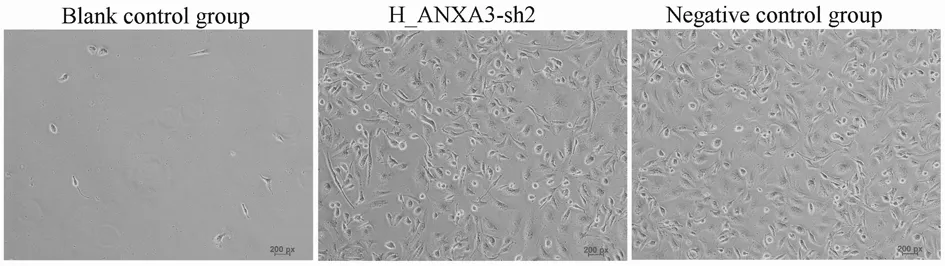
图5 600ng/ml嘌呤霉素筛选细胞14日后细胞图(×100)
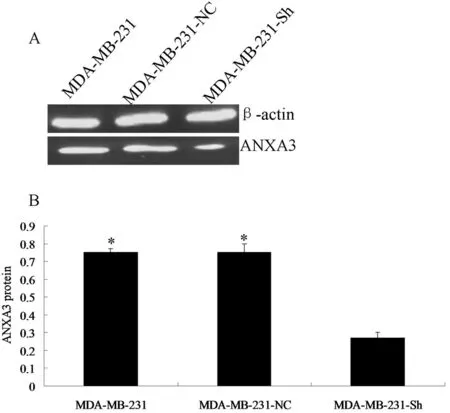
图6 western blot 检测转染细胞中ANXA3蛋白表达
注:A:western blot 检测转染细胞中ANXA3蛋白表达;B:与MDA-MB-231-Sh细胞比较,*P<0.05;MDA-MB-231-Sh细胞中ANXA3蛋白显著降低,转染针对ANXA3 的shRAN可以显著下调ANXA3蛋白表达
1Bandorowicz-Pikua J, Wo M, Pikua S.Participation of annexins in signal transduction, regulation of plasma membrane structure and membrane repair mechanisms. Postepy Biochem,2012,58:135-148.
2Fatimathas L, Moss SE. Annexins as disease modifiers. Histol Histopathol,2010,25:527-532.
3Ranishte T, Arsenescu-Georgescu C, Tomescu MC, et al. Annexins, calcium-dependent phospholipid binding proteins in irreducible heart failure. Rev Med Chir Soc Med Nat Iasi,2013,117:648-653.
4Bianchi C,Bombelli S,Raimondo F,et al. Primary cell cultures from human renal cortex and renal cell carcinoma evidence a differential expression of two spliced isoforms of annexin A3. Am J Pathol,2010,176: 1660-1670.
5Baine MJ,Chakraborty S,Smith LM,et al. Transcriptional profiling of peripheral blood mononuclear cells in pancreatic cancer patients identifies novel genes with potential diagnostic utility. PLoS One, 2011, 6: e17014.
6Yip KT,Das PK,Suria D,et al. A case- controlled validation study of a bloodbased seven gene biomarker panel for colorectal cancer in Maiaysia.J Exp Clin Cancer Res,2010,29:128.
7Liu Y, Li Y, Tan BB, et al. Technique appraisement of comparative proteomics and screening of differentiation-related protein in gastric carcinoma. Hepatogastroenterology,2013,60:633-637.
8Xie YQ, Fu D, He ZH, et al. Prognostic value of Annexin A3 in human colorectal cancer and its correlation with hypoxia-inducible factor-1α. Oncol Lett,2013,6:1631-1635.
9Wozny W,Schroer K,Schwall GP,et al.Differential radioactive quantification of protein abundance ratios between benign and malignant prostate tissues: cancer association of annexinA3. Proteomics,2007,7:313-322.
10Yan XD,Pan LY,Yuan Y,et al. Identification of platinum-resistance associated proteins through proteomic analysis of human ovarian cancer cells and their platinum-resistant sublines.Proteome Res,2007,6:772-780.
11Xie YQ, Fu D, He ZH, et al. Prognostic value of Annexin A3 in human colorectal cancer and its correlation with hypoxia-inducible factor-1α. Oncol Lett,2013,6:1631-1635.
12朱利芹,邵婧娴,孙静悦,等. ANXA3在结直肠癌细胞株中的表达. 现代医学,2015,43:267-271.
13Madoz-Gurpide J,Lopez-Serra P,Martínez-Torrecuadrada JL,et al.Proteomics-based validation of genomic data. Molecular & Cellular Proteomics,2006,5:1471-1483.
14Liang RC, Neo JC, Lo SL, et al. Proteome database of hepatocellular carcinoma.J Chromatogr B,2002,771: 303-328.
15Zeng C,Ke ZF,Song YL,et al.Annexin A3 is associated with a poor prognosis in breast cancer and participates in the modulation of apoptosis in vitro by affecting the Bcl-2 balance. Experimental and Molecular Pathology, 2013, 95:23-31.
16吴志明, 邱海江, 方孙阳. Annexin A3在乳腺癌中的表达及意义.肿瘤学杂志,2014,20:705-709.
Establishment of breast cancer cell line-MDA-MB-231 through down-regulating the expressions of annexin A3 gene by RNA interference technique
ZHOUTao*,YANGLi,LIULiang,etal.
*CenterforBreastExamination,TheFourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
ObjectiveTo establish a breast cancer cell line-MDA-MB-231 transfected with shRNA (small hairpin RNA) targeting at annexin A3, in order to provide a basis for further study.MethodsThe expression levels of ANXA3 mRNA and protein in MDA-MB-231 cells and MCF-7 cells were detected by fluorescent quantitation RT-PCR and Western Blot,respectively. The three shRNAs (shRNA1, 2 and 3) plasmids of silencing ANXA3 gene and negative control plasmid were established. MDA-MB-231 human breast cancer cells were transfered with liposome method.The interference plasmid that could silence ANXA3 gene most effectively was selected for subsequent experiment.The stable transfection cells were selected out by using puromycin, and the expression levels of annexin A7 were detected by Western Blot.ResultsThe expression levels of ANXA3 mRNA and protein in MDA-MB-231 cells were significantly higher than those in MCF-7 cells (P<0.05). The three shRNAs plasmids targeting at annexin A3 gene were successfully established.The expression levels of ANXA3 mRNA in MDA-MB-231 cells after transfected with ANXA3-sh1~3 and negative control plasmid were 0.0196±0.0002, 0.0085±0.0002, 0.0220±0.0035, 0.0661±0.0057,respectively,however,which in MDA-MB-231 cells without transfection and in liposomes group were 0.0692±0.0050,0.0652±0.0118,respectively. The silencing efficiency of ANXA3-sh2 on ANXA3 mRNA in MDA-MB-231 cells was the highest (87.72%),thus, ANXA3-sh2 was selected for subsequent experiment. The stable transfection cells selected by puromycin were named as MDA-MB-231-Sh cells and MDA-MB-231-NC cells. Western Blot showed that the expression levels of ANXA3 protein in MDA-MB-231-Sh cells were significantly lower than those in MDA-MB-231 cells and in MDA-MB-231-NC cells (P<0.01).ConclusionThe expression levels of annexin A3 protein in MDA-MB-231 cells are higher than those in MCF-7 cells.The successful establishment of MDA-MB-231 cells of down-regulating the expressions of annexin A3 stably lays the foundation for furthere research about the expression and characteristics of ANXA3.
breast cancer; RNA interference; Annexin A3; transfection
10.3969/j.issn.1002-7386.2016.20.002
050011石家庄市,河北医科大学第四医院乳腺中心(周涛),CT室(杨丽),肿瘤所(刘亮),动物中心(巨英超)
R 737.9
A
1002-7386(2016)20-3049-06
2016-05-19)
