龙须菜果孢子的X射线诱变及优势突变体的筛选*
2016-10-18魏惠惠隋正红王津果杜青伟商二磊
魏惠惠, 隋正红, 王津果, 杜青伟, 商二磊,米 萍, 阙 州
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
龙须菜果孢子的X射线诱变及优势突变体的筛选*
魏惠惠, 隋正红❋❋, 王津果, 杜青伟, 商二磊,米萍, 阙州
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
采用X射线作为诱变源,对龙须菜进行辐照诱变,验证了果孢子作为诱变材料相对于龙须菜藻尖的优越性,并确定了最佳诱变剂量-90 Gy。约107~108个野生型龙须菜果孢子经过90 Gy的X射线辐照,获得了约106~107株成活的龙须菜幼苗。将诱变存活幼苗平均分成2组,分别对其进行耐高温和低磷速生品系的筛选。经过幼苗期和成熟期的双重筛选,初步获得了1株耐高温突变株和3株低磷速生突变株。分别命名为WT-3和WLP-1、WLP-9、WLP-22。其中,WT-3为经历了41和35 ℃高温胁迫后仍存活并保持良好生长的藻株;WLP-1、WLP-9、WLP-22在10-2mg/L的磷浓度水平下相对野生藻株具有显著的生长优势。本研究提供了一套可行有效的龙须菜诱变筛选技术,同时,筛选出的优良藻株为下一步遗传研究和生产应用提供了材料。
X射线诱变;耐高温;低磷;速生;龙须菜
引用格式:魏惠惠, 隋正红, 王津果, 等. 龙须菜果孢子的X射线诱变及优势突变体的筛选[J]. 中国海洋大学学报(自然科学版), 2016, 46(9): 50-58.
WEI Hui-Hui, SUI Zheng-Hong, WANG Jin-Guo, et al. X-ray-irradiation mutation on carpospores ofGracilariopsislemaneiformisand screening of mutants with superior traits[J]. Periodical of Ocean University of China, 2016, 46(9): 50-58.
龙须菜(Gracilariopsislemaneiformis)是一种具有重要经济价值的大型海洋红藻,其琼胶含量高,所产琼胶被广泛应用于各个生产领域;龙须菜还是鲍鱼养殖的重要饵料,富含牛磺酸和谷氨酸[1],能够有效诱食并且有提高鲍鱼肉质的作用;对龙须菜的多糖及藻胆蛋白的诸多研究表明,龙须菜还具有抗氧化、抗病毒等多种生物学作用;龙须菜养殖可以有效降低海水中N、P含量[2],防止赤潮的发生,具有重要的生态价值。龙须菜自1980年代以来,被人工栽培的规模逐渐扩大,其经济价值和生态效益得到了有效的发挥,促进了我国海水养殖事业的发展[3]。
野生龙须菜的最适生长温度是12~23 ℃,主要分布在我国山东半岛潮间带。1998年,张学成等[3]通过化学诱变的方法,选育出耐高温品系981,使得龙须菜的耐受温度提高到26 ℃,在南方海域得到广泛推广。但是,品系981的耐受温度虽然相对野生型有显著提高,但在南方海域仍然不能成功渡夏。因此,更加耐高温的龙须菜品系亟待被选育出来。
磷是植物生长过程中不可或缺的元素之一,磷缺乏会导致龙须菜产量降低、质量下降。Atkinson和 Smith[4]报道,海洋大型红藻生长环境中磷元素含量相对较低,碳、氮、磷的比例一般保持在550∶30∶1这样1个平均比值左右。并且,我们通过栽培实践以及不同海区海水氮磷含量的累计测量,发现很多海区磷含量明显偏低,甚至会低至0.01 mg/L以下。研究表明,龙须菜生长所需的饱和磷浓度约为0.62 mg/L[5],而为了防止赤潮等海水富营养化现象的发生,根据我国海水水质标准,海水的磷含量范围应为≤0.045 mg/L[6],这个磷浓度远远低于龙须菜生长所需。并且,通过添加磷肥的方式来提高其产量,必然会对海域的生态环境产生负面的影响。因此,提高藻体本身的低磷耐受能力,是解决龙须菜因低磷而产量下降问题的重要途径。
本实验首次使用X射线辐照的方法,对龙须菜果孢子进行诱变,进一步筛选获得具有耐高温和低磷速生特性的龙须菜抗逆突变体。本文目的在于为龙须菜的优良品系选育提供一条新的途径,探索出合适的诱变条件和筛选方法,同时也为了选育出高抗逆性的龙须菜品系,将其应用于生产,解决龙须菜栽培领域遇到的问题。
1 材料与方法
1.1 实验材料
实验中所用的龙须菜为采自青岛湛山湾的野生四分孢子体和成熟的雌配子体。
1.2 材料的培养和诱变材料的获得
将采集的新鲜材料先用灭菌水冲洗并用毛刷刷去藻体表面的杂藻。然后置于500 mL锥形瓶中培养,采用Pro培养基[7],培养条件为(20±1) ℃,光强30 μmol/(m2·s),光暗周期12 L∶12 D,每周更换一次培养基。该培养条件为龙须菜的正常培养条件,用于之后果孢子幼苗的培养。
一方面,选取一株长势良好且分支较多的四分孢子体藻株,切取1 cm长的藻尖,用于之后X射线诱变。另一方面,将成熟的雌配子体切成2 cm的藻段,置于六孔板中培养,每个孔中加入10 mL含有Pro培养基的灭菌海水,且保证每个六孔板中藻体的囊果数相同。采用果孢子放散最佳培养条件[8]:温度(20±1) ℃,光强15 μmol/(m2·s),光暗周期12 L∶12 D,每周更换1次培养基。定期在显微镜下观察,待果孢子大量放散。
1.3 藻尖和果孢子的X射线诱变
分别用1 cm的藻尖和放散刚附着的果孢子进行X射线诱变,使用的仪器为青岛四零一医院的VARIAN 21EX医用直线加速器(Varian Medical,美国),采用能量为6 MV的X射线,剂量率设定为6 Gy/min。Gray(Gy)为辐射剂量的绝对单位,1Gy=1 J/kg,即每1千克受照物质吸收1焦耳核辐射能时的辐射剂量。辐射总剂量设置7个梯度,分别为0、15、30、45、60、75、90 Gy。每个剂量设置3个平行。材料经过X射线辐照后暗培养24 h,之后恢复至正常条件培养。对于藻尖,每周更换1次培养基,2周后统计致死率;对于果孢子,诱变1周后在倒置显微镜下统计果孢子的存活数目,进而计算出各个X射线剂量梯度对龙须菜果孢子的致死率。致死率的计算方法如下:致死率/%=(1-存活孢子数目/总孢子数目)×100%[9]。统计方法:采用10倍物镜(×200),总致死率为随机20个视野的平均值。
1.4 耐高温藻株的筛选
1.4.1 耐高温筛选温度的确定参照付峰等[9],略加修改。将未经诱变的野生果孢子培养在(20±1) ℃的培养箱中,光强15 μmol/(m2·s),光暗周期12 L∶12 D,每周更换1次培养基。待其长成2~3 mm长的小苗后,置于38、39、40、41、42 ℃5个温度梯度的水浴锅中热胁迫30 min。之后在正常培养温度下暗培养12 h,再恢复光照培养。1周后统计存活率,得到致使野生型小苗全部死亡的最低温度,用于之后诱变小苗的耐高温筛选。
1.4.2 突变体高温胁迫筛选将诱变后的果孢子培养至2~3 mm长的幼苗期,培养条件同1.4.1,置于上述实验确定的筛选温度,高温水浴胁迫30 min。存活下来的小苗在海上挂养成熟后,进行第二次筛选,每株藻称取0.1 g藻段,每株设置3个平行,置于35 ℃的光照培养箱中胁迫培养72 h[9]。幼苗期和成熟期两次热胁迫后均得以存活的藻株被挑选出来。
1.5 低磷速生藻株的筛选
1.5.1 低磷筛选浓度的确定选取120株未经诱变并长至1 cm长的野生型幼苗,均分为4组,培养于添加了去磷Pro培养基的海水中,不同组添加磷的终浓度分别为0、0.01、0.1和1 mg/L。每周测量1次幼苗长度,连续测量6周。观察小苗生长状态和生长速率,从而获得最佳的低磷筛选浓度。
1.5.2 突变体低磷胁迫筛选待诱变后的果孢子的存活率稳定后,将其与同时期的野生果孢子共同在上述实验得到的低磷培养基中培养。正常Pro培养基培养的小苗为对照组,海水中磷的终浓度约为1 mg/L。待小苗的平均长度长至2 cm左右,统计测量幼苗长度,得到野生型最大苗长,挑选出大于该苗长的诱变组小苗,同野生小苗一同挂至海上培养成熟后,进行第二次筛选。每株称取0.5 g藻体,设置3个平行,野生小苗为对照组。在低磷培养基中培养,培养条件为(20±1) ℃,光强30 μmol/(m2·s),光暗周期12 L∶12 D,每周更换一次培养基。30 d后称量藻体的质量,进而计算出日平均生长速率(Specific Growth Rate,SGR),先获得野生型最大日平均生长速率,诱变组中大于该速率的藻株被认定为低磷速生藻株。日平均生长速率的计算公式[9]如下:
SGR=100×(lnWt-lnW0)/t,
式中:SGR为日平均生长速率/%·d-1,Wt为第t天的藻体湿重/g;W0为藻体初始湿重/g。
1.6 数据分析
以上实验均设置3个平行,结果为3个平行的平均值。采用统计软件SPSS22.0对实验数据进行单因素方差分析(ANOVA),差异显著性水平:P=0.05。
2 实验结果
2.1 X射线诱变材料和诱变剂量的确定
X射线诱变预实验分别用2种诱变材料——藻尖和果孢子,在0、15、30、45、60、75、90Gy7个剂量梯度下进行。7个剂量梯度的X射线对龙须菜藻尖均没有表现出明显的致死效应,仅个别藻尖端部变白,但90Gy组藻尖存活率仍为100%(见图1)。而果孢子则对X射线辐照比较敏感,45Gy时致死率为42%,90Gy时致死率为91%。根据2种材料的X射线诱变预实验结果,选用果孢子作为诱变材料。
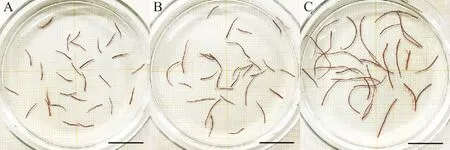
(A.辐照后第1天;B.辐照后第7天;C.辐照后第21天(标尺:2cm)。A.1stdayafterirradiation;B.7thdayafterirradiation;C.21stdayafterirradiation(scalebars=2cm).)
图1X射线(90Gy)辐照后龙须菜藻尖的形态变化
Fig.1ThemorphologicalchangeofstemtipsofGp. lemaneiformisafterX-ray(90Gy)irradiation
根据不同剂量水平对果孢子的致死率,得到诱变剂量与致死率的线性关系(见图2)。通过计算得出,X射线辐照的半致死剂量约为48Gy,致死率为90%时辐照剂量约为90Gy。为了得到更高的正突变率,本实验选定90Gy作为后续诱变的辐照剂量。
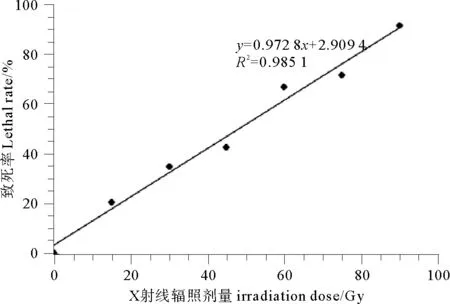
图2 不同X射线辐照剂量对龙须菜果孢子的致死率
2.2 诱变后小苗耐高温筛选温度的确定
野生的四分孢子体幼苗在高温水浴中胁迫30min后,结果显示,在41 ℃时,小苗存活率为0(见图3)。以导致野生型小苗全部死亡的最低处理温度,即41 ℃,作为突变藻株的耐高温筛选温度。
2.3 龙须菜果孢子的X射线诱变及诱变后的形态变化
将放散后刚附着的果孢子(每个六孔板中约有105个孢子,共200个六孔板)按照90Gy的剂量进行X射线辐照。与未作处理的果孢子相比,辐照后的果孢子分裂速度变慢,发育明显滞后(见图4)。并且分裂过程中形状不规则,出现非正常发育时期——三细胞期(见图B1)。
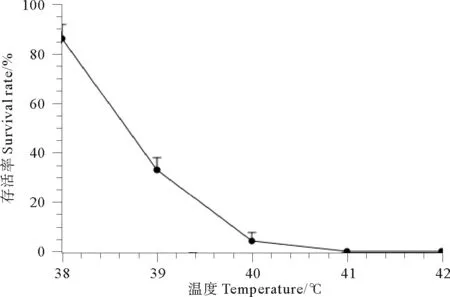
图3 不同温度下野生型龙须菜果孢子幼苗的存活率
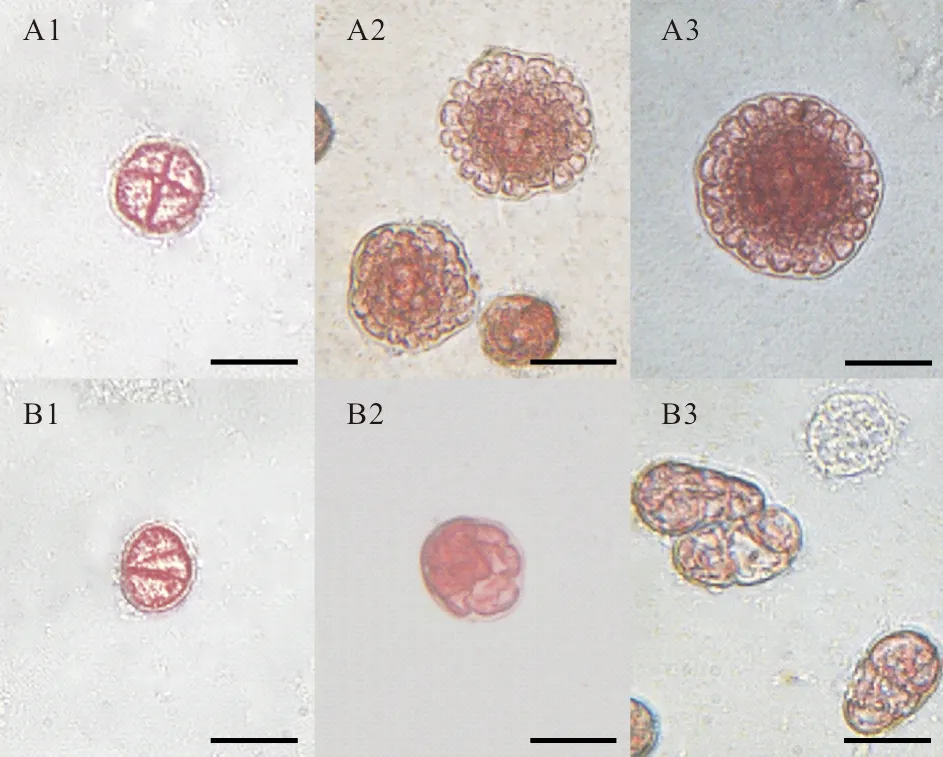
(A.1~3分别为正常果孢子发育第3、6、9天;B.1~3分别为诱变后果孢子发育第3、6、9天(标尺:20μm)。A.1~3is3rd, 6th, 9thdaywithouttreatment,respectively;B.1~3is3rd, 6th, 9thdayaftertreatment,respectively(Scalebars=20μm).)
图4X射线诱变和未经处理的龙须菜果孢子发育情况对比(×400)
Fig.4ThedevelopmentalcomparisonofthecarposporesofGp. lemaneiformistreatedwithandwithout(×400)X-rayirradiation,respectively
2.4 耐高温藻株的筛选
将长至2~3mm(约4周后)的小苗置于41 ℃水浴中高温胁迫30min,胁迫后初期并没有明显的形态变化,随着时间的推移,小苗颜色逐渐变浅。在热胁迫后第3天,小苗呈现出明显的浅紫红色,在第7天大部分小苗全部变为白色(见图5),而有些小苗则维持或部分维持红褐色从而存活下来,这些存活下来的小苗被初步认定为耐高温小苗。
耐高温小苗挂养成熟后,采用在35 ℃培养箱中胁迫培养72h的方法进行2次筛选,热胁迫后一些藻株从局部开始逐渐变绿,进而整株藻体死亡,而另一些藻株则仅尖端或小部分变绿,剩余藻体很快形成了新的分支,存活下来。经过2次筛选后存活下来的藻株,被认定为耐高温藻株,其中一株分支较多,且有显著生长优势,命名为WT-3。

图5 经41 ℃热胁迫30 min后第1、3、7天的龙须菜果孢子幼苗(标尺:1 cm)
2.5 低磷速生藻株的筛选
4个磷浓度组的幼苗连续6周的长度测量结果(见图6)显示,添加正常Pro培养基(1mg/L)的小苗,生长速度显著高于其他3组(P<0.05);0.1mg/L组居中,显著高于0.01、0mg/L组(P<0.05)。后2组长势相似,差异不显著(P>0.05)。由于用于幼苗培养的海水中本身磷浓度约为0.02~0.04mg/L,因此后2组培养液的磷终浓度均为10-2mg/L水平,实验结果与其一致。由图可知,海水磷浓度在10-2mg/L水平时,龙须菜生长速度缓慢,生长明显受到抑制,因此该水平的磷浓度可用于低磷筛选。另外,为了避免天然海水中磷浓度的不稳定性对藻体生长带来的影响,实验选择添加磷终浓度0.01mg/L作为后续低磷速生藻株筛选浓度。
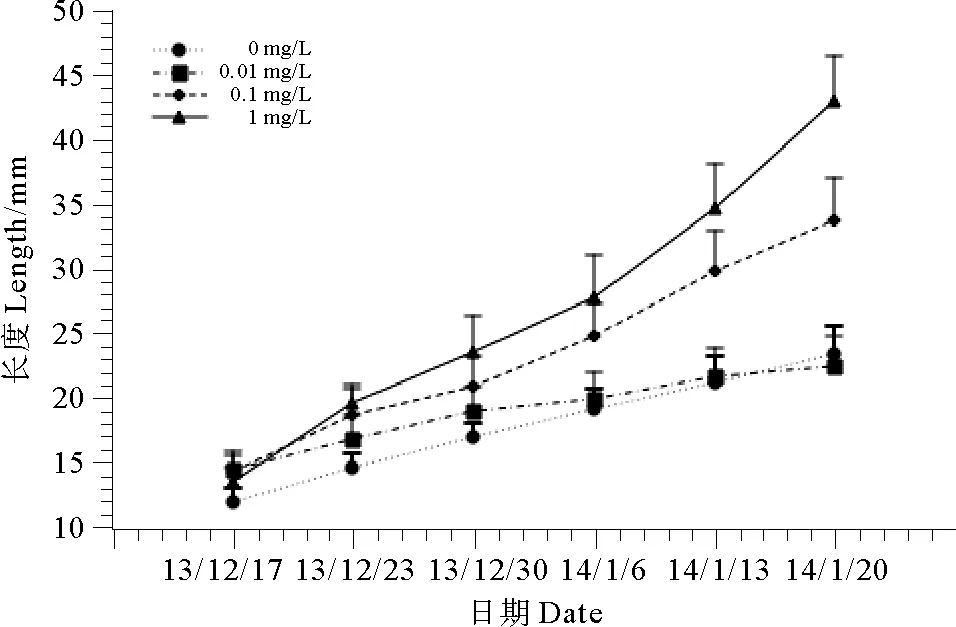
图6 4个磷浓度组龙须菜幼苗的生长
将同时放散的等量的(100个六孔板)经诱变和未经诱变的果孢子采用低磷培养基,在相同条件下培养。约16周后,果孢子长成了2cm左右的幼苗,测量统计幼苗长度,统计结果(见图7)显示:诱变组相对于未诱变组小苗,平均长度较小,标准偏差较大。另外,测得野生小苗的最大长度约为2.4cm,将诱变组中长于2.4cm的小苗挑出,共27株,其中最大长度达到3.6cm。
将初筛得到耐低磷小苗挂至海上培养成熟后。每株取0.5g,设置3个平行,另外30株野生小苗为对照组,在实验室中进行低磷培养,30d后计算日平均生长速率。结果显示(见图8),野生组最大生长速率为2.21%,诱变藻株中,有3株日平均生长速率分别为2.79%、2.72%、3.01%,显著高于野生组的最大速率(P<0.05),被分别命名为WLP-1、WLP-9、WLP-22。
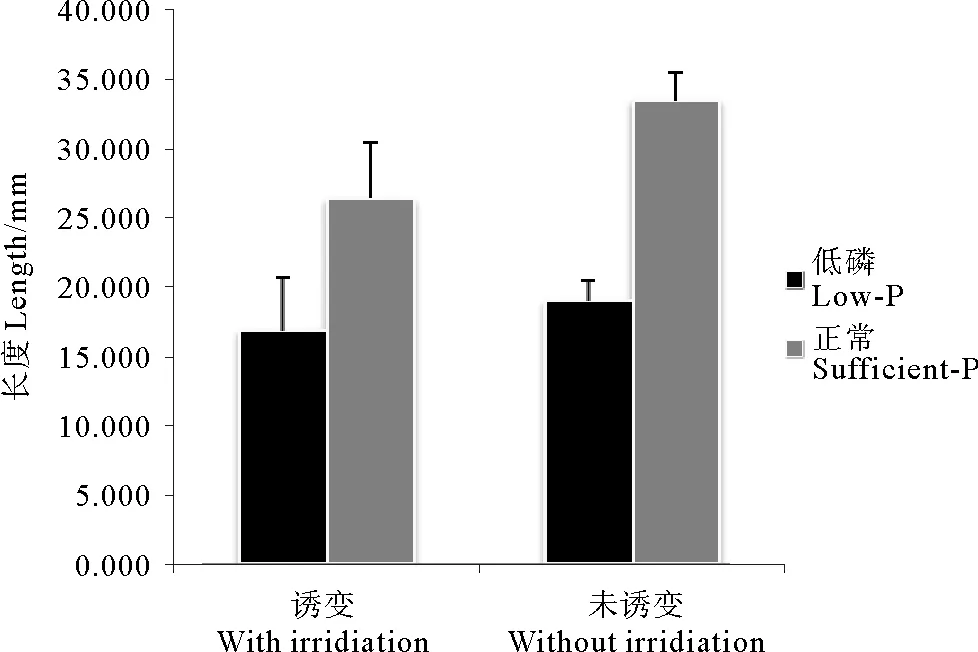
图7 诱变和未经诱变龙须菜小苗16周时长度比较
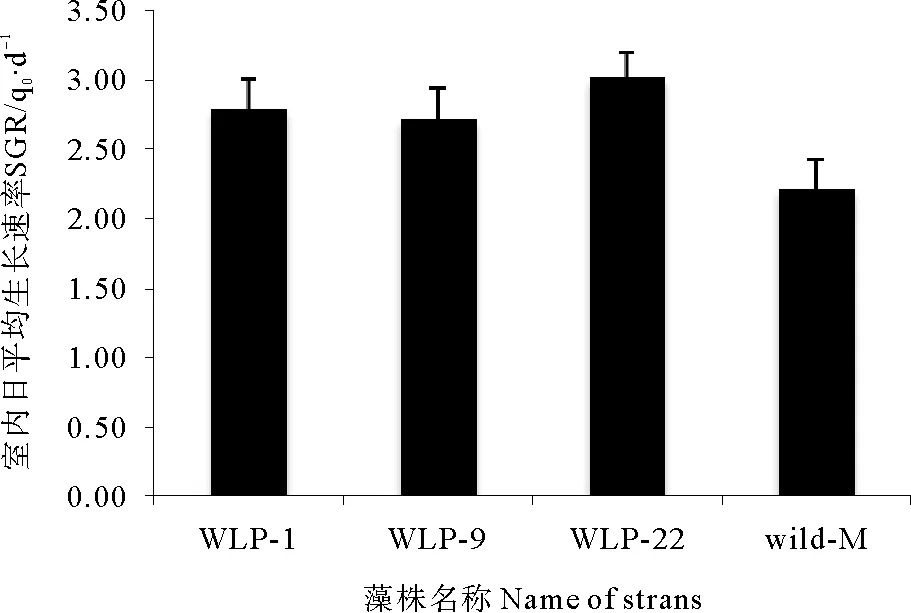
图8 龙须菜藻株在实验室的日平均生长速率比较
3 讨论
3.1 诱变材料
江蓠的辐照诱变大多采用Co60-γ射线或者紫外线,用于辐照诱变的材料也根据诱变源的不同而有所差异。针对特定的诱变源,选择合适的诱变材料,能够有效提高诱变效率。Shen等[10]用紫外线辐照细基江蓠(Gracilaria tenuistipitata)2mm厚的藻段,对其进行诱变育种。而龙须菜中常用的诱变材料有2种,藻尖和放散的孢子。张学成等[11]报道幼嫩的藻尖常被用作龙须菜紫外诱变的材料。而孟琳[12]在利用Co60-γ射线诱变龙须菜时,选用的材料也为20~30mm长的藻尖。付峰[13]则选用了龙须菜的果孢子和四分孢子对其进行紫外诱变。
本实验选取了2种材料进行X射线辐照,即龙须菜藻尖和刚附着的果孢子,从而获得更适合于X射线诱变的材料。预实验的结果表明,果孢子相对于藻尖而言对X射线具有更高的灵敏度,在诱变剂量为90Gy时致死率已达到90%,而藻尖在90Gy时,只有部分尖端变白,并无藻尖完全死亡的情况。放散后刚附着的果孢子作为诱变材料有其特有的优点,由于孢子只有在接触六孔板底部时才能附着,所以用于辐照的果孢子均平铺在六孔板底面,不存在孢子重叠的现象,能保证所有孢子均匀接受辐照,且辐照距离相等;放散后刚附着的果孢子没有厚实的多糖细胞壁,X射线更容易穿透,进而发挥效应;其为单细胞,突变发生后能够随着细胞分裂分化在完整藻株中表现出来,而藻尖则可能会由于射线辐照的不均匀性而形成嵌合体。另外,孢子制备方便,可以大量获得,且成活率高,能够为X射线诱变提供大量的材料,提高了正突变株产生的几率。
3.2 诱变方法
辐射诱变被普遍应用于高等植物、藻类和微生物的育种研究,其具有突变谱较广、突变率高等优势。不同的物理射线会对生物体产生不同的辐射生物效应[14]。X射线是一种电离辐射,具有强的穿透能力,照射在分子上能够将分子中的电子击出,产生离子,即产生电离作用,其发生在DNA分子上能够诱发基因突变。
X射线在高等植物和微生物诱变育种中应用广泛,而在藻类尤其是大型藻类中应用较少。黄海水产研究所和中科院海洋研究所[15-16]用X射线进行辐照诱变,再经筛选和自交,得到了干物质含量高且耐高温的海带品种“1170”。蒋霞敏等[17]以雨生红球藻作为诱变材料,从超微结构变化的角度研究了X射线的致突变效应,推测X射线辐照引起的细胞核、线粒体、叶绿体等细胞器的损伤,可能是造成突变的原因。
诱变育种被广泛应用于龙须菜优良品系的选育。包括物理和化学诱变2种手段,常用的化学诱变剂有N-甲基-N′-亚硝基胍(MNNG)和甲基磺酸乙酯(EMS)等。张学成等[3, 18]用MNNG对龙须菜进行诱变,先是获得了多种色素突变体,为龙须菜的色素组成研究提供了材料;后又结合羟脯氨酸以及高温胁迫筛选,选育出了耐高温良种—品系981。Zhang等[19]利用EMS对龙须菜进行诱变,获得了色素突变体,为龙须菜遗传研究提供了基础。孟琳等[12]利用MNNG对品系981的藻尖进行诱变,再对其进行高温筛选,获得了耐高温品系07-2,与品系981相比,具有更好的耐高温性、更快的生长速率和更高的琼胶含量。常用的物理方法主要是紫外线辐照诱变,付峰等[13]用紫外线诱变龙须菜,通过高温筛选获得了两株耐高温藻株,生长速率明显高于品系981和野生型,且通过对其热胁迫下耐高温指标的测定,证明其相对于品系981和野生型具有显著的耐高温优势。
X射线具有比紫外线更强的穿透力,其致突变效应也在多种植物的育种研究中得到证实。但其在龙须菜的诱变育种中一直未被采用。在本实验中,利用医用电子直线加速器产生的X射线对龙须菜释放刚附着的果孢子进行辐照诱变,更加安全高效,果孢子相对传统的诱变材料而言,具有其特有的优点。且实验结合高温和低磷筛选获得了具有耐高温和低磷速生优良性状的藻株,结果显示了X射线辐照方法诱变果孢子的可行性。
3.3 诱变后果孢子的形态变化
孢子的正常发育过程一般为单细胞期→二细胞期→四细胞期→多细胞盘状体→直立体→小苗。诱变后的果孢子在发育过程中出现了为数不少的三细胞期,发育到多细胞阶段,大多呈现为形状不规则的细胞团块。推测X射线对细胞核内遗传物质产生了损伤或改变,以致细胞分裂和发育出现异常。对不规则分裂的果孢子进行跟踪观察,发现部分不规则细胞团块发育迟缓,渐而凋亡,而另一部分则通过细胞的分裂修整,形成了基部为同心圆或接近圆形的盘状体。有关诱变对细胞形态及发育进程的影响及其调控过程是有待于深入研究的课题。
3.4 耐高温突变体的筛选
建立起一套有效的突变体筛选的方法和技术,是植物诱变育种中的关键步骤。对于耐高温突变株的筛选,一般分为一步法和多步法。由于多步法需要长期逐步地筛选,耗时长、劳动强度大,许多研究者比较倾向于一步筛选法,将植株或藻株培养于大于其最适生长温度的高温中,挑选出在该温度下能够存活或者生长快速的藻株。黄瑞芳等[20]利用连续7d的夏季强光高温(42~52 ℃)筛选经紫外诱变的巴氏杜氏藻(Dunaliella bardawil),获得了一株耐高温的突变株。Ong等[21]通过在40 ℃高温培养筛选诱变后的小球藻,获得了两株耐高温突变体。
另外,植株在不同发育阶段可能会显示出不同的耐受性[22-23]。樊恭炬[24]等通过实验和调查研究,推测龙须菜幼株比成熟藻体更耐高温。于是,本实验在龙须菜幼苗期和成熟期均设置了耐高温筛选,来获得耐热性能够稳定表达的藻株。
Burke等[25]采用远高于拟南芥最适生长温度的48~50 ℃温浴30min来分离缺少获得性耐热成分的拟南芥。Mullarkey等[22]在筛选EMS诱变的小麦耐高温突变体时,采用的方法是将M2代幼苗置于47 ℃的高温中热胁迫90min。本实验采用高温水浴胁迫的方法对幼苗期的诱变藻株进行首次筛选。首先通过预实验得到致使野生小苗全部死亡的最低温度-41 ℃,然后将2~3mm长的经诱变的果孢子幼苗置于该温度下胁迫30min。成熟期藻体的耐高温筛选为35 ℃热胁迫72h。结果显示,该筛选方法耗费时间较短,降低了筛选的劳动强度;在成熟期时进行2次筛选,其结果能够反映突变体的性状稳定性,有利于筛选出真正具有耐高温特性的突变藻株。
在幼苗期时经高温水浴胁迫有大量的果孢子幼苗存活下来,这些小苗在成熟期热胁迫后却仍有大批藻株死亡,在一定程度上验证了龙须菜在幼苗期具有更高的抗高温性的观点。筛选出的耐高温藻株还需要后续的遗传分析和实践栽培工作来验证其遗传稳定性。
3.5 低磷速生突变体的筛选
磷是植物必需的营养元素,在其生长发育、新陈代谢中起着重要的作用。由于土壤中能够供给作物利用的有效磷浓度非常低[26],因此,在高等植物尤其是农作物中关于低磷胁迫和耐低磷筛选指标的研究非常之深入和广泛。在低磷胁迫下作物根系会分泌大量的酸性磷酸酶来活化土壤中的有机磷,被认为是作物适应低磷胁迫的重要生理机制[27]。还有研究表明,在缺磷状态下,小麦[28]、油菜[29]等作物的根冠比会增加,这是因为更多的碳水化合物被迫使向根部运输。武志远等[30]利用根际显色反应作为耐低磷品种的筛选方法,筛选耐低磷的粗山羊草品系,根际显色试验能说明不同材料根际分泌的酸类物质的数量差异。高亲和性磷酸转运系统被认为低磷胁迫状态下有效磷的主要转运系统,其在环境中低磷或者缺磷时被诱导表达,而在正常供磷情况下表达被抑制[31]。另外,分蘖能力、根轴长度、相对叶龄等也经常被用作高等植物耐低磷筛选的指标。
但在藻类尤其是大型海藻中,耐低磷筛选指标的研究相对缺乏。有研究表明,钝顶节旋藻细胞内P含量受限时,会引起碳水化合物、脂质和C/N比的升高以及蛋白质含量的降低[32]。另外,N、P浓度的变化,会影响龙须菜叶绿素a、藻红蛋白、丙二醛含量以及硝酸还原酶和过氧化物酶活性[33]。但这些指标能否反映藻株对低磷胁迫的耐受力还缺乏足够的证据。但生长速率作为最直观的性状表征,是高等植物和藻类耐低磷筛选最基本的指标。
本实验以低磷培养条件下的生长速率为指标,进行低磷速生品系的选育。首先,幼苗期通过测量各株幼苗的长度,初步筛选出相对野生型有着明显生长优势的藻株。诱变组平均长度明显低于野生组,说明X射线辐照使大多数藻株产生了负突变。测量得到野生型最大长度,以该长度为筛选标准,大于该长度的诱变组藻株,被初步认定为耐低磷藻株。一方面,野生型藻株样本与诱变组数量一致,均为106~107,样本数目足够大,并且藻株培养条件均一致,因此,以野生型最大长度为筛选标准具有可信性。大于该长度的诱变组小苗相对野生型具有显著的生长优势,因此,极有可能是耐低磷的突变株。
在第一轮筛选的基础上,待其成熟后,设计实验再次验证耐低磷小苗的生长优势,每株藻设计3个平行,日平均生长速率显著大于野生型的藻株被确定为低磷速生藻株,但其遗传变异的稳定性,还需进一步分析鉴定。
实验验证了用X射线辐照果孢子是一种有效的龙须菜诱变育种方法。筛选出的WT-3经过幼苗期的高温水浴胁迫和成熟期的高温培养胁迫后存活下来,说明其可能具有较高的耐热性。WLP-1、WLP-9、WLP-22以生长速率为指标,经过幼苗期和成熟期的双重筛选,显示了在低磷条件下显著的生长优势。筛选出的耐高温和低磷速生藻株有望作为优良品系应用于生产栽培,4株突变体的性状优越性和遗传稳定性的确定还需大量的后续研究和实践栽培工作。
本实验将X射线诱变与耐高温和低磷速生筛选相结合,建立了一套可行的龙须菜优良品系筛选方法,为龙须菜的优良品系选育提供了研究基础,同时,筛选出的优良藻株为下一步遗传研究和生产应用提供了材料。
[1]余杰, 王欣, 陈美珍, 等. 潮汕沿海龙须菜的营养成分和多糖组成分析[J]. 食品科学, 2006, 27(1): 93-97.
YuJ,WangX,ChenMZ,etal.AnalysisonnutritionalcomponentsandpolysaccharidecompositionofGracilaria lemaneiformisfromChaoshanCoast[J].FoodScience, 2006, 27(1): 93-97.
[2]FeiXG.Solvingthecoastaleutrophicationproblembylargescaleseaweedcultivation[J].Hydrobiologia, 2004, 512(1-3): 145-151.
[3]张学成, 费修绠, 王广策, 等. 江蓠属海藻龙须菜的基础研究与大规模栽培[J]. 中国海洋大学学报(自然科学版), 2009, 39(5): 947-954.
ZhangXC,FeiXG,WangGC,etal.GeneticstudiesandlargescalecultivationofGracilaria lemaneiformis[J].PeriodicalofOceanUniversityofChina, 2009, 39(5): 947-954.
[4]AtkinsonMJ,SmithSV.C:N:Pratiosofbenthicmarinealgae[J].LimnolOceanogr. 1983, 28: 568-574.
[5]徐永健. 养殖富营养化修复藻类的营养生态学研究[D]. 厦门: 厦门大学, 2004.
XuYJ.StudyonNutrientEcologyofSeaweedsUsedforRemediatingMariculturalEutrophication[D].Xiamen:XiamenUniversity, 2004.
[6]国家环境保护局.GB3097-1997 海水水质标准[S].北京:环境科学出版社, 2004.
MinistryofEnvironmentalProtectionofthePeople'sRepublicofChina.GB3097-1997SeaWaterQualityStandard[S].Beijing:ChinaEnvironmentalSciencePress, 2004.
[7]ZhouW,SuiZH,WangJG,etal.AnorthogonaldesignforoptimizationofgrowthconditionsforalllifehistorystagesofGracilariopsis lemaneiformis (Rhodophyta)[J].Aquaculture, 2013, 392: 98-105.
[8]PflugmacherS,SteinbergC.ActivityofphaseⅠandphaseⅡdetoxificationenzymesinaquaticmacrophytes[J].AngewandteBotanik, 1997, 71(5-6): 144-146.
[9]付峰, 隋正红, 常连鹏, 等. 龙须菜果孢子的紫外诱变及优势突变体的筛选[J]. 中国海洋大学学报 (自然科学版), 2014, 44(3): 50-56.
FuF,SuiZH,ChangLP,etal.UV-irradiationmutationoncarposporesofGracilariopsis lemaneiformisandscreeningofthermo-tolerantstrains[J].PeriodicalofOceanUniversityofChina, 2014, 44(3): 50-56.
[10]ShenD,WuM.Chromosomalandmutagenicstudyofthemarinemacroalga, Gracilaria tenuistipitata[J].JournalofAppliedPhycology, 1995, 7(1): 25-31.
[11]张学成, 秦松, 马家海, 等. 海藻遗传学[M]. 北京:中国农业出版社, 2005.
ZhangXC,QinS,MaJH,etal.TheGeneticsofMarineAlgae[M].Beijing:ChinaAgriculturePress, 2005.
[12]孟琳. 龙须菜耐高温新品系的选育及其相关性状分析[D]. 青岛: 中国海洋大学, 2009.
MengL.SelectionandCharacteristicAnalysisonNewStrainofGracilaria lemaneiformis[D].Qingdao:OceanUniversityofChina, 2009.
[13]付峰. 龙须菜紫外诱变育种及抗逆速生优良品系的选育[D]. 青岛: 中国海洋大学, 2013.
FuF.TheUltravioletMutagenesisBreedingandSelectionofStressToleranceandFastGrowthStrainsofGracilariopsis lemaneiformis[D].Qingdao:OceanUniversityofChina, 2013.
[14]施巧琴, 吴松刚. 工业微生物育种学[M]. 北京: 科学出版社, 2003.
ShiQQ,WuSG.IndustrialMicrobialBreedingScience[M].Beijing:SciencePress, 2003.
[15]WuCY,LinGH.ProgressinthegeneticsandbreedingofeconomicseaweedsinChina[J].Hydrobiologia, 1987, 151/152: 57-61.
[16]李大鹏, 芦永红, 吴超元. 海带遗传育种及育苗生物技术历史及现状[J]. 生物学通报, 2002, 37(8): 1-3.
LiDP,LuYH,WuCY.ThehistoryandpresentsituationofgeneticbreedingbiotechnologyofLaminaria japonica[J].BulletinofBiology, 2002, 37(8): 1-3.
[17]蒋霞敏, 翟兴文, 董姣娣, 等.X,γ辐射对雨生红球藻超微结构的影响[J]. 核农学报, 2003, 17(6): 438-441.
JiangXM,ZhaiXW,DongJD,etal.EffectofX-andγ-irradiationontheultrastructureofHaematococcus pluvialis[J].JournalofNuclearAgriculturalScience, 2003, 17(6): 438-441.
[18]张学成, 张锦东, 隋正红, 等. 江蓠属藻胆蛋白的研究:Ⅰ诱变、突变体筛选及藻胆蛋白的光谱特性[J]. 青岛海洋大学学报(自然科学版), 1996, 26(3): 318-326.
ZhangXC,ZhangJD,SuiZH,etal.StudiesonphycobiliproteinsfromGracilaria: Ⅰ.Mutagenesis,mutationselectionandcharacterizationofabsorptionspectraandfluorescentemissionspectra[J].JournalofOceanUniversityofQingdao, 1996, 26(3): 318-326.
[19]ZhangX,MeerJP.AgeneticstudyonGracilaria sjoestedtii[J].CanadianJournalofBotany, 1988, 66(10): 2022-2026.
[20]黄瑞芳, 刘广发, 周韬, 等. 耐高温巴氏杜氏藻突变株的诱变和鉴定[J]. 厦门大学学报 (自然科学版), 2006, 45(2): 272-275.
HuangRF,LiuGF,ZhouT,etal.MutationandidentificationofthemutantofDunaliella bardawilresistanttohightemperature[J].JournalofXiamenUniversity(NaturalScience), 2006, 45(2): 272-275.
[21]OngSC,KaoCY,ChiuSY,etal.Characterizationofthethermal-tolerantmutantsofChlorellasp.withhighgrowthrateandapplicationinoutdoorphotobioreactorcultivation[J].BioresourceTechnology, 2010, 101(8): 2880-2883.
[22]MullarkeyM,JonesP.Isolationandanalysisofthermotolerantmutantsofwheat[J].JournalofExperimentalBotany, 2000, 51(342): 139-146.
[23]邓茳明, 熊格生, 袁小玲, 等. 棉花不同耐高温品系的SOD,POD,CAT活性和MDA含量差异及其对盛花期高温胁迫的响应[J]. 棉花学报, 2010, 22(3): 242-247.
DengJM,XiongGS,YuanXL,etal.DifferencesinSOD,POD,CATactivitiesandMDAcontentandtheirresponsestohightemperaturestressatpeakfloweringstageincottonlineswithdifferenttolerancetohightemperature[J].CottonScience, 2010, 22(3): 242-247.
[24]樊恭炬, 李伟新, 王永川, 等. 琼胶海藻的研究:Ⅰ.龙须菜的果孢子萌发体的生长适温及其幼苗的季节生长[J]. 植物学报, 1974, 16(1): 24-30.
FanGJ,LiWX,WangYC,etal.Studiesontheagarophytes: Ⅰ.Theoptimumgrowthtemperatureofthecarpospores-germlingsofGracilariopsis lemaneiformisandtheseasonalgrowthofthesporelings[J].JournalofIntegrativePlantBiology, 1974, 16(1): 24-30.
[25]BurkeJJ,O'MahonyPJ,OliverMJ.IsolationofArabidopsismutantslackingcomponentsofacquiredthermotolerance[J].PlantPhysiology, 2000, 123(2): 575-588.
[26]BieleskiRL.Phosphatepools,phosphatetransport,andphosphateavailability[J].AnnualReviewofPlantPhysiology, 1973, 24(1): 225-252.
[27]VanceCP,Uhde-StoneC,AllanDL.Phosphorusacquisitionanduse:Criticaladaptationsbyplantsforsecuringanonrenewableresource[J].NewPhytologist, 2003, 157(3): 423-447.
[28]庞欣, 李春俭. 部分根系供磷对小麦幼苗生长及同化物分配的影响[J]. 作物学报, 2000, 26(6): 719-724.
PangX,LiCJ.Effectofpartial-rootsupplyofPnutrientonthegrowthandassimilatedistributionofwheatseedlings[J].ActaAgronomicaSinica, 2000, 26(6): 719-724.
[29]段海燕, 徐芳森, 王运华. 甘蓝型油菜不同磷效率品种苗期根系生长及磷营养的差异[J]. 植物营养与肥料学报, 2002, 8(1): 65-69.
DuanHY,XuFS,WangYH.ThedifferenceofrootsystemgrowthandPnutritionintheseedlingsofrapecultivarswithdifferentP-efficiency[J].PlantNutritionandFertilizerScience, 2002, 8(1): 65-69.
[30]武志远. 粗山羊草和小麦耐低磷品种的筛选及Pht1基因的克隆与序列分析[D]. 开封: 河南大学, 2012.
WuZY.PhosphorusEfficientVarietiesSelectionandCloningandSequencesAnalysisofPht1GenefromAegilops tauschiiandWheat[D].Kaifeng:HenanUniversity, 2012.
[31]RaghothamaKG.Phosphateacquisition[J].AnnualReviewofPlantBiology, 1999, 50(1): 665-693.
[32]MarkouG.AlterationofthebiomasscompositionofArthrospira (Spirulina) platensisundervariousamountsoflimitedphosphorus[J].BioresourceTechnology, 2012, 116: 533-535.
[33]YuJ,YangYF.PhysiologicalandbiochemicalresponseofseaweedGracilaria lemaneiformistoconcentrationchangesofNandP[J].JournalofExperimentalMarineBiologyandEcology, 2008, 367(2): 142-148.
Inthispaper,X-raywasusedasthemutagentoconductthemutagenesisofGp. lemaneiformis.Carposporeswereprovedtobethebettermutagenicmaterialcomparedtostem-tipsandtheoptimalirradiationdosewasdeterminedtobe90Gy(Gray, 1Gy=1J/kg,istheabsorptionofonejouleofenergy,intheformofionizingradiation,perkilogramofmatter.).Approximately107~108carposporesweremutatedbyX-rayirradiationoutofwhich106~107seedlingssurvivedandweredividedinto2groupstobescreenedfurtherunderhightemperatureandlowphosphorusstress,respectively.
Thethermo-toleratescreeningmethodwassetupintwophases.Whencarposporesdevelopedinto2~3mmgermlings(4weeksaftermutagenesis),theyweresubjectedtoheatshockat41 ℃for30mininwaterbath.Followingfieldcultivationanddevelopmentofgermlingsintomaturealgae,theywereexposedtoheatshockof35 ℃for72hinincubator.Onemutantwithheattolerancewasobtained,namedWT-3,whichsurvivedafterthetwoscreeningphasesanddisplayedrapidgrowth.Low-phosphorustolerantstrainswerescreenedmainlybygrowthrateatbothseedlingandmaturestages.Thesamequantitiesofwildandmutatedcarposporicgermlingswereculturedunderthesamecondition.Theculturemediumwaswith10-2mg/Lphosphorusconcentrationandreplacedonceaweek.Thewildoneswereusedasthecontrol.Mutatedstrainsdisplayinghighergrowthratethanthemaximumofcontrolwereselected.Threemutantsoflow-phosphorustolerancewereobtained,namedWLP-1,WLP-9andWLP-22.Thespecificgrowthrate(SGR)ofthemwere2.79%, 2.72%and3.01%respectively,significantlyhigherthan2.21%(P<0.05),themaximumSGRofthewildstrains.
ItissafeandeffectivetousetheX-rayemittedfromthemedicalelectronlinearacceleratorasthemutagen.AndthenewlyreleasedcarposporeswithoutcellwallsaremuchmoresensitivetoX-rayirradiationtreatmentthanthestem-tips.TheresultindicatedthatthemutationmethodisappropriateforGp. lemaneiformis.
ThestudyprovidedefficientandfeasiblemutagenesisandscreeningprocedureforGp. lemaneiformis.Meanwhile,theselectedstrainscanbegoodcandidatesforgeneticresearchandcultivationapplicationsinthefuture.
责任编辑高蓓
X-Ray-Irradiation Mutation on Carpospores of Gracilariopsis lemaneiformisandScreeningofMutantswithSuperiorTraits
WEIHui-Hui,SUIZheng-Hong,WANGJin-Guo,DUQing-Wei,SHANGEr-Lei,MIPing,QUEZhou
(TheKeyLaboratoryofMarineGeneticsandBreeding,MinistryofEducation,OceanUniversityofChina,Qingdao266003,China)
Gracilariopsis lemaneiformis(Rhodophyte)isoneofthemostimportanteconomicmacroalgaeinChina.FollowingLaminariaandporphyra,ithasbecomethethirdlargestcultivatedseaweedinChinaandthecultivationscaleisincreasinglyenlarging.However,thesuitabletemperatureforgrowthofthewildpopulationis12~23 ℃.Althoughthethermo-tolerantcultivar981hasbeensuccessfullycultivatedinthesoutharea,it’sstillunabletosurviveinsummer.Inaddition,thephosphorusconcentrationisgenerallylowinmostmariculturearea,sometimesevenisbellow0.01mg/L.TheproductivityandqualityofGp. lemaneiforsisisseriouslyinfluenced.Inordertoenlargethecultivationarea,toextendthecultivationperiodandtoincreasetheproductivityandquality,itisurgentlyneededtoimproveitsheattolerance,low-phosphorustoleranceandgrowthrate.Therefore,itisessentialtoconductmutagenesisbreedingandselectiontoobtainmutantswithsuperiortraits.
X-raymutagenesis;heattolerance;low-phosphorustolerance;fastgrowing; Gracilariopsis lemaneiformis
山东省自主创新计划课题项目(2013CXC80202);国家自然科学基金项目(31372529)资助
2015-12-25;
2016-01-15
魏惠惠(1991-),女,硕士。E-mail:sydweihui@163.com
❋❋通讯作者:E-mail:suizhengh@ouc.edu.cn
Q949.2
A
1672-5174(2016)09-050-09
10.16441/j.cnki.hdxb/20150428
Supported by Independent Innovation Foundation of Shandong Province(2013CXC80202);National Natural Science Foundation of China (31372529)
