芋种子萌发特性的研究
2016-10-17孙亚林柯卫东黄新芳董红霞何燕红
孙亚林 柯卫东 黄新芳 董红霞 何燕红
(1武汉市蔬持科学研究所,湖北武汉 430065;2园艺植物生物学教育部重点实验室,华中农业大学园艺林学学院,湖北武汉 430070)
芋种子萌发特性的研究
孙亚林1柯卫东1黄新芳1董红霞1何燕红2
(1武汉市蔬持科学研究所,湖北武汉 430065;2园艺植物生物学教育部重点实验室,华中农业大学园艺林学学院,湖北武汉 430070)
以仰光×乐平及仰光×霞山2种杂交种子为试材,探究消毒方法、光照、温度、播种基质对芋种子萌发和生长的影响。结果表明:8%NaClO(无水酒精稀释)处理9min后用无水酒精清洗种子是最佳的芋种子消毒方法;种子或珍珠岩消毒对种子的萌发和子叶的生长无显著影响,但在有菌条件下,生长后期衍生出的细菌或真菌会影响子叶的后续生长;芋种子是喜光性种子,种子萌发的适宜温度为25~30 ℃;在培养土中,芋种子不萌发,湿润滤纸、无菌水、珍珠岩、沙子和MS培养基中芋种子的发芽率较高,但仅沙子和MS培养基中幼苗生长健壮;移栽于培养土后幼苗生长良好,成活率高达95%。
芋;种子萌发;光照;温度;基质;灭菌
芋〔Colocasia esculenta(L.)SChoot〕是天南星科芋属植物,也可作为观叶植物来栽培。国内外主要把芋作为蔬粮作物来研究,多探究其品种分类(张谷曼和杨振华,1984;李庆典,2004)、组织培养和脱毒技术(Chand & Pearson,1998;Zhou et al.,1999;刘玉平等,2003)、高产栽培技术(李春龙,2010)和病虫害防治(刘锡升和石军,2009;吕梅等,2010)。
目前芋的繁殖方式以无性繁殖为主,变异来源少,新品种选育困难。通过杂交育种,可使双亲的基因重新组合,有效增加变异类型,为新品种选育提供丰富的材料。为实现芋杂交育种,前人在成花诱导、种子采集和贮存等方面做了较多的研究。Katsura等(1986)、陆绍椿和李储学(1988)利用不同浓度的赤霉素水溶液处理萌动的种芋、植株和分生组织,可诱导二倍体和三倍体芋开花。Tyagi等(2004)指出可以通过空气烘干和硅胶干燥保存芋种子,当种子湿度为12%时,芋种子的发芽率最高可达80%。Strauss等(1979)研究发现芋种子在(22±2)℃、40%相对湿度条件下保存效果最好,种子在培养基上的萌发率在60%以上。PriCe等(2007)发现控制好温度与湿度,芋种子可以保存2 a以上,当种子存放温度为5 ℃和_20 ℃时,种子湿度应控制在10%~12%;种子存放在室温下时,种子湿度应控制为7.3%。但是有关种子萌发特性的系统性研究鲜见报道。
在前人研究的基础上,笔者成功诱导了芋开花,并获得了大量杂交种子(孙亚林等,2010)。本文旨在确定芋种子萌发所需的最佳条件,通过在最佳条件下提高种子萌发率,建立较为完善的种子萌发所需环境体系,为芋产生大量实生苗并从中选育出具有推广前景的新品种打下基础。
1 材料与方法
1.1试验材料
试验所用的芋种子是由2013年7~8月武汉市蔬持科学研究所“国家种质武汉水生蔬持资源圃”里的芋经过人工授粉方式得到的,包括仰光红梗芋和乐平野芋的杂交种(以下简称仰光×乐平)及仰光红梗芋与霞山叶用芋的杂交种(以下简称仰光×霞山),2013年10月种子采收后,用塑料袋密封,常温保存。2014年2~3月,在国家种质武汉水生蔬持资源圃进行种子萌发特性试验。
1.2消毒处理对芋种子萌发率的影响
1.2.1芋种子消毒处理 参考Wang(1983)的芋种子消毒方法,做适当修改,对种子进行4种不同的消毒处理:用8%NaClO(无水酒精稀释)分别处理3、6、9min后再用无水酒精清洗;用8%NaClO(蒸馏水稀释)处理9min后蒸馏水清洗。清洗种子2~3次,每次1min,直至没有乳白色悬浊物产生,将处理后的种子接种到无菌的MS培养基上,光照/黑暗为12 h/12 h、30 ℃恒温条件下培养,7d后观察培养皿中芋种子周围是否长出细菌或真菌。每处理30粒种子,3次重复。
1.2.2芋种子和基质消毒处理 以仰光×乐平的杂交种子为试材,珍珠岩为培养基质,设置4个处理:种子消毒、珍珠岩消毒,种子消毒、珍珠岩不消毒,种子不消毒、珍珠岩消毒,种子不消毒、珍珠岩不消毒。处理后置于光照/黑暗为12 h/12 h、30 ℃恒温条件下培养,观察统计种子的萌发率、子叶和真叶长出时间。其中珍珠岩消毒采用120 ℃高压灭菌20min,芋种子消毒采用8%NaClO(无水酒精稀释)消毒9min后用无水酒精清洗的方法。每处理30粒种子,3次重复。
1.3外界环境条件对芋种子萌发率的影响
为了排除外界细菌或真菌的干扰,本次试验中的种子与基质都经过消毒处理,其中种子采用8%NaClO(无水酒精稀释)消毒9min后无水酒精清洗的方法,所有基质于120 ℃高压灭菌20min后备用。每个处理20粒种子,3次重复。
1.3.1光照处理 在25 ℃条件下,将仰光×乐平杂交种子播种于MS培养基中,分别放置于光照培养室(光照/黑暗为12 h /12 h)和黑暗培养室中培育。处于黑暗处理中的种子要在暗绿色的光下观察其发芽情况(Strauss et al.,1979)。
1.3.2温度处理 在光照/黑暗为12 h/12 h条件下,将仰光×乐平杂交种子播于MS培养基中,分别放于温度为15、20、25 ℃和30 ℃的智能光照培养箱(瑞华,HP300G型)中培育。
1.3.3基质处理 在光照/黑暗为12 h /12 h、25 ℃恒温条件下,将仰光×乐平、仰光×霞山杂交种子分别接种到无菌水、湿润滤纸、珍珠岩、沙子、培养土和MS培养基中培育。
1.4移栽方法
参照龙春林等(2005)的方法,当幼苗长出真叶、根系发育良好时,用镊子轻轻取出植株,用水洗净根部黏附的MS培养基,其他基质中的植株直接取出。幼苗转入以珍珠岩为基质的塑料杯中进行炼苗,浇透定根水,用塑料薄膜封口,放入30 ℃左右的恒温箱中驯化7~14d。移栽前5d去除塑料薄膜,加少量水保湿(宋喜贵和余小平,2004),然后移栽到培养土中,放于玻璃温室中培育。
1.5统计分析
从播种当天开始每天观察发芽率及子叶和真叶长出所需时间。当种子长出明显的胚轴(显绿)时认为其已萌芽。所有数据隔天记录1次,直至没有新萌发的种子出现。利用ExCel 2013软件和DPS 9.50软件进行数据处理和方差分析。
2 结果与分析
2.1不同消毒方法对芋种子的消毒效果
8%NaClO(蒸馏水稀释)处理种子时,芋种子体积小、质量轻,易粘在试管壁上无法进行有效的消毒处理,经MS培养基培养,细菌或真菌污染率高达63.33%,显著高于其他处理。用无水酒精稀释而成的8%NaClO处理芋种子,种子均沉至底,消毒处理易操作,且随着消毒时间的延长,杀菌效果越好(表1)。8%NaClO (无水酒精稀释)处理9min再后用无水酒精清洗对种子的消毒效果最佳,种子均不长菌。
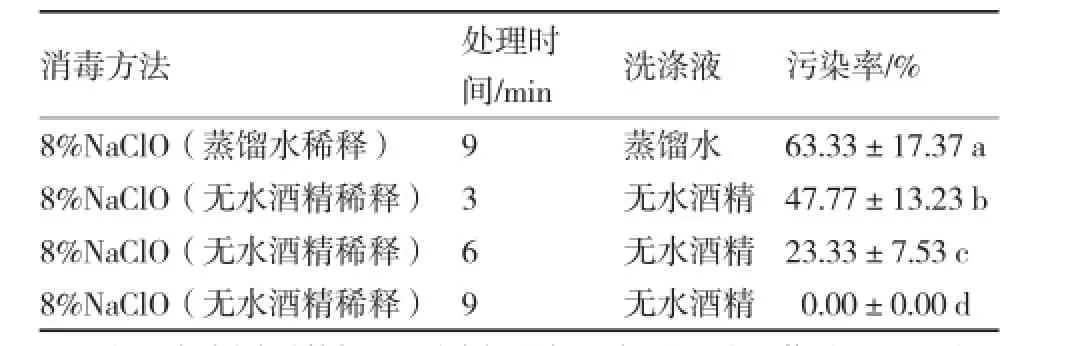
表1 不同消毒方法对芋种子的消毒效果
2.2芋种子或基质消毒对种子萌发和生长的影响
如表2所示,芋种子和基质是否消毒对芋种子的萌发率和子叶长出所需要的时间没有显著影响,但在种子和基质都消毒的条件下,真叶长出所需时间最长。试验中发现,在种子或珍珠岩不消毒的条件下,存在子叶长出后无法正常生长,幼苗腐烂死亡的现象。表明虽然种子或珍珠岩是否消毒对种子的萌发和子叶的生长时间无显著影响,但在有菌条件下生长后期衍生出的细菌或真菌会影响子叶的后续生长。

表2 种子或基质消毒对芋种子萌发和生长的影响
2.3外界环境条件对芋种子萌发的影响
2.3.1光照对芋种子萌发的影响 如表3所示,在光照条件下,芋种子的萌发率显著高于黑暗条件下的萌发率,芋种子长出子叶和真叶所需时间显著短于黑暗条件的处理;且在黑暗条件下,幼苗茎部细长,长势不良,子叶发黄;在光照条件下,幼苗长势一致,根系发达,叶片翠绿,植株健壮。

表3 光照对芋种子萌发和生长的影响
2.3.2温度对芋种子萌发的影响 光照/黑暗为12 h /12 h条件下,在15 ℃时,芋种子均不能萌发。随着温度的升高,芋种子的萌发率逐渐增加,子叶和真叶长出所需时间也逐渐缩短。在30 ℃条件下的萌发率最高,其子叶和真叶长出所需时间也最短,分别为5d和13d左右。但25 ℃和30 ℃条件下,种子的萌发率和子叶、真叶长出时间无显著差异(表4)。

表4 温度对芋种子萌发和生长的影响
2.3.3播种基质对芋种子萌发的影响 芋种子的萌发率随基质和杂交种子的不同而变化(表5)。基质为培养土时,仰光×乐平和仰光×霞山的杂交种子的萌发率均为0,基质为湿润滤纸、珍珠岩、无菌水和沙子培养基中时种子的萌发率无显著差异。仰光×乐平和仰光×霞山2种杂交种子的子叶和真叶长出所需时间在MS培养基中最短,分别为6.00~7.67d和13.33~15.33d。真叶长出所需的时间在无菌水、珍珠岩和湿润滤纸中较长,均需要19d以上。此外,在湿润滤纸上和无菌水中,幼苗的生长势较差,根系瘦弱而且很长,需要较长时间才能长出真叶且叶片发黄;在沙子上芋种子的发芽率不是最高的,但幼苗生长健壮,根系较短且粗壮,叶片翠绿(图1)。

表5 不同基质对芋种子萌发和生长的影响

图1 播种基质对仰光×乐平杂交种子萌发和生长的影响
2.4 不同基质对移栽方法和幼苗成活率的影响
由试验操作可以得到不同基质中幼苗移栽的时间,具体操作流程:①mS培养基中的幼苗长至3~4Cm高、具3~5片叶片、根系发育良好时,用镊子轻轻取出植株,注意不要伤及根和叶片,用水洗净根部黏附的培养基,再转入以珍珠岩为基质的塑料杯中;②因为没有养分供应,无菌水和滤纸上的幼苗长出子叶后就可转入以珍珠岩为基质的塑料杯中;③珍珠岩和沙子中的幼苗长到3Cm左右、具真叶时就可转入以珍珠岩为基质的塑料杯中;④移苗后浇透定根水,用塑料薄膜封口,放入30 ℃左右的恒温箱中驯化7~14d;⑤移栽前5d去除塑料薄膜并加少量自来水保湿,随后移栽到养分充足的培养土中。移栽后注意保温保湿,加强水肥管理和通风,幼苗的成活率高达95%。
3 结论与讨论
真菌的侵染是芋种子萌发和生长过程中遇到的主要问题(Wang,1983)。本试验结果表明种子与基质消毒灭菌处理对芋种子的萌发率和幼苗生长速度的影响不大,但在有菌条件下,种子萌发后不能正常生长或死亡。
适宜的光照、充足的水分和较高的温度是芋种子萌发的三大环境要素。本试验结果表明,芋种子在光照条件下易萌发,且长势良好,而在黑暗条件下萌发困难,生长状况不佳。由此可见,芋种子是喜光性种子,光照是芋种子萌发和正常生长的必要条件。此外,芋原产于热带和亚热带地区,其萌发和生长都需要高温高湿的环境。12 ℃以下芋生长停滞,日均温15 ℃左右生长缓慢,生长最适温度为25~35 ℃(Puiatti et al.,2010)。本试验发现,15 ℃时,温度过低抑制了芋种子萌发;在20~30℃范围内种子都能萌发,且随着温度的升高发芽率逐渐增加,30 ℃时发芽率最高。
播种基质影响芋种子的萌发和生长。基质为培养土时,因芋种子体积小,播种后均掉落于培养土的孔隙中,处于黑暗条件,种子不易萌发,此结果与前文所述芋种子的萌发需要光照的结论一致。种子从开始萌发到形成幼苗这一生长过程主要依赖种子内现成的有机养料来提供营养(强胜,2006),但后期依赖基质中的养分。滤纸、无菌水和珍珠岩中种子的萌发率并不比沙子和MS培养基中种子的萌发率低,但后期幼苗的根系细长,茎部瘦弱,子叶和真叶生长缓慢且叶片发黄,长势不良,如果移栽不及时,成活困难。芋幼苗在沙子和MS培养基上生长健壮,但是MS培养基的成本高,移栽过程中MS培养基的残留易导致细菌的滋生,因此沙子是作为芋种子萌发最适宜的播种基质。
李春龙.2010.魔芋的繁殖方法及栽培技术.科学种养,5(12):23_23.
李庆典.2004.芋(Colocasia esculenta)民族植物学研究及遗传多样性分子评价〔博士论文〕.长沙:湖南农业大学.
刘锡升,石军.2009.芋头栽培技术规程.山东蔬持,14(1):27_28.
刘玉平,柯卫东,黄新芳,彭静.2003.试管芋诱导的研究.园艺学报,30(1):43_46.
龙春林,程治英,蔡秀珍.2005.大野芋种子形成丛生芽的微繁殖.植物分类与资源学报,27(3):327_330.
陆绍椿,李储学.1988.诱导芋头开花的初步研究.菜阳农学院学报,5(3):66_69.
吕梅,陈志兴,张勇.2010.荔蒲芋头栽培技术探讨.农技服务,27(11):1408_1408.
强胜.2006.植物学.北京:高等教育出版社.
孙亚林,柯卫东,黄新芳,李明华.2010.赤霉素诱导槟榔芋开花试验.长江蔬持,27(14):68_69.
宋喜贵,余小平.2004.大野芋的组织培养和植株再生.植物生理学报,16(5):583_583.
张谷曼,杨振华.1984.中国芋的染色体数目研究.园艺学报,11(3):187_191.
Chand H,Pearsonm N.1998.Rapid vegetativemultipliCation in Colocasia esculenta (L.)SChott (taro).Plant Cell,Tissue and Organ Culture,55(3):223_226.
Katsura N,Takayanagi K,Sato T.1986.GibberelliC aCid induCed flowering in Cultivars of Japanese taro.Engeigakkai Zasshi,55 (1):69_74.
Puiattim, Lopes W, Junior R,李峰.2010.巴西芋头概况.长江蔬持,11(14):6_10.
PriCe T V,Poka K,Bogareig,Chan A,Okpul T.2007.EffeCt of seed storage under ambient and Cold temperatures ongermination of taro seed (Colocasia esculenta).Seed SCienCe and TeChnology,35(3):674_687.
Straussm S,MiChaud Jd,Arditti J.1979.Seed storage andgermination and seedling proliferation in taro,Colocasia esculenta(L.)SChott.Annals of Botany,43(5):603_612.
Tyagi A P,Taylorm,Deo P C.2004.Seedgermination and seedlingdevelopment in taro (Colocasia esculenta).The South PaCifiCJournal of Natural and Applied SCienCes, 22(1): 62_66.
Wang J K.1983.Taro:a review of Colocasia esculenta and its potentials.Hawaii:University of Hawaii Press.
Zhou S P,He Y K,Li S J.1999.InduCtion and CharaCterization of in vitro Corms ofdiploid_taro.Plant Cell,Tissue and Organ Culture,57(3):173_178.
Studies on Characteristics of Taro Seedgermination
SUN Ya_lin1,KE Wei_dong1,HUANG Xin_fang1,DONG Hong_xia1,HE Yan_hong2
(1Wuhan City Vegetable Research Institute,Wuhan 430065,Hubei,China;2Key Laboratory of Horticultural Plant Biology,Ministry of Education,College of Horticulture and Forestry Sciences,Huazhong Agricultural University,Wuhan 430070,Hubei,China)
Taking hybrid taro〔Colocasia esculenta(L.)SChoot〕seeds ‘Yangguang×Leping’ and‘Yangguang×Xiashan’ as experimentalmaterial,this study explored the effeCts ofdisinfeCtionmethod, light,temperature,sowing substrate on tarogermination andgrowth.The results showed that washing taro seeds with anhydrous alCohol after treating them with 8% NaClO(anhydrous alCoholdiluted)for 9minutes was the best seeddisinfeCtionmethod.There was no signifiCant effeCt on seedgermination and Cotyledongrowth by seed or perlitedisinfeCtion,but baCteria or fungiderived at latergrowth stagemight affeCt the subsequentgrowth of Cotyledon. Light is essential for taro seedgermination and the optimum temperature for seedgermination is 25_30 ℃.Seedgermination rates were relatively higher inmoistened filter paper,sterile water,sand,perlite andmS substrate,while no seed Couldgerminate in Cultivation soil.However, seedlingsgrew strongly on sand andmS substrate,andgrew well after being transplanted in Cultivation soil.Their survival rate was high up to 95%.
Taro;Seedgermination;Light;Temperature; Substrate;Sterilization
孙亚林,男,农艺师,专业方向:水生蔬持栽培与育种,E_mail:kevinCan@163.Com
2015_12_18;接受日期:2016_03_30
科技部“十二五”国家科技支撑计划项目(2012BAD_ 2700)
