直肠癌术前MRI对异时远处转移的预测价值评估
2016-10-17刘欢欢汪登斌沈伟崔艳芬张财源崔龙傅佶泓
刘欢欢, 汪登斌, 沈伟, 崔艳芬, 张财源, 崔龙, 傅佶泓
·腹部影像学·
直肠癌术前MRI对异时远处转移的预测价值评估
刘欢欢, 汪登斌, 沈伟, 崔艳芬, 张财源, 崔龙, 傅佶泓
目的:探讨直肠癌术前MRI对异时远处转移的预测价值。方法:回顾性分析291例经手术病理证实为直肠癌患者治疗前的MR资料及随访资料,分析直肠癌MR征象与异时远处转移的相关性,分析异时远处转移的独立危险因素,并与病理结果进行对照。结果:291例患者中69例(23.7%)发生异时远处转移。单因素分析结果表明治疗前癌胚抗原(CEA)水平(P<0.001)、mrT分期(P=0.037),mrN分期(P<0.001)和环周切缘状态(mrCRM)(P<0.001)与直肠癌异时远处转移具有相关性。多因素分析结果显示CEA升高(P<0.001)、mrN2期(P=0.013)和mrCRM(P=0.001)受侵是直肠癌异时远处转移的独立危险因素。相比于mrN0患者,mrN1和mrN2期患者发生异时远处转移的危险比值比(OR值)分别为1.93和2.60。病理结果亦证实N分期为远处转移的危险因素。结论:直肠癌术前mrN分期是直肠癌异时远处转移的独立危险因素,有助于筛选远处转移的高危患者,从而采取个性化治疗,以提高预后。
磁共振成像; 直肠肿瘤; 淋巴结; 肿瘤转移
直肠癌是胃肠道常见的恶性肿瘤,其发病率呈逐年上升趋势[1]。随着直肠癌全直肠系膜筋膜切除术(total mesorectal excision,TME)的开展以及放化疗的应用,直肠癌局部复发率已降至10%以下[2]。然而,直肠癌患者远处转移的发病率仍处于较高水平,发病率约20%~50%[3]。直肠癌远处转移的患者预后较差,文献报道直肠癌肝转移患者的2年生存率仅为3%,4年生存率为0[4]。对于直肠癌肝脏或肺转移的患者,行手术切除治疗后的5年生存率可提高至40%和56.2%[5]。因此,术前筛选直肠癌远处转移的高危人群,对其进行个性化的治疗方案,对提高患者预后具有重要的意义。目前,有关直肠癌远处转移患者的预后研究多依据病理结果[4,6,7]。而术前MRI对直肠癌异时远处转移的预测价值研究报道较少。本文旨在探讨直肠癌术前MRI对直肠癌异时远处转移的预测价值,为术前筛选远处转移的高危人群提供无创性的检查手段,以提高患者预后。
材料与方法
1.临床资料
本研究经院伦理委员会同意。回顾性分析2010年1月-2011年12月经手术病理证实为直肠癌并具有完整影像资料的患者415名。排除标准:①合并其他原发肿瘤(n=16);②姑息性手术切除者(n=35);③同时转移者,即术中发现远处转移或术后6个月内出现远处转移者(n=45);④失访者(n=28)。最终纳入研究者291例,其中男108例,女183例,年龄30~89岁,中位年龄62岁。患者的临床表现包括排便习惯改变、便血等。109例患者手术前接受新辅助化疗或者放疗结合化疗治疗,182例患者术前未行新辅助治疗;128例患者手术后依据病理结果行化疗治疗。
2.MRI检查技术
患者于检查前1 d开始流质饮食,检查前2 h肛注开塞露清洁肠道。采用GE 3.0T Signa HDxt磁共振设备进行扫描,使用8通道相控阵线圈。扫描序列:矢状面T2W,TE 102 ms,TR 4600 ms;横断面T2W,TE 102 ms,TR 4600 ms和冠状面T2W,TE 102 ms,TR 2780 ms,层厚3 mm,层间距1 mm,矩阵256×256,视野25 cm×25 cm~28 cm×28 cm。
3.CT检查技术
为评估患者远处转移情况,患者术前均行胸部及上腹部增强CT检查。采用第一代双源CT(Siemens Somatom Definition Flash,Germany)进行扫描。患者均行平扫、动脉期及门脉期扫描,扫描范围从肺尖至双肾下极水平。增强扫描采用高压注射器经肘前静脉团注非离子型对比剂优维显(300 mg I/mL)70~120 mL(1.5 mL/kg),注射流率2.0~3.0 mL/s。动脉期扫描采用Smart-pre软件技术(低剂量曝光实时监测腹主动脉CT值,当达到阈值100 HU时自动启动正式扫描),门静脉期为延迟70 s进行扫描。扫描参数:管电压120 kV,管电流200 mAs,螺距0.6,层厚、层间距5 mm。
4.图像分析
采用影像工作站从医学图像存储及传输系统(PACS)存储服务器调阅影像,由两位具有胃肠道肿瘤分期的影像专家共同分析治疗前的MR影像,阅片过程中不同意见由协商达成一致。两位专家阅片前均不知晓患者的手术病理结果。直肠癌MR征象评估包括肿瘤高度(肿瘤距离肛缘距离)、肿瘤长径、T分期(mrT)、N分期(mrN)和环周切缘(circumferential resection margin,mrCRM)受侵情况。直肠癌TN分期依据第7版美国癌症联合委员会(AJCC)/国际抗癌联盟(UICC)TNM分期系统[8]。T分期标准:T1:肿瘤侵犯黏膜下层;T2:肿瘤侵犯固有肌层;T3:肿瘤穿透固有肌层至浆膜下或进入无腹膜包裹的直肠旁组织中;T4:肿瘤穿透腹膜脏层或直接侵犯或粘连于其他器官或结构。因MRI对T1和T2鉴别困难,因此,本研究将T1和T2期归类为T1-2期。N分期标准:Nx:区域淋巴结无法评估;N0:无区域淋巴结转移;N1:1~3枚区域淋巴结转移;N2:4枚以上区域淋巴结转移。转移淋巴结的诊断标准采用短径≥5 mm(图1)或边缘模糊、信号不均匀者[8](图2)。CRM受侵定义为肿瘤原发病灶、癌结节或转移淋巴结距离直肠系膜筋膜的最短距离≤1 mm[9](图3)。
5.手术及组织病理学检查
所有患者手术均遵循TME原则,手术均经组织病理学检查。病理结果包括肿瘤病理分级、病理类型、肿瘤浸润深度以及淋巴结转移情况。将病理TN分期的结果与mrT分期及mrN分期结果对照,分析MRI评估TN分期的准确度。
6.随访
患者行直肠癌根治术后,均行直肠镜和血清癌胚抗原检测进行随访复查,术后2年内每3个月检查一次,后3年每6个月检查一次,随后每1年复查一次。术后第6个月行胸腹盆CT检查,后每1年复查一次。出现异时远处转移者的记录转移部位及转移时间,异时远处转移定义为手术至首次发现远处转移的时间>6个月者。
7.统计学分析
采用SPSS 19.0统计学软件进行数据分析,P<0.05为差异具有统计学意义。选取阈值将本研究中的计量资料转换成计数资料。采用χ2检验分析患者临床及影像各指标与直肠癌异时远处转移的相关性,将单因素分析中具有统计学意义的指标纳入多因素Logistic回归模型中,分析异时远处转移的独立危险因子。将病理结果作为金标准分析异时远处转移的危险因子。采用Kappa分析比较两位专家评估mrT分期和mrN分期的一致性。
结 果
1.随访结果
本研究随访时间截止至2014年12月,随访时间为36~59个月,中位随访时间为41个月。291例患者中共69例(23.7%)发生异时远处转移,肝脏转移34例,肺转移17例,同时伴有肝脏和肺转移10例,骨转移2例,脑转移1例和卵巢转移2例。其中,21例(30.4%)远处转移经手术病理证实,其余因为多发病灶无法手术者,依据CT图像上典型影像表现诊断。
2.直肠癌部位及手术方式
肿瘤高度为4.2~14.4 cm,平均为(7.5±2.8) cm。肿瘤长径为1.5~12.3 cm,平均为(4.9±1.7) cm。上段直肠癌27例,中段直肠癌92例,下段直肠癌172例。206例行直肠前切除术,61例行腹-会阴联合切除术,24例行hartmann术,手术时间在新辅助化疗或放化疗后的4~8周进行。术中探查117例肿瘤位于腹膜反折下方,72例位于腹膜反折水平,102例位于腹膜反折上方。
3.MRI分期及病理分期
MRI T分期:mrT1-2期41例,mrT3期243例,mrT4期7例。MR图像中共发现淋巴结1967枚。其中,362枚淋巴结短径≥5 mm,或边缘不规则、信号不均匀。MRI N分期:mrN0期193例,mrN1期51例和mrN2期47例。两位专家对mrT分期及mrN分期诊断结果一致性良好(k=0.893,k=0.842)。
病理T分期:T1-2期70例,T3期216例,T4期5例。手术标本中共检出淋巴结4005枚,pN0者 154例,pN1者74例,pN2者63例。
为避免术前新辅助治疗对术后手术标本病理学评估的影响,本研究选取182例术前未行新辅助治疗患者的术后病理结果作为参考标准来评估MRI评估T分期和N分期的准确性。mrT3-4分期的准确率为75.8%,灵敏度为89.3%,特异度为47.5%。mrN分期的准确率为81.3%, 灵敏度为58.9%,特异度为91.3%。
4.直肠癌异时远处转移危险因素分析
患者临床-影像征象与直肠癌异时远处转移相关性的单因素及多因素logistic回归分析(表1、2)。mrT分期、mrN分期及mrCRM受侵与异时远处转移具有显著相关性,而多因素分析结果表明mrN分期和mrCRM受侵为独立的危险因素。
本研究分析182例术前未行新辅助治疗患者的术后淋巴结转移与异时转移的相关性,单因素分析结果表明相比于pN0期,pN阳性患者的危险比值比(Odds ratio,OR)值为4.11(P=0.002),95%可信区间为1.71~9.85。

表1 临床影像因素与异时远处转移的logistic回归分析结果
注:OR值(Odds Ratio),危险比值比(CI:confidence interval,可信区间),CRM(circumferential resection margin,环周切缘)。
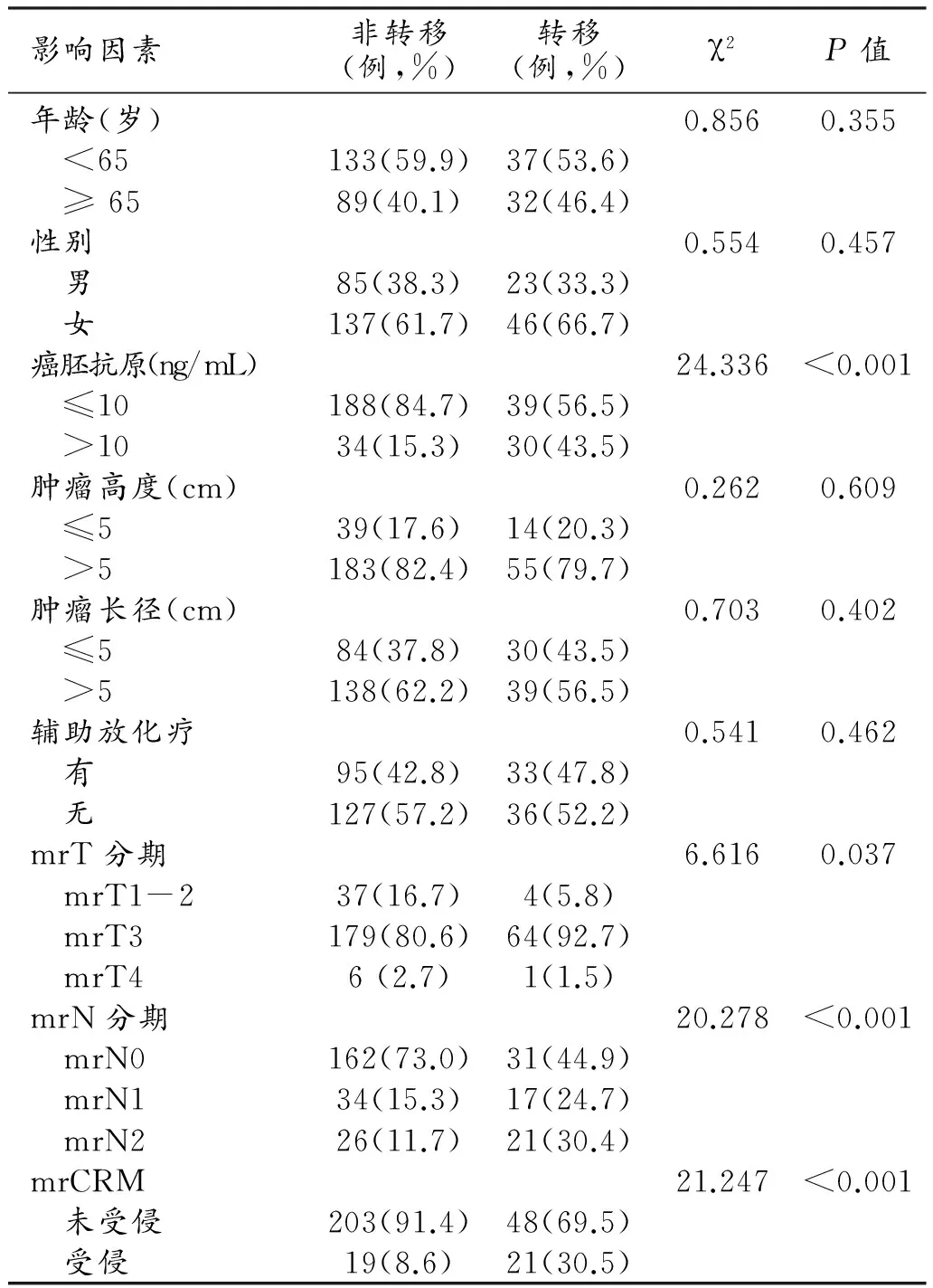
表2 临床影像征象与异时远处转移相关性的单因素分析结果
讨 论
本文通过对直肠癌MRI征象与异时远处转移相关性研究的单因素和多因素分析结果显示直肠癌mrN分期与直肠癌异时远处转移具有显著相关性。笔者通过分析病理淋巴结转移与异时远处转移相关性亦证实淋巴结受侵为其危险因素,与以往学者研究直肠癌异时性肺转移的危险因素以及直肠癌同时远处转移的危险因素结果一致[7,8]。本研究结果提示直肠淋巴结转移的患者为术后异时远处转移的危险人群,对高危人群术前可加大术前系统治疗的强度以提高患者预后[8]。对于患者术后的随访亦可缩短行CT复查的时间,争取早期发现转移病灶,采取积极治疗手段改善预后。
淋巴结转移是影响直肠癌患者预后的重要因素。MRI具有高软组织分辨率和多平面成像的优点,目前已成为直肠癌术前评估的首选。研究报道MRI对直肠癌T分期的诊断准确率可达88.6%[10],而由于淋巴结微转移和炎性反应性增生的存在,MRI对淋巴结转移的诊断准确率差异较大。Ogawa等[11]报道MRI对淋巴结转移的诊断准确率为57%~85%。因此,转移淋巴结的评估对于临床医生仍然是一个难题。近年来,研究报道显示MR弥散加权成像、增强扫描MR以及淋巴结短径联合形态和信号有助于提高淋巴结转移诊断准确率[1,12,13],但目前对于淋巴结转移尚无统一的诊断标准。本研究采用5mm淋巴结短径为诊断阈值联合其形态及信号,诊断的准确率达到81.3%,特异度达91.3%,表明该诊断标准诊断效能较好。通过多因素分析研究发现,相比于mrN0患者,mrN1和mrN2期患者的异时远处转移的危险比值比分别为1.93倍和2.60倍。因此,对于淋巴结转移的患者术前应积极采取个性化治疗方案,降低远处转移率。近年来,直肠癌患者TME的应用联合术前新辅助治疗以及术后辅助治疗已将局部复发率降至10%以下,但对总体生存预后无明显改进,其重要影响因素之一为远处转移[14]。患者行术前放疗以及手术根治术使部分患者的耐受性降低,无法完全配合完成术前以及术后足量、足疗程的化疗,从而影响患者的预后,远处转移率亦未得到明显降低。Chua等[14]研究表明对于MRI评估的低危直肠癌患者,可在术前常规的放化疗之前采用全身足量的卡培他滨和奥沙利铂的诱导化疗,然后再行常规的新辅助放化疗、手术治疗以及术后化疗。这种足量的全身化疗可以根除微转移灶,从而降低远处转移发生率,改善预后。
本研究结果显示mrT分期与直肠癌异时远处转移具有相关性,但不是独立的危险因素。孙毅等[4]研究表明局部肿瘤浸润深度每增加一个等级,死亡的风险度将增加1.743倍。其原因可能为本研究中27例T1-2期的患者高估为T3期患者,造成评估的误差;T4期患者的例数较少,可能对统计结果有一定的影响。目前,MRI对于鉴别直肠癌T2期和T3期具有一定的难度,T2期患者往往被诊断为T3期,造成高估的原因主要是病变周围局部纤维化或炎症、感染或血管病变造成的改变常被误诊为肿瘤浸润的征象[10]。因此,今后需要提高直肠癌mrT2期和mrT3期的诊断准确率,进一步研究mrT分期对异时远处转移的预测价值。
CRM受侵亦是影响直肠癌预后重要因素。Taylor等[15]以1mm为阈值诊断CRM受侵,发现CRM受侵与直肠癌局部复发具有显著相关性。而Sohn等[8]采用2mm为阈值发现CRM受侵与直肠癌同时远处转移有相关性,但不是独立的危险因子。因此,目前CRM受侵的诊断阈值以及其预后价值尚未达成一致。本研究以1mm为诊断阈值,结果表明mrCRM受侵为异时远处转移的独立危险因素。然而,因术前MRI提示CRM受侵的患者均在术前行新辅助的放化疗。因此,本研究无法评估MRI评估CRM的诊断效能。有关CRM对异时远处转移的预测价值尚需进一步研究。
本研究存在一定的局限性。①存在一定的患者选择偏倚;②T4分期患者的病例数较少,今后将扩大样本量进一步研究;③多数远处转移病灶发现时已缺乏手术指征,缺乏病理结果证实,主要依靠典型的CT表现进行诊断。
综上所述,直肠癌淋巴结转移是影响患者预后的重要因素。临床工作中将短径≥5mm或形态不规则、信号不均匀作为淋巴结转移的诊断标准有助于筛选出直肠癌异时远处转移的高危人群,对临床术前治疗方案以及术后随访方案的选择具有重要意义。
[1]Cho EY,Kim SH,Yoon JH,et al.Apparent diffusion coefficient for discriminating metastatic from non-metastatic lymph nodes in primary rectal cancer[J].Eur J Radiol,2013,82(11):e662-668.
[2]Bosset JF,Collette L,Calais G,et al.Chemotherapy with preoperative radiotherapy in rectal cancer[J].N Engl J Med,2006,355(11):1114-1123.
[3]Rasanen M,Carpelan-Holmstrom M,Mustonen H,et al.Pattern of rectal cancer recurrence after curative surgery[J].Int J Colorectal Dis,2015,30(6):775-785.
[4]孙毅,尚革,包永星,等.77例直肠癌伴肝转移患者的预后因素分析[J].中国肿瘤杂志,2010,32(8):622-625.
[5]Kanas GP,Taylor A,Primrose JN,et al.Survival after liver resection in metastatic colorectal cancer:review and meta-analysis of prognostic factors[J].Clin Epidemiol,2012,4(1):283-301.
[6]刘彦龙,杨艳梅,王锡山.314例直肠癌患者术后复发转移形式及其预后[J].中华胃肠外科杂志,2010,13(8):572-576.
[7]姚蒙洁,李浩,徐建,等.直肠癌异时性肺转移的危险因素及治疗分析[J].中国现代普通外科进展,2015,18(3):206-209.
[8]Sohn B,Lim JS,Kim H,et al.MRI-detected extramural vascular invasion is an independent prognostic factor for synchronous metastasis in patients with rectal cancer[J].Eur Radiol,2015,25(5):1347-1355.
[9]Ucar A,Obuz F,Sokmen S,et al.Efficacy of high resolution magnetic resonance imaging in preoperative local staging of rectal cancer[J].Mol Imaging Radionucl Ther,2013,22 (2):42-48.
[10]唐娜,尚乃舰,张红霞,等.MRI对直肠癌术前T分期的诊断价值[J].实用放射学杂志,2013,29(4):583-585.
[11]Ogawa S,Itabashi M,Hirosawa T,et al.A logistic model including risk factors for lymph node metastasis can improve the accuracy of magnetic resonance imaging diagnosis of rectal cancer[J].Asian Pac J Cancer Prev,2015,16(2):707-712.
[12]谢伟,靳二虎,马俊芳,等.增强MRI诊断直肠癌淋巴结转移的价值[J].放射学实践,2013,28(5):547-549.
[13]Al-Sukhni E,Milot L,Fruitman M,et al.Diagnostic accuracy of MRI for assessment of T category,lymph node metastases,and circumferential resection margin involvement in patients with rectal cancer:a systematic review and meta-analysis[J].Ann Surg Oncol,2012,19(7):2212-2223.
[14]Chua YJ,Barbachano Y,Cunnungham D,et al.Neoadjuvant capecitabine and oxaliplatin before chemoradiotherapy and total mesorectal excision in MRI-defined poor-risk rectal cancer:a phase 2 trial[J].Lancet Oncol,2010,11(3):241-248.
[15]Taylor FG,Quirke P,Heald RJ,et al.Preoperative magnetic resonance imaging assessment of circumferential resection margin predicts disease-free survival and local recurrence:5-year follow-up results of the MERCURY study[J].J Clin Oncol,2014,32(1):34-43.
Evaluation of prognostic value for preoperative MRI in predicting metachronous distant metastasis of rectal cancer
LIU Huan-huan,WANG Deng-bin,SHEN Wei,et al.
Department of Radiology,Xinhua Hospital affiliated to Shanghai Jiaotong University School of Medicine,Shanghai 200092,China
Objective:To investigate the prognostic value of preoperative MRI in predicting metachronous distant metastasis of rectal cancer.Methods:Pretreatment MRI and follow-up data of 291 patients with primary rectal cancer proved by histopathology were retrospectively analyzed.The correlations of MRI features and metachronous distant metastasis were evaluated.The independent risk factors of metachronous distant metastasis were analyzed.The histopathological results were used as the reference standard.Results: Among 291 patients,69 patients (23.7%) were confirmed to have metachronous distant metastasis.Pretreatment CEA level (P<0.001),mrT staging (P=0.037),mrN staging (P<0.001) and circumferential resection margin (mrCRM) status (P<0.001) were significantly correlated with distant metastasis in univariate analysis.Multiple-factor analysis showed elevated CEA level (P<0.001),mrN2 staging (P=0.013) and mrCRM involvement (P=0.001) were independent risk factors for distant metastasis.Compared with odds ratios of metachronous distant metastasis in mrN0 staging,the odds ratios in mrN1 staging and mrN2 staging were 1.93 and 2.60 respectively.Pathological results also confirmed that N-staging was risk factor for distant metastasis.Conclusion: Preoperative mrN staging is an independent risk factor for metachronous distant metastasis in patient with rectal cancer,it can help to screen high-risk patients for individual treatment to improve prognosis.
Magnetic resonance imaging; Rectal neoplasms; Lymph nodes; Neoplasm metastasis
200092上海,上海交通大学医学院附属新华医院放射科 (刘欢欢、汪登斌、崔艳芬、张财源);200092上海,上海交通大学医学院附属新华医院肛肠外科(沈伟、崔龙、傅佶泓)
刘欢欢(1989-),女,江西新余人,博士研究生,主要从事腹部疾病影像诊断。
汪登斌,E-mail:dbwang8@aliyun.com
国家自然科学基金(No.81371621、No.81171389)、上海市卫生系统优秀学科带头人培养计划(No.XBR2013110)
R445.2; R735.37; R322.25; R73-37
A
1000-0313(2016)06-0506-05
10.13609/j.cnki.1000-0313.2016.06.007
2015-11-09
2016-01-14)
