不同辐照剂量下兔同种异体半月板移植的大体和组织学研究
2016-10-15张晋陈星佐宋关阳李岳李旭王雪松冯华
张晋陈星佐宋关阳李岳李旭王雪松冯华
1北京积水潭医院运动损伤科(北京100035)2中日友好医院骨科
不同辐照剂量下兔同种异体半月板移植的大体和组织学研究
张晋1陈星佐2宋关阳1李岳1李旭1王雪松1冯华1
1北京积水潭医院运动损伤科(北京100035)2中日友好医院骨科
目的:许多研究认为gamma射线对同种异体移植物生物力学强度的破坏存在剂量依赖性,不过,尚无研究证实这种强度的减低与半月板移植术(MAT)后高的失效率有关。本研究目的为明确应用gamma射线辐照的半月板行MAT术后,移植半月板及关节软骨在形态学与组织学上的变化。方法:60只新西兰大耳白兔均于右侧膝关节行内侧半月板切除术。取下的全部60例半月板分为3组,每组20例,分别接受0 Mrad、1.5 Mrad及2.5 Mrad gamma射线辐照。在每组20例半月板中,随机选取5例半月板行电子显微镜扫描(SEM),剩余的15例半月板作为MAT术供体(3组共45例)。共45只实验兔接受了MAT术,分别为0 Mrad组,1.5 Mrad组及2.5 Mrad组,每组15只。余下的15只不接受MAT术(Meni组),其左膝关节作为阴性对照组(n=15)。所有实验兔于术后24周处死。采用国际软骨修复协会(ICRS)评分评价内侧间室软骨大体形态学改变,应用Masson三色染色并通过Mankin评分评价内侧间室软骨组织学改变。结果:SEM分析结果显示半月板纤维随着gamma射线辐照剂量的增加而破坏程度加剧。在术后24周,移植半月板的形态学评估显示行MAT术的3组间差异无统计学意义,仅在2.5 Mrad组中2例移植半月板存在体部放射状裂。ICRS评分及Mankin评分对照组最低,Meni组最高(P<0.05)。接受MAT术的3组中,2.5 Mrad组的ICRS评分及Mankin评分均高于0 Mrad组及1.5 Mrad组,差异存在统计学意义。而1.5 Mrad组与0 Mrad组ICRS评分及Mankin评分相近,差异无统计学意义。结论:对于新西兰大耳白兔,尽管在gamma射线辐照后半月板纤维存在一定程度的破坏,但只要gamma射线辐照剂量不高于1.5 Mrad,则不会增加MAT术的失败率。
Gamma射线辐照;组织学;形态学;半月板移植术
半月板在膝关节中起着至关重要的作用[1]。已有研究证明半月板切除会导致膝关节早期骨关节炎的发病风险增加[2-4]。因此,目前对于半月板手术均要求尽可能多地保留半月板组织[5,6]。不过,对于一些半月板严重撕裂的病例,可能术中不得不采取半月板全切术。选择何种移植物来替代半月板在膝关节中的作用是目前临床工作中亟待解决的问题。
自1984年第一例半月板移植术(meniscal allograft transplantation,MAT)成功实施后,MAT术已在世界范围内流行开来[7]。许多研究分析并随访了MAT术后患者膝关节功能、疼痛缓解等因素,发现多数病例可以获得满意的临床效果[8,9]。
不过,同种异体半月板的应用存在着播散传染性疾病的风险[10]。组织库的各种消毒技术可以在最大程度上保证移植物的使用安全性。Gamma射线辐照是目前临床上最常用的同种异体半月板组织消毒技术,其具备优良的杀灭细菌与病毒的能力[11]。不过,有研究表明高剂量的gamma射线辐照将导致半月板生物力学性能的降低:当辐照剂量达到2.0 Mrad时则可以明显降低半月板移植物的刚度及强度[12]。目前尚不清楚这种生物力学强度的降低是否会影响MAT术的临床效果。
本研究目的为评估应用gamma射线辐照后的同种异体半月板行MAT术后,移植半月板组织及关节软骨的大体形态学及组织学的改变。基于先前的研究,我们假设MAT术的临床效果会随着gamma射线辐照剂量的增加而变差。
1 材料与方法
1.1实验设计
本研究共包括60只成年、雌性、体重3.0~4.0 kg的新西兰大耳白兔。研究得到了北京积水潭医院动物伦理委员会的审批通过。所有实验兔均首先接受右侧膝关节内侧半月板切除术,取下作为异体半月板来源。将所得半月板分为3组(每组20个)。每组半月板分别通过0 Mrad、1.5 Mrad及2.5 Mrad剂量的gamma射线辐照,后于-20℃冷冻6~14天。每组中随机选取5例半月板行电子显微镜扫描(scanning electron microscopic,SEM),余下的15例辐照后的半月板作为MAT术的供体。
在所有60只实验兔中,随机选取45只行MAT术(分别为0Mrad组、1.5Mrad组及2.5Mrad组,每组15只)。剩余15只实验兔不接受MAT术(作为不移植组,简称Meni组),选取该组实验兔的左侧膝关节作为阴性对照组。所有实验兔均在术后24周处死,取下肢标本备用。
1.2手术操作
所有实验兔均采用氯胺酮(35 mg/kg)加甲苄噻嗪麻醉(5 mg/kg)。术侧下肢刷洗后备皮,常规消毒。取髌骨内侧长约5~6 cm纵切口。深层分离后见内侧半月板组织,锐性分离半月板前、后角,切断后沿滑膜缘完整取下内侧半月板。手术过程中注意保护内侧副韧带,这对术后膝关节稳定性至关重要。二次手术时采用原手术切口,将辐照后的同种异体半月板生理盐水浸泡后,应用4-0不可吸收缝线(Ethicon,Somerville,NJ,USA)牢靠缝合于内侧滑膜缘。移植物前、后角分别与临近韧带等软组织进行牢靠缝合固定。3-0 Vicryl缝线逐层关闭切口(Ethicon)。Meni组术侧膝关节不接受二次手术,未术侧膝关节作为阴性对照采取阴性开关切口,不切除内侧半月板组织。
1.3术后处理
关闭切口后无菌纱布覆盖切口表面,术后48小时内摘除。所有实验兔均预防性应用抗生素,允许饲养笼内自由活动。饲养笼每日进行清洁处理以预防外源性感染。所有实验兔均在术后24周通过耳缘静脉推注硫喷妥钠10 ml处死。术侧膝关节自髋关节离断后准备进行大体形态学及显微镜下组织学观察。
移植半月板及关节软骨的形态学观察:
切开膝关节后横行切断内侧半月板股骨韧带,将移植半月板保留于胫骨平台上(如果存在半月板移植物)。对于胫骨平台软骨、股骨髁软骨以及移植半月板组织进行照片拍摄(Nikon 4600,Nikon photo products,Tokyo,Japan)。
半月板组织的形态学评估包括:半月板完整性、半月板总体位置、半月板根部位置、半月板形状是否正常、有无撕裂、表面是否完整及滑膜反应[7]。全部参考指标通过1~3分的评分系统来评价优良(1代表最佳,3代表最差)。
股骨内侧髁(medial femoral condyle,MFC)及内侧胫骨平台(medial tibial plateau,MTP)软骨形态学评价参考国际软骨修复协会(International Cartilage Repair Society,ICRS)制定的软骨损伤分类标准。对于MTP软骨情况的评估可进一步分为半月板覆盖部分(meniscus coverd,MC)及无半月板覆盖部分(non-meniscus coverd,NMC)。
1.4电镜扫描
冷冻的半月板组织首先于室温解冻。沿矢状面方向将半月板切成长×宽为12 mm×12 mm的形状,切取过程中注意保留半月板上、下表面组织。标本在生理盐水反复冲洗、脱水、喷银后即可在SEM下成像。对选取的3组共15个半月板标本均采取上述操作。针对半月板纤维的张力、走行、光滑度及完整性进行全面评估。全部参考指标同样通过1~3分的评分系统进行评价(1代表最佳,3代表最差)。
1.5关节软骨的组织学评价
获取关节骨软骨标本后,应用10%的福尔马林溶液(Sigma Diagnostics,St.Louis,MO,USA)对标本进行固定。固定后的标本在10%的乙二胺四乙酸溶液(TitriplexⅢ,Merck,Darmstadt,Germany)中脱钙3周。完成脱钙后,MTP标本选择在中心位置沿冠状面切块,MFC标本则选择在中心位置沿矢状面切块。所得标本酒精脱水后进行石蜡包埋。选择4 μm层厚切片,Masson三色染色法进行染色。
MTP软骨的评估可以进一步分为MC组与NMC组。MFC、MC及NMC区域分别通过针对透明软骨退变的Mankin评分系统进行评分。该评分系统包括评估软骨结构(0~6),细胞异常性(0~3),基质染色情况(0~4)及潮线完整性(0~1)。对于无软骨破坏的最佳评分为0分,而存在严重软骨破坏的标本最差可评为14分。
所有标本的评分由3名病理科医生完成。所有评分均采取双盲处理,选择3人的均分作为该标本的最终评分。
1.6统计学分析
应用Mann-Whitney秩和检验比较不同组间及不同位置的形态学与组织学评分。所有统计学分析通过SPSS 18.0软件进行。P<0.05认为差异存在统计学意义。
2 结果
在术后24周,所有实验兔均恢复良好,无感染或其他严重并发症发生。所有膝关节未出现关节内大量积血等表现。
2.1半月板及关节软骨的形态学评估
接受MAT术的3组膝关节,半月板移植物的大体形态基本正常,表现为正常半月板组织的亮白色,表面光滑。在2.5 Mrad组有2例半月板可观察到体部放射状裂。所有移植半月板与外周滑膜缘愈合良好。形态学评分结果详见表1。总体来说,行MAT术的三组间半月板形态学评分差异无统计学意义。半月板撕裂评分,2. 5 Mrad组明显高于其他两组。
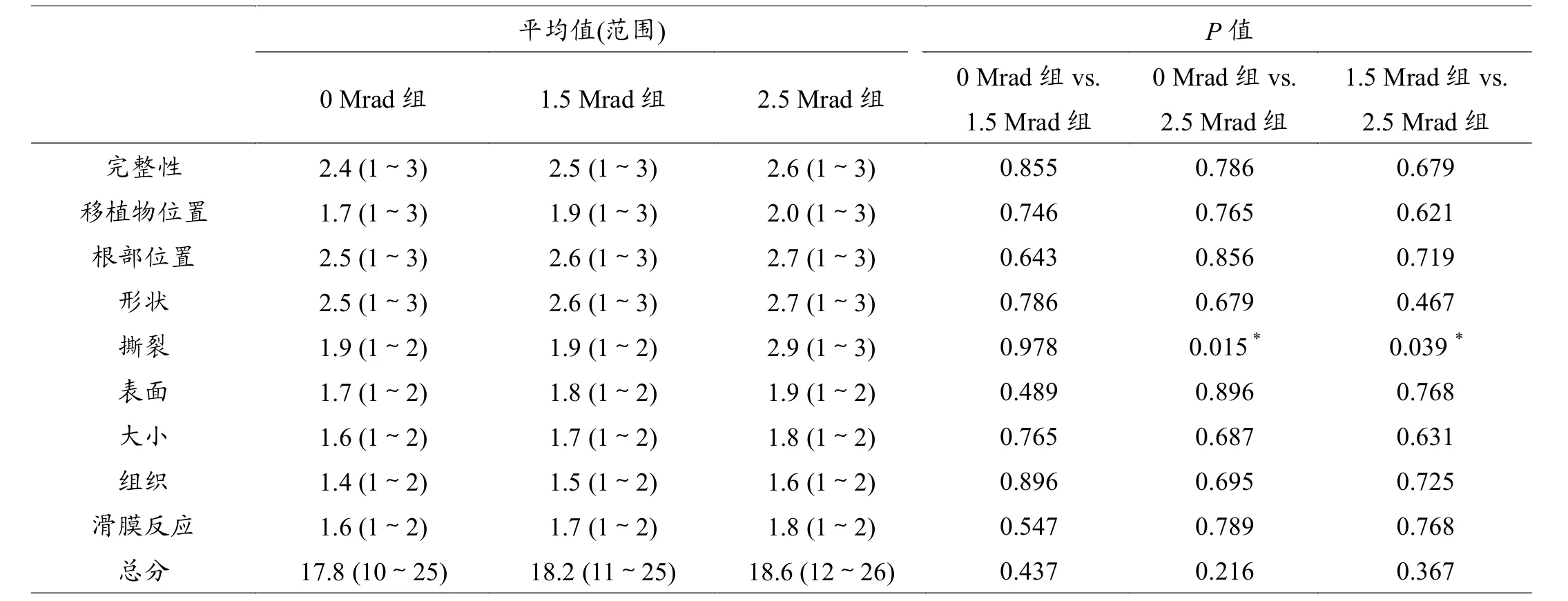
表1 半月板形态学评分结果
ICRS 评分结果详见表2。在术后24周时,阴性对照组软骨形态表现大致正常,而Meni组膝关节的内侧间室则可观察到明显的软骨退变情况,特别是在MFC以及MTP的NMC区域。Meni组的ICRS评分在所有区域均明显高于其他组,部分标本还可见骨赘形成。
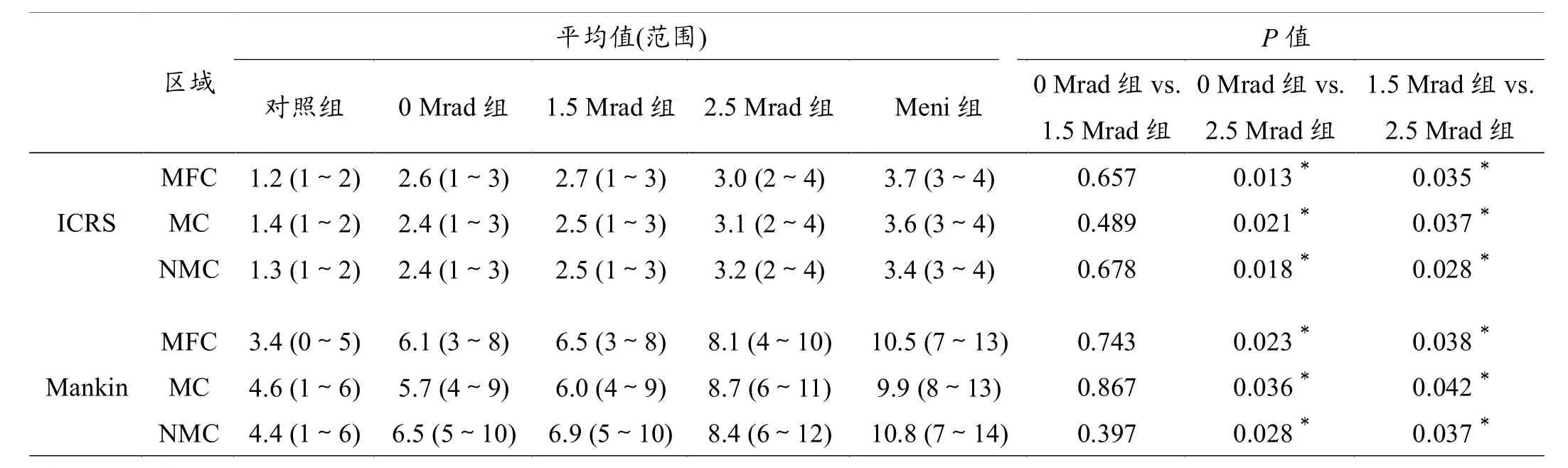
表2 关节软骨ICRS及Mankin评分结果
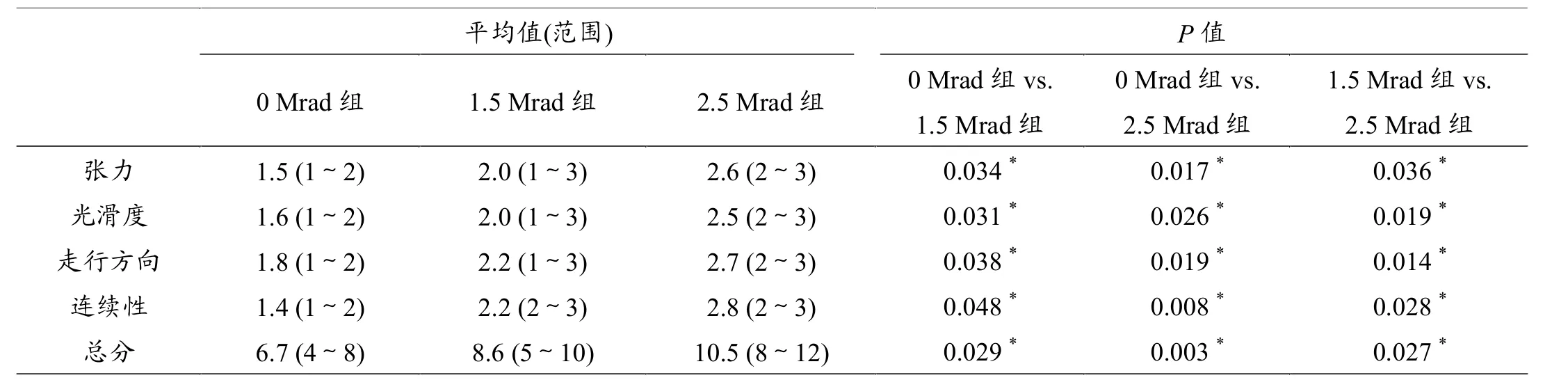
表3 辐照的半月板组织电镜扫描结果
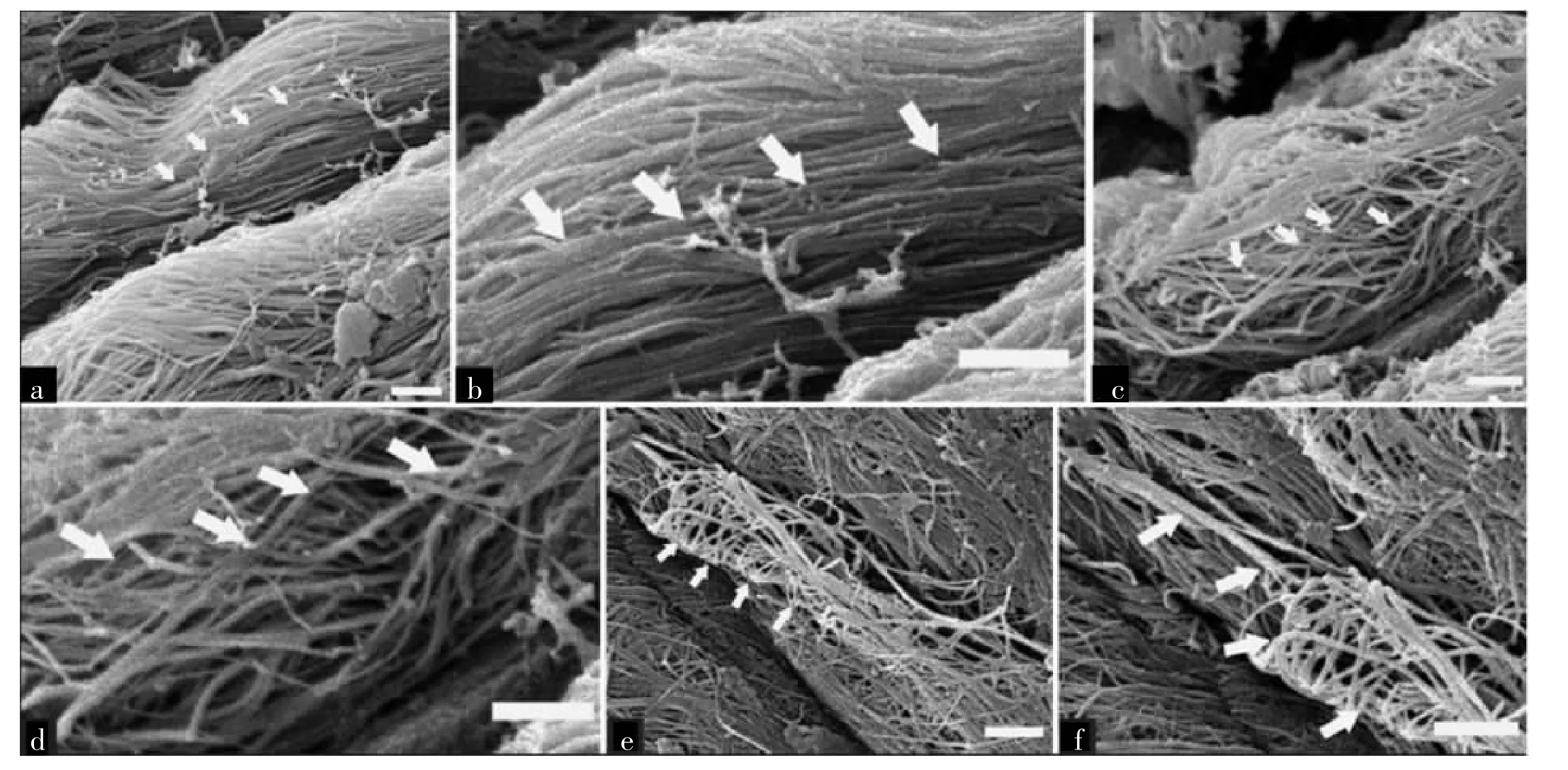
图1 电子显微镜观察半月板胶原纤维
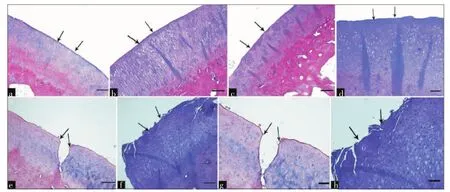
图2 接受半月板移植术(MAT)的3组实验动物在术后第24周股骨内侧髁(MFC)与胫骨平台内侧(MTP)的关节软骨组织学表现
行MAT术的3组ICRS评分波动在阴性对照组与Meni组之间(表2),其中2.5 Mrad组最高,0 Mrad组最低。值得注意的是对于进行评估的所有区域,1.5 Mrad组与0 Mrad组差异无统计学意义,而2.5 Mrad组与1.5 Mrad组之间差异则存在统计学意义。
2.2半月板电镜扫描结果
电镜下0 Mrad组的半月板纤维排列规律,无断裂、杂乱表现,纤维走行一致(图1)。不过,随着gamma射线辐照剂量的增大,半月板纤维开始出现明显排列混乱,并出现断裂表现。半月板组织的电镜扫描结果详见表3。1.5 Mrad组与2.5 Mrad组的SEM评分均明显高于0 Mrad组。2.5 Mrad组的SEM评分亦高于1.5 Mrad组,同样具有统计学意义。
2.3关节软骨组织学评价
Mankin评分结果详见表2。总体来讲,阴性对照组评分最佳,而Meni组的所有评估区域评分均为最差,表现为明显的软骨退变。与ICRS评分类似,行MAT术的3组Mankin评分波动在阴性对照组与Meni组之间,同样2.5 Mrad组最高,0 Mrad组最低。对于进行评估的所有区域,1.5 Mrad组与0 Mrad组差异无统计学意义,而2.5 Mrad组与1.5 Mrad组之间差异则存在统计学意义(图2)。
3 讨论
本研究的主要发现包括:(1)通过SEM证实,随着gamma射线辐照剂量的增加,半月板纤维破坏越严重;(2)应用1.5 Mrad及0 Mrad辐照后的半月板行MAT术,在术后24周关节软骨的形态与组织学特性无差异。
近20年来,骨科手术对同种异体材料的应用进展很快[13],应用同种异体材料行MAT术可以获得良好的临床效果[14,15],发展迅速。但是,应用同种异体移植物存在传播传染性疾病的风险。由于单纯的无菌取材和组织处理均无法做到消毒,因此多数组织库在获得移植材料后需要进行消毒处理[16,17]。Gamma射线辐照是当下组织库所用最流行的消毒方法之一,其优势主要体现在极佳的组织穿透能力,这保证了对移植组织的消毒效果[18,19]。此外,gamma射线在较低剂量(1.5~2.5 Mrad)的情况下即可产生良好的灭菌能力[20]。不过,其对半月板移植物组织存在潜在的破坏能力限制了gamma射线的应用。根据文献报道,gamma射线辐照对移植物生物力学性能的影响与辐射剂量成正相关[21,22]。目前临床上依然面临着这样的困境。
半月板的生物力学性能主要依赖于它独特的纤维走行方向[23]。因此,对于半月板组织理想的消毒方式要尽量做到不破坏它的独特结构。本研究应用SEM观察半月板在接受gamma射线辐照后的组织学表现,结果显示半月板的胶原纤维出现了破损现象,这也间接证明了gamma射线对半月板生物力学性能存在影响。不仅如此,随着辐照剂量由1.5 Mrad提高至2.5 Mrad,半月板胶原纤维的破坏也更加严重,这也间接证明了先前研究关于gamma射线辐照对半月板生物力学性能的影响与辐射剂量成正相关的结论。
这种半月板纤维结构的改变是否会显著增加MAT术后失效率是目前面临的一个巨大问题。目前尚未见研究证明MAT术后的临床效果与gamma射线辐照剂量之间关系。根据我们的结果,3组应用不同辐照剂量的半月板移植物行MAT术后,术后24周时在半月板标本形态学评分上差异无统计学意义。虽然高的辐照剂量导致半月板部分环状纤维遭到破坏,有趣的是似乎这并没有影响到半月板本身的存活率。不过,2.5 Mrad组中存在2例半月板发生体部放射状裂,这也可以较好地被SEM下观察到的半月板纤维形态的改变所解释。
对于接受MAT术的3组,虽然可以观察到内侧间室关节软骨的退变,但其ICRS评分与Mankin评分均显著低于Meni组,这也说明了在应用gamma射线辐照过的半月板行MAT术后,移植半月板对关节软骨存在保护作用。同时,我们发现在1.5 Mrad gamma射线辐照后半月板的软骨保护效果与0 Mrad相似,在我们所观察的所有区域内两组间的形态学评分与组织学评分差异均无统计学意义。我们认为在1.5 Mrad gamma射线辐照剂量的情况下,gamma射线对于半月板纤维的破坏并不会影响半月板移植物的功能。同样,一个离体生物力学实验[18]表明,相比不受任何辐照的移植物,1.5 Mrad gamma射线辐照并不会显著影响移植物的生物力学性能。有研究[20]发现1.5 Mrad的gamma射线辐照剂量在保证组织生物力学强度的同时可以获得良好的消毒效果。Costi等[19]同样认为1.5 Mrad gamma射线辐照并不会对组织造成不良的影响,可以保证良好的临床效果。
尽管应用辐照半月板行MAT术后对关节软骨起到了保护作用,但关节软骨的破坏并没有完全避免。在术后24周时,行MAT术的3组ICRS评分与Mankin评分均显著高于阴性对照组。这可能与几个因素相关。一个可能的原因是移植物自身的影响。Rijk[22]认为半月板大小的改变会影响胶原的工作环境,这不仅仅破坏了半月板的形状,同时还影响了它的生物力学性能。此外,gamma射线的辐照剂量会改变移植物的特性。有研究表明高于3.0 Mrad的辐照剂量会显著增加骨组织的脆性并降低骨组织内胶原的含量[11,12]。应用相对高剂量的gamma射线辐照(高于2.5 Mrad)后的移植物行前交叉韧带重建术同样会显著影响术后膝关节的稳定性[23]。Curran等[20]证明了2.0 Mrad的gamma射线辐照剂量会降低移植物的生物力学强度,这种负效应会随着辐照剂量的增加而增大。在该研究中,2.5 Mrad组的软骨保护效果明显差于2.0 Mrad组。
本研究存在以下几点优势。首先,这是第一个研究不同gamma射线辐照剂量对MAT术临床效果影响的在体动物实验。其次,在对半月板与关节软骨的形态学与组织学评估上进行半定量分析,较先前研究更加客观。最后,所有实验评分均由对于实验双盲的病理科医生完成。
研究存在以下劣势。首先,研究的所有数据均来自于实验兔,所得结果并不能完全反映人体情况。其次,可以增加1.0 Mrad辐照组从而进一步评估最佳辐照剂量。不过,1.5 Mrad组在各个观测区域与0 Mrad类似,这也表明了1.5 Mrad可以作为新西兰大耳白兔半月板消毒的最佳gamma射线辐照剂量。最后,可以进一步研究在体的半月板组织学特性。
本研究通过在体动物实验证明表明,尽管在gamma射线辐照后半月板纤维存在一定程度的破坏,但只要gamma射线辐照剂量不高于1.5 Mrad,则不会增加MAT术的失败率。因此,对于新西兰大耳白兔,可将1.5 Mrad作为gamma射线辐照的最佳剂量应用于今后的MAT术。
4 结论
本研究通过在体动物实验证实,对于新西兰大耳白兔,尽管在gamma射线辐照后半月板纤维存在一定程度的破坏,但只要gamma射线辐照剂量不高于1.5 Mrad,则不会增加MAT术的失败率。
[1]Zhang H,Liu X,Wei Y,et al.Meniscal allograft transplantation in isolated and combined surgery.Knee Surg Sports Traumatol Arthrosc,2012,20:281-9.
[2]LeeAS,KangRW,KroinE,etal.Allograftmeniscus transplantation.Sports Med Arthrosc,2012,20:106-14.
[3]HerganD,ThutD,ShermanO,etal.Meniscalallograft transplantation.Arthroscopy,2011,27:101-12.
[4]He W,Liu YJ,Wang ZG,et al.Enhancement of meniscal repair in the avascular zone using connective tissue growth factor in a rabbit model.Chin Med J,2011,124:3968-75.
[5]Wang YJ,Yu JK,Luo H,et al.An anatomical and histological study of human meniscal horn bony insertions and perimeniscal attachments as a basis for meniscal transplantation. Chin Med J,2009,122:536-40.
[6]Ha JK,Jang HW,Jung JE,et al.Clinical and radiologic outcomes after meniscus allograft transplantation at 1-year and 4-year follow-up.Arthroscopy,2014,30:1424-9.
[7]Jiang D,Zhao LH,Tian M,et al.Meniscus transplantation using treated xenogeneic meniscal tissue:Viability and chondroprotection study in rabbits.Arthroscopy,2012,28:1147-59.
[8]Ha JK,Sung JH,Shim JC,et al.Medial meniscus allografttransplantationusingamodifiedboneplugtechnique:Clinical,radiologic,andarthroscopicresults.Arthroscopy,2011,27:944-50.
[9]Koh YG,Moon HK,Kim YC,et al.Comparison of medial and lateral meniscal transplantation with regard to extrusion of the allograft,and its correlation with clinical outcome.J Bone Joint Surg Br,2012,94:190-3.
[10]Mickiewicz P,Binkowski M,Bursig H,et al.Preservation and sterilization methods of the meniscal allografts:Literature review.Cell Tissue Bank,2014,15:307-17.
[11]Nguyen H,Cassady AI,Bennett MB,et al.Reducing the radiationsterilizationdoseimprovesmechanicaland biological quality while retaining sterility assurance levels of bone allografts.Bone,2013,57:194-200.
[12]Burton B,Gaspar A,Josey D,et al.Bone embrittlement and collagen modifications due to high-dose gamma-irradiation sterilization.Bone,2014,61:71-81.
[13]Lee BS,Chung JW,Kim JM,et al.Morphologic changes in fresh-frozen meniscus allografts over 1 year:A prospective magnetic resonance imaging study on the width and thickness of transplants.Am J Sports Med,2012,40:1384-91.
[14]Samitier G,Alentorn-Geli E,Taylor DC,et al.Meniscal allografttransplantation.Part2:Systematicreviewof transplant timing,outcomes,return to competition,associated procedures,and prevention of osteoarthritis.Knee Surg Sports Traumatol Arthrosc,2015,23:323-33.
[15]Yanke AB,Chalmers PN,Frank RM,et al.Clinical outcome of revision meniscal allograft transplantation:Minimum 2-year follow-up.Arthroscopy,2014,30:1602-8.
[16]Gelber PE,Gonzalez G,Torres R,et al.Cryopreservation does not alter the ultrastructure of the meniscus.Knee Surg Sports Traumatol Arthrosc,2009,17:639-44.
[17]Villalba R,Pena J,Navarro P,et al.Cryopreservation increases apoptosis in human menisci.Knee Surg Sports Traumatol Arthrosc,2012,20:298-303.
[18]Fideler BM,Vangsness CT Jr,Lu B,et al.Gamma irradiation:Effects on biomechanical properties of human bone-patellar tendon-bone allografts.Am J Sports Med,1995,23:643-6.
[19]Costi JJ,Edmonds-Wilson RH,Howie DW,et al.Stem micromotion after femoral impaction grafting using irradiated allograft bone:A time zero in vitro study.Clin Biomech(Bristol,Avon),2013,28:770-6.
[20]Curran AR,Adams DJ,Gill JL,et al.The biomechanical effects of low-dose irradiation on bone-patellar tendon-bone allografts.Am J Sports Med,2004,32:1131-5.
[21]Chen XZ,Zhang J,Lin P,et al.Early graft failure after meniscus allograft transplantation:An unusual cause of using all-inside meniscal repair device.Chin Med J,2013,126:3985-7.
[22]Rijk PC.Meniscal allograft transplantation-Part I:Background,results,graft selection and preservation,and surgical considerations.Arthroscopy,2004,20:728-43.
[23]Foster TE,Wolfe BL,Ryan S,et al.Does the graft source really matter in the outcome of patients undergoing anterior cruciate ligament reconstruction An evaluation of autograft versus allograft reconstruction results:A systematic review. Am J Sports Med,2010,38:189-99.
Effect of Gamma Irradiation on the Transplanted Meniscal Allograft in Rabbit Model
Zhang Jin1,Chen Xingzuo2,Song Guanyang1,Li Yue1,Li Xu1,Wang Xuesong1,Feng Hua1
1 Department of Sports Medicine,Beijing Jishuitan Hospital,Beijing,China 100035 2 China-Japan Friendship Hospital,Beijing,China 100029
Feng Hua,Email:fenghua20080617@126.com
Purpose The aim of this study was to investigate the effects of gamma irradiation on the joint meniscus and cartilage after meniscal allograft transplantation(MAT).Methods Sixty New Zealand white rabbits underwent total right knees medial meniscectomy.Every 20 of the excised menisci were sterilized and respectively received 0 Mrad of gamma irradiation(0 Mrad group),1.5 Mrad of gamma irradiation(1.5 Mrad group)and 2.5 Mrad of gamma irradiation(2.5 Mrad group).5 menisci in each group were randomly chosen for electron microscopic scanning(Meni group),and the remaining 45 were used as allografts for MAT.The left knees of the rabbits were served as control group.All rabbits were sacrificed 24 weeks after the surgery.Their cartilage of the medial compartment was evaluated macroscopically using the International Cartilage Repair Society(ICRS)score and the histology of the cartilage using the Mankin score based on the Masson trichromestaining.Results The damage of meniscal collagen fibers deteriorated gradually with the increasing dose of gamma irradiation.There was no significant differences in overall macroscopic scores of the transplanted meniscal tissue among the 3 MAT groups 24 weeks after the surgery,with the only exception of the 2 in 2.5 Mrad group(partial radial tears in caudomedial part of the meniscus).The lowest ICRS scores and the Mankin scores appeared in the control group and the highest in Meni group(P<0.05).The ICRS scores and Mankin scores in 2.5 Mrad group were significantly higher than in 0 Mrad group and the 1.5 Mrad group(P<0.05),while those between 1.5 Mrad group and 0 Mrad group were insignificant.Conclusions The failure rate of MAT surgery increased insignificantly if the gamma irradiation dose was less than 1.5 Mrad for New Zealand white rabbits.
gamma irradiation,histology,meniscal allograft transplantation
2015.10.18
国家自然科学基金(编号81404814)
冯华,Email:fenghua20080617@126.com
