半月板纤维软骨细胞接种脱钙松质骨支架构建组织工程半月板的方法选择
2016-10-15张正政王少杰齐岩松张继英江东余家阔
张正政 王少杰 齐岩松 张继英 江东 余家阔
北京大学第三医院运动医学研究所(北京100191)
半月板纤维软骨细胞接种脱钙松质骨支架构建组织工程半月板的方法选择
张正政 王少杰 齐岩松 张继英 江东 余家阔
北京大学第三医院运动医学研究所(北京100191)
目的:探讨半月板纤维软骨细胞(MFCs)接种脱钙松质骨(DCB)支架的最佳接种方法。方法:实验分静滴法、注射法、离心法、负压法等4组。取兔MFCs,采用上述4种方法对孔隙率为80%、平均孔径为268 μm的DCB支架进行细胞接种。Live/Dead染色检测其细胞活性,并通过软件分析其细胞分布情况。CCK-8法和Hoechst 33258法检测支架内MFCs增殖情况和支架内DNA含量。结果:通过Live/Dead染色显示,离心法接种细胞后其存活率优于其他3组(P<0.05);细胞分布均匀,由浅至深各层细胞比例无明显统计学差异(P>0.05);1~5天细胞增殖能力优于其他3组(P<0.05),14~21天支架DNA含量亦优于其他3组(P<0.05)。结论:离心法可以明显提高MFCs在DCB上的细胞分布和细胞增殖能力,是一种简单、高效的,利于组织工程半月板(TEM)构建的接种方法。
组织工程半月板;接种方法;半月板纤维软骨细胞;脱钙松质骨
半月板损伤是运动损伤的常见病,目前半月板部分切除、缝合修复或是半月板移植等均无法达到非常满意的疗效[1-4]。组织工程半月板(tissue-engineered meniscus,TEM)的出现为修复或替换损伤半月板开辟了新的途径[5]。细胞接种是建立支架三维培养的首要环节,在TEM构建中起重要作用[6]。由于半月板的复杂结构组成,尤其是构建它的支架要求体积较大,而目前各种种植方法不能均匀地、完全地将细胞种植其中[7]。接种方法一般分为直接接种和间接接种,其中直接接种包括静滴法和注射法,是直接将细胞接种于支架表面或是内部,结果不理想[8]。而文献报道间接法是通过动态过程将细胞接种于支架内部,其接种结果有待进一步证实[9,10]。脱钙松质骨(demineralized cancellous bone,DCB)支架因其良好的生物活性及生物力学性能等优点被广泛应用于组织工程[11-13]。因此,本实验应用半月板纤维软骨细胞(meniscal fibrochondrocytes,MFCs)作为种子细胞,采用静滴法、注射法、离心法、负压法进行接种,旨在探索何种方法效率更高,更利于构建TEM。
1 材料与方法
1.1实验动物、材料与仪器
实验中所用动物和实验设计均通过北京大学第三医院动物伦理委员会论证和批准。3个月龄新西兰大白兔10只(体质量为3 kg,雄性,购于北京大学医学部实验动物中心)。Live/Dead染料(Invitrogen公司,美国),鬼笔环肽(Cytoskeleton公司,美国),胰蛋白酶、I型胶原酶、Hoechst 33258、小牛胸腺DNA、木瓜蛋白酶(Sigma公司,美国),CCK-8试剂盒(Dojindo Laboratories公司,日本),低温高速离心机(Eppendorf公司,德国),激光共聚焦显微镜(Leica公司,德国),多功能酶标仪(Thermo公司,美国)等。
1.2实验方法
1.2.1半月板纤维软骨细胞的培养
无菌条件下取新西兰大白兔双膝内外侧半月板,放入盛有DMEM培养基的培养皿中,用含1%庆大霉素+链霉素的PBS冲洗3遍,眼科剪剪成约1 mm×1 mm×1 mm碎块,然后用0.25%胰蛋白酶37℃消化30 min,再加入0.2%I型胶原酶37℃恒温水浴摇床振荡消化过夜。经显微镜观察,大部分细胞消化下来后,吹打,1000 rpm离心4 min,弃上清,PBS洗两次,细胞按1×106/瓶重悬于含10%FBS的DMEM培养基的25 cm2培养瓶,置于37℃、5%CO2恒温培养箱中培养。每3天换液1次,待细胞85%融合后传代,实验用第三代细胞。
1.2.2脱钙松质骨支架制备
获取成年猪股骨及胫骨干骺端松质骨,剔除周围肌肉、韧带、肌腱以及骺端组织,用电动摆锯将其制作为1 mm厚骨片,自来水冲洗干净,蒸馏水浸泡,用5%的盐酸脱钙2~3天,用浓度为1∶1的甲醇/氯仿液中脱脂24小时,用3%的双氧水H2O2中浸泡4小时,以上各步骤间均用蒸馏水浸泡冲洗。用10 mm环钻在脱钙松质骨片上卡压后得圆形支架。冷冻干燥,包装,Co60进行消毒备用。通过扫描电镜观察脱钙松质骨的表面及断面结构,每个标本随机取10幅照片,将扫面电镜图片导入Image-pro Plus software 6.0,使用测量工具进行平均孔径测定;孔隙率通过Adobe Photoshop 7.0软件的直方图(histogram)功能计算,以像素(pixel)代表孔隙面积。孔隙率=孔隙所占的像素/整个照片的像素。经计算后DCB支架孔隙率为80%、平均孔径为268 μm(图1)。实验均采用以上统一表征形状的支架。

图1 脱钙松质骨支架大体观(A)及电镜扫描图(B)
1.2.3细胞接种
静滴法:MFCs消化,重悬,按0.5×106/支架,25 μl(浓度1×107/ml)缓慢滴注于支架上,37℃培养箱培养15 min后,再滴注剩余25 μl细胞悬液,4小时后缓慢从支架旁加入培养基,隔天换液;注射法:1 ml注射器取50 μl(浓度1×107/ml)细胞悬液,25 G针头分别于支架顶部、底部、侧壁对称部位进行注射,每次进针1 mm,4小时后缓慢从支架旁加入培养基;离心法:将支架置于1.5 ml EP管底部,在支架上方缓慢滴注50 μl(浓度1×107/ml)细胞悬液,封口胶封闭管口,将离心管按500 rmp、2 min离心,再倒置EP管再次离心,反复3次。轻轻取出支架后,放入培养皿中培养,4小时后缓慢从支架旁加入培养基;负压法:将15 ml离心管对半裁剪,两端用橡皮塞塞紧,并插入25 G针头,消毒备用。实验时顶端针头连接1 ml注射器,底端针头连接5 ml注射器,将支架放入容器中,拧紧橡皮塞形成密闭环境。先从上方注入50 μl(浓度1×107/ml)细胞悬液,下方注射器抽取负压吸引悬液,再次由上方注入,下方负压吸引,反复3次。轻轻取出支架后,放入培养皿中培养,4小时后缓慢从支架旁加入培养基,隔天换液。
1.2.4支架上MFCs的活性及分布检测
细胞种植24小时后,用Live/Dead染料进行染色30 min,PBS冲洗15 min后,激光共聚焦显微镜观测并采集图像,活细胞细胞质标记为绿色(波长488 nm),死细胞细胞核标记为红色(波长568 nm)。图像通过Image-pro Plus软件计数活/死细胞并计算出细胞存活比例;通过Imaris软件将图像转换成三维模型,并定量计算每层(100 μm)细胞分布比例。
1.2.5支架上MFCs形态学观察
细胞种植1周后,用鬼笔环肽作细胞骨架染色,Hoechest 33258标记细胞核后用激光共聚焦显微镜观察。具体操作:支架用PBS冲洗后4%多聚甲醛固定15 min,1%Triton X-100破膜30 min,鬼笔环肽作细胞骨架染色1 h,Hoechest 33258标记细胞核15 min。激光共聚焦显微镜观测并采集图像。
1.2.6支架上MFCs的增殖检测
体外培养1、3、5天时,200 μl培养基中加入20 μl CCK-8工作液,37℃孵育2 h,收集培养液,450 nm波长测定培养基吸光度。
1.2.7支架上DNA含量测定
体外培养1、7、14、21天后,每个支架加入木瓜蛋白酶裂解液,60℃过夜消化裂解,取20 μl裂解液加入200 μl Hoechst33285工作液,37℃孵育20 min后检测各孔荧光值(激发波长为360 nm,吸收波长为460 nm)。以小牛胸腺DNA为标准品绘制标准曲线,计算每个支架内DNA含量,然后以支架的湿重进行标准化。
1.3统计学分析
应用SPSS l6.0统计学软件进行,3组及以上数据比较应用单或多因素方差分析,若差异有统计学意义,则再采用LSD-t法进行组间两两比较。两组数据比较应用Student-t检验等统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1支架上MFCs活性检测
通过Live/Dead染料对体外应用4种接种方法接种的支架进行染色,发现4种接种方法均能使MFCs存活。如图2所示,静滴法(A)细胞主要分布于支架孔隙表面,且分布不均匀,细胞团聚明显;注射法(B)由于注射操作的原因对支架造成破坏,细胞无法粘附于支架上,引起死细胞增多;离心法(C)细胞在支架孔隙周围及细胞内部都有分布,且分布均匀,无明显重叠团聚;而负压法(D)由于负压吸力将细胞悬液抽吸出支架,造成细胞种植数量下降。通过Image-pro Plus软件对活/死细胞进行计数并计算出存活率(图3A),离心法较其它种植方法种子细胞存活率高(P<0.05)。
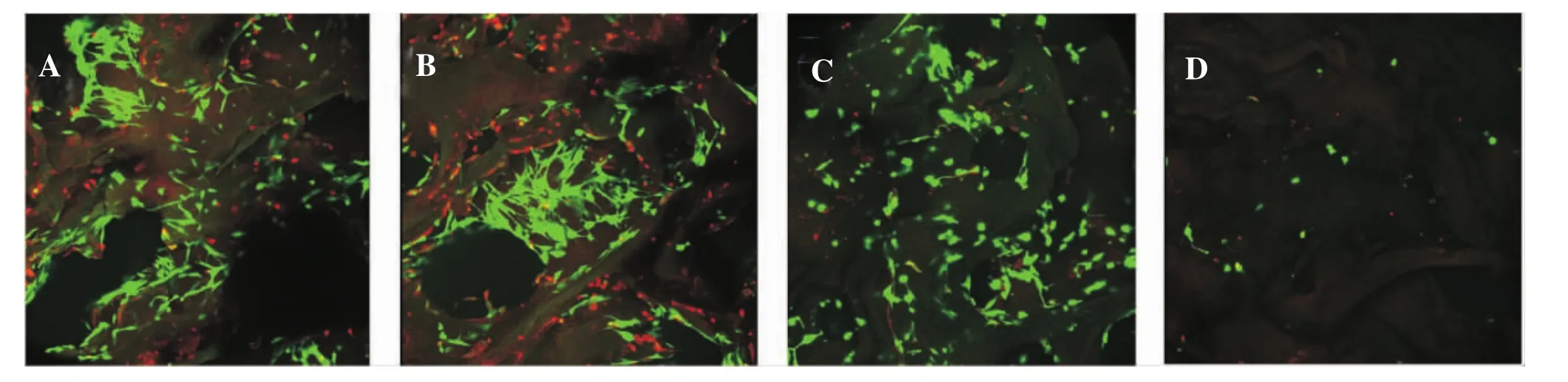
图2 细胞活性示意图
2.2支架上MFCs分布检测
通过Imaris软件将图像转换成三维模型(图4),并定量计算每层(100 μm)细胞分布比例(图3B)。可见MFCs通过离心法种植后各层分布均匀,无明显统计学差异(P>0.05),而静滴法和注射法,种子细胞分布于支架表面(200~300 μm),负压法种子细胞数量较少且主要位于支架深部。
2.3支架上MFCs形态学观察
如图5所示,离心法(C)种植细胞细胞量较多,且细胞分布均匀呈立体分布,细胞保持其梭形结构,细胞间形成桥接。而其他注射方法细胞数量少,分布分散,细胞形态孤立单一。
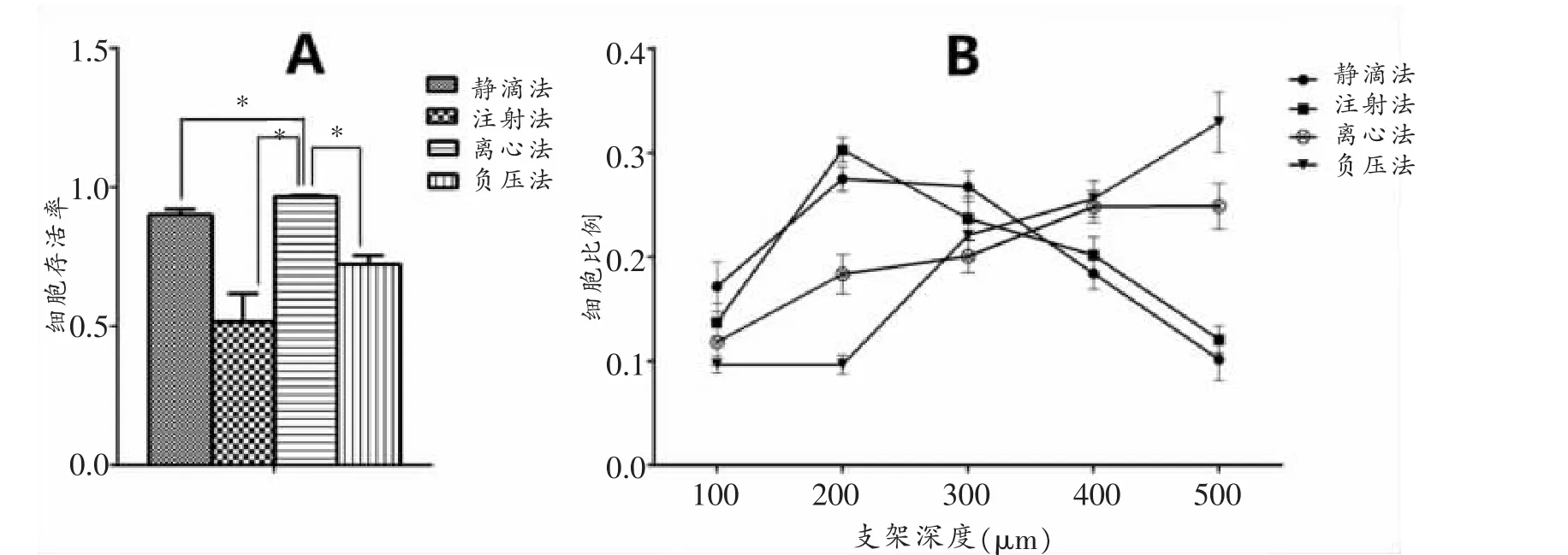
图3 细胞存活率
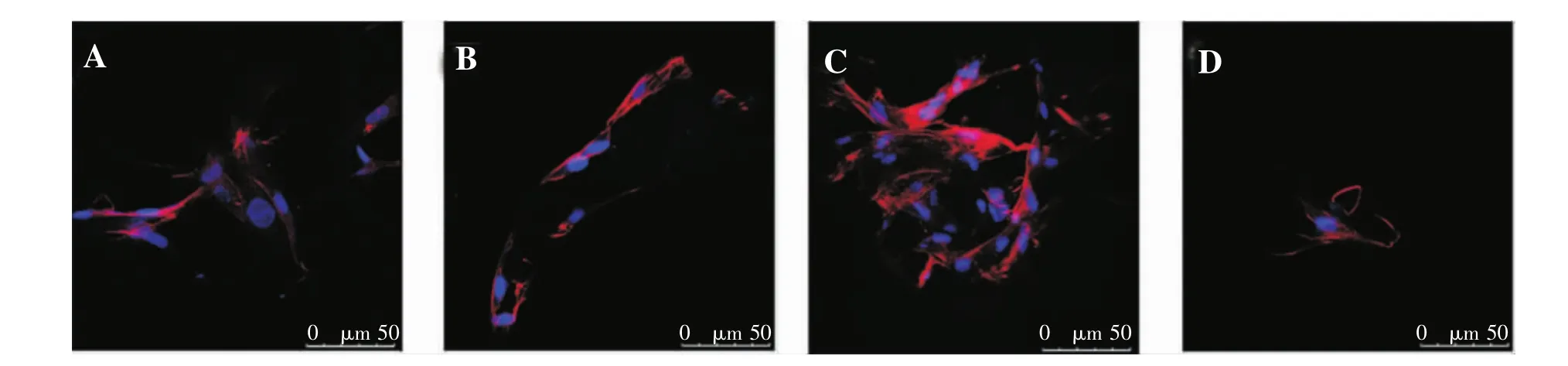
图5 支架上细胞形态示意图
2.4支架上MFCs增殖及DNA含量检测
通过CCK-8和DNA含量检测(图5),离心法接种MFCs在1~5天细胞增殖能力较其他方法明显增强(P< 0.05);14~21天支架上DNA含量亦优于其他3组(P<0.05),且随时间增长其有持续增殖能力。
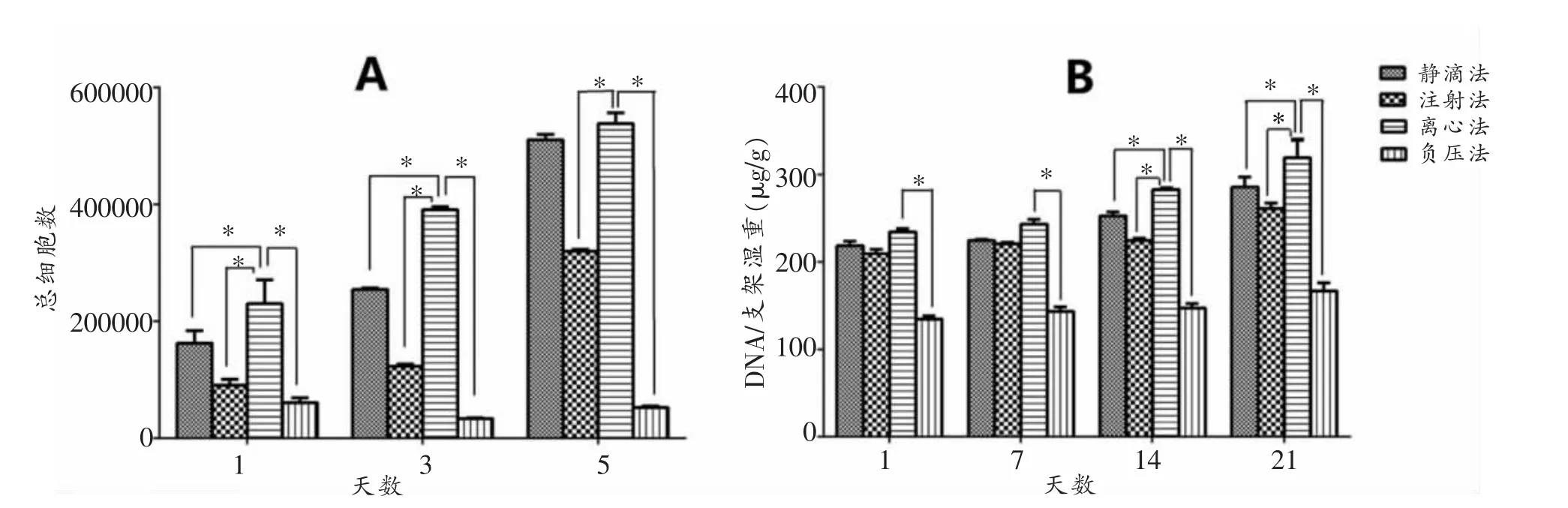
图6 支架上MFCs增殖及DNA含量检测
3 讨论
尽管文献报道各种不同材料支架及种子细胞应用于TEM的构建,但是如何将种子细胞种植于支架上仍是首要解决的问题[14]。既往文献报道,种子细胞在支架上的分布和增殖等是保证组织工程构建体最终生物功能的重要影响因素[15]。TEM由于其特殊的组织学和解剖学结构,种子细胞接种效果多不理想,很难进入支架深部且分布不均匀,不利于最终发挥其部分或完全替代损伤半月板的功能[8]。因此,本研究通过比较4种不同种植方法,旨在探索一种利于TEM构建的合适接种方法。
文献报道离心法适于种子细胞的接种[7,16],但仍需要在接种的成本、操作的难易度和无菌程度等方面改进。我们通过总结并改进离心法,使其具有以下特点:(1)所有耗材设备均为商品化,统一标准。(2)离心管可以根据支架的尺寸选择不同大小规格,整个离心过程操作简捷并保证无菌。(3)本实验验证了MFCs可均匀一致地接种于DCB并发挥其生物学功能,为构建TEM提供了一种合适的方法。
由于文献报道离心可能影响细胞的增殖、基因的表达[17],因此我们设计了长期的体外培养,结果表明离心法接种MFCs在细胞增殖能力等方面优于其他方法,并且随时间增长其有持续增殖能力。离心速度及离心力的选择同样有争议,高速离心可能会造成细胞碎裂和支架的破坏,影响最终的离心效果[18]。同时,不同的支架其孔径大小、空心率等表征也会影响离心方法参数的选择[18]。通过总结文献及多次预实验,本实验采用的离心方法为通过500 rmp、2 min离心,再倒置EP管再次离心,反复3次。结果表明离心法MFCs的增殖和分布等优于其他接种方法。
DCB具有较好的孔隙率(80%),具有一定的弹性和抗拉强度,多孔的三维结构有利于细胞附着和增殖,同时含有细胞分化和增殖所需要的生物活性物质,其体外降解时间约8~9周,无明显组织和细胞毒性[11,12]。目前已有脱钙松质骨支架修复软骨及骨缺损的研究报道,效果良好[13]。但尚未见到以脱钙松质骨为支架材料构建TEM的相关研究。通过兔全身骨骼(胫骨平台、股骨髁、股骨头、肱骨髁、骨盆、脊柱)的解剖发现,没有一处松质骨片可达到兔半月板大小(兔半月板的前后径和左右径约为10 mm,宽度约为1~2 mm),难以满足体内移植的需要。因此,我们选择用猪胫骨平台及股骨远端的松质骨作为支架材料,首先因为经过脱钙和脱细胞处理后松质骨主要残余I型胶原支架,胶原的分子结构具有很强的保守性,种属间差异较小,抗原性较低[19];其次本课题组应用异种异体猪半月板经处理后移植到兔膝关节体内,6周后已无明显免疫排斥反应,不影响半月板的存活[20]。
本实验4种接种方法的优缺点总结如下:静滴法是目前组织工程最普遍应用的接种方法,其易于操作,但是本实验通过3D建模证实种子细胞很少进入支架内部,多位于支架表层;注射法通过针头可以将种子细胞种植于支架内部及特定部位,但是由于其侵入性造成支架内部结构的破坏,影响种子细胞的粘附,最终导致其存活率下降;负压法可以解决细胞进入支架内部的问题,但是由于负压吸引力,导致种子细胞分布不均匀,多位于支架深层或是被吸出支架造成渗漏,最终也影响种植的效果。
总之,本研究结果表明离心法可以明显提高MFCs在DCB上的细胞分布和细胞增殖能力,是一种简单、高效的,利于组织工程半月板(TEM)构建的接种方法。本实验的主要不足是未能将更多的接种方法和不同的种子细胞和支架材料纳入,下一步将纳入更多的方法和材料进行比较研究,以进一步寻找适合TEM构建的细胞接种技术。
[1]Holzer LA,Leithner A,Holzer G.Surgery versus physical therapy for meniscal tear and osteoarthritis[J].N Engl J Med,2013,369(7):677.
[2]冯华,张辉,洪雷,等.半月板移植的早期临床疗效分析[J].中华骨科杂志,2010,30(4):351-356.
[3]章亚东,侯树勋,张轶超,等.关节镜下同种异体半月板移植的疗效分析[J].中华骨科杂志,2010,30(2):175-181.
[4]颜斌,敖英芳,龚熹,等.同种异体半月板移植和半月板切除术后中期临床效果比较[J].中国运动医学杂志,2015,34(1):5-9.
[5]周预,刘玉杰,黄靖香,等.兔半月板脱细胞基质的制备[J].中国医学科学院学报,2011,1:62-65+115-116.
[6]Yang TH,Miyoshi H,Ohshima N.Novel cell immobilization method utilizing centrifugal force to achieve high-density hepatocyte culture in porous scaffold[J].J Biomed Mater Res,2001,55(3):379-386.
[7]Roh JD,Nelson GN,Udelsman BV,et al.Centrifugal seeding increases seeding efficiency and cellular distribution of bone marrow stromal cells in porous biodegradable scaffolds[J]. Tissue Eng,2007,13(11):2743-2749.
[8]Thevenot P,Nair A,Dey J,et al.Method to analyze threedimensional cell distribution and infiltration in degradable scaffolds[J].Tissue Eng Part C Methods,2008,14(4):319-331.
[9]Kim BS,Putnam AJ,Kulik TJ,et al.Optimizing seeding and culturemethodstoengineersmoothmuscletissueon biodegradable polymer matrices[J].Biotechnol Bioeng,1998,57(1):46-54.
[10]Xiao YL,Riesle J,Van Blitterswijk CA.Static and dynamic fibroblast seeding and cultivation in porous peo/pbt scaffolds[J].J Mater Sci Mater Med,1999,10(12):773-777.
[11]Fu WL,Zhou CY,Yu JK.A new source of mesenchymal stem cellsforarticularcartilagerepair:Mscsderivedfrom mobilizedperipheralbloodsharesimilarbiological characteristics in vitro and chondrogenesis in vivo as mscs from bone marrow in a rabbit model[J].Am J Sports Med,2014,42(3):592-601.
[12]Huang H,Zhang X,Hu X,et al.Directing chondrogenic differentiation of mesenchymal stem cells with a solidsupported chitosan thermogel for cartilage tissue engineering[J].Biomed Mater,2014,9(3):035008.
[13]Huang H,Zhang X,Hu X,et al.A functional biphasic biomaterial homing mesenchymal stem cells for in vivo cartilage regeneration[J].Biomaterials,2014,35(36):9608-9619.
[14]Rongen JJ,van Tienen TG,van Bochove B,et al.Biomaterials in search of a meniscus substitute[J].Biomaterials,2014,35(11):3527-3540.
[15]Baker BM,Mauck RL.The effect of nanofiber alignment on thematurationofengineeredmeniscusconstructs[J]. Biomaterials,2007,28(11):1967-1977.
[16]Ng R,Gurm JS,Yang ST.Centrifugal seeding of mammalian cells in nonwoven fibrous matrices[J].Biotechnol Prog,2010,26(1):239-245.
[17]Li J,Jiang L,Liao G,et al.Centrifugal forces within usuallyused magnitude elicited a transitory and reversible change in proliferation and gene expression of osteoblastic cells umr-106[J].Mol Biol Rep,2009,36(2):299-305.
[18]Godbey WT,Hindy SB,Sherman ME,et al.A novel use of centrifugal force for cell seeding into porous scaffolds[J]. Biomaterials,2004,25(14):2799-2805.
[19]Goble EM,Kohn D,Verdonk R,et al.Meniscal substitutes--human experience[J].Scand J Med Sci Sports,1999,9(3):146-157.
[20]Jiang D,Zhao LH,Tian M,et al.Meniscus transplantation using treated xenogeneic meniscal tissue:Viability and chondroprotection study in rabbits[J].Arthroscopy,2012,28(8):1147-1159.
An Optimal Method for Seeding Meniscal Fibrochondrocytes into Demineralized Cancellous Bone Scaffolds
Zhang Zhengzheng,Wang Shaojie,Qi Yansong,Zhang Jiying,Jiang Dong,Yu Jiakuo
Institute of Sports Medicine,Peking University Third Hospital,Beijing,China 100191
Jiang Dong,Email:bysyjiangdong@126.com;Yu Jiakuo,Email:yujiakuo@126.com
Objective The purpose of the study is to explore an optimal method for seeding meniscal fibrochondrocytes(MFCs)into demineralized cancellous bone(DCB)scaffolds.Methods Statics,injection,centrifugation and vacuum methods of inoculation were used to seed the MFCs into the DCB scaffolds(composed of 80%porosity and 268 μm pore size).Cell viability was assessed by fluorescence staining and its distribution by a softwear of reconstructed three-dimensional image.The Cell Counting Kit-8 assay and DNA assay were employed to assess the cell proliferation.Results The survival rate of the MFCs were significantly improved via centrifugal seeding as compared to the other three seeding methods(P<0.05). Seeded MFCs using centrifugation revealed more homogeneous distribution throughout the scaffold as compared to the other three seeding methods.There was no significant differences in the penetration depth in the scaffold of seeded MFCs by the three seeding methods(P>0.05).The reproductive activity of MFCs in day 1 to 5 and the level of DNA in the scaffold in the day 14 to day 21 of the centrifugal group surpassed the other three groups(P<0.05).Conclusion The centrifugal seeding method could significantly improve MFCs distribution and proliferation on the DCB scaffolds,providing a simple and effective cell-seeding procedure for tissue-engineered meniscus.
seedingmethod,meniscalfibrochondrocytes,demineralizedcancellousbone,tissueengineered meniscus
2015.10.28
863主题项目(2012AA020502);国家自然科学基金青年基金项目(31200725);国家自然科学基金面上项目(51273004)
江东,Email:bysyjiangdong@126.com;余家阔,Email:yujiakuo@126.com
