三孢布拉霉菌发酵生产β-胡萝卜素的代谢调控
2016-10-14喻静兰孙建春
喻静兰,孙建春,杨 晔
(上海化工研究院,上海 200062)
三孢布拉霉菌发酵生产β-胡萝卜素的代谢调控
喻静兰,孙建春,杨 晔
(上海化工研究院,上海 200062)
[目的]研究三孢布拉霉菌发酵生产β-胡萝卜素的代谢调控途径,为通过优化发酵培养条件来提高β-胡萝卜素的产量提供依据和参考。[方法]采用紫外分光光度计测定β-胡萝卜素的含量,优化正负菌孢子接入种子培养基的接种比例,通过对三孢布拉霉菌发酵生产β-胡萝卜素的代谢调控分析,确定最佳补液时间,优化培养温度和接种比例来提高β-胡萝卜素的产量。[结果]最佳孢子接种比例为正菌∶负菌=10∶1,最佳补液时间为52 h,最佳培养温度为27 ℃,最佳种子液接种比例为8%。[结论]通过对菌体生长代谢的分析优化了培养条件,并将β-胡萝卜素的产量从1.45 g/L提高到2.26 g/L,产量提高了55.9%,取得了较好的效果,为β-胡萝卜素的工业化生产奠定了基础。
三孢布拉霉; β-胡萝卜素; 发酵; 代谢调控
β-胡萝卜素是重要的维生素A前体[1],具有较强的抗氧化作用,在食品、保健品、化妆品以及医药等领域具有重要用途。目前,我国β-胡萝卜素的生产方法主要有化学合成法、植物提取法和微生物发酵法3种[2-3]。其中,微生物发酵法由于产品天然且不受环境条件限制、培养周期短、易于产业化等优点,越来越受到重视,已成为天然β-胡萝卜素的主要生产方法。三孢布拉霉菌具有生长迅速、生物量大和类胡萝卜素合成产量高等特点,是发酵生产β-胡萝卜素的优良菌种。研究表明,通过将该菌的正、负单性菌株混合发酵可获得较高产量的β-胡萝卜素[4]。笔者对菌株发酵种子液培养期的初级代谢结果进行分析,并根据分析结果对初级代谢阶段的发酵条件进行一系列的优化,从而提高最终产物β-胡萝卜素的产量。
1 材料与方法
1.1菌种三孢布拉霉(Blakesleatrispora):正菌H5-30,负菌H6-1,由上海化工研究院生物化工实验室保存。
1.2仪器和试剂分光光度计UV755B;无水乙醇,石油醚。
1.3培养基PDA培养基:土豆汁200 g/L,葡萄糖200 g/L,蛋白胨100 g/L,琼脂200 g/L,VB15 mg/L;种子培养基:黄豆饼粉80 g/L,玉米粉28 g/L,VB150 g/L,淀粉酶1滴;发酵培养基:玉米淀粉80 g/L,黄豆饼粉16 g/L,酵母膏2 g/L,异烟肼0.4 g/L,VB15 mg/L,KH2PO40.6 g/L,MnSO40.3 g/L,Triton 1.2 g/L,煤油24 g/L,豆油66 g/L。
1.4培养方法
1.4.1孢子悬浮液的制备。将甘油管保藏的正负菌菌株分别接种至PDA培养基培养至孢子长出,用25 mL无菌水洗涤孢子并用2层纱布过滤,分别得到正负菌孢子悬浮液。取1 mL孢子悬浮液稀释至6 mL,用分光光度计在波长650 nm下测定吸光度,计算悬浮液的孢子浓度。
1.4.2种子培养。按照正菌孢子悬浮液接种量为3,负菌孢子接种量为0.3的接种比例接入种子培养基,在27 ℃、230 r/min下培养24 h。
1.4.3发酵培养。将培养好的种子液按10%的接种比例接入发酵培养基,在27 ℃、230 r/min下培养120 h。1.5β-胡萝卜素的提取和测定将培养好的菌丝分别用200目丝网抽滤,温水冲洗至滤液无色,称取湿重;在80~90 ℃下烘干至恒重,计算生物量。称取适量菌体至10 mL离心管,加钢珠和5 mL二甲基亚砜∶三氯甲烷=2∶3的混合液,振荡打磨45 min后离心,浸出液用无水乙醇稀释100倍后,在波长455 nm下测定吸光度,根据标准曲线计算β-胡萝卜素的含量。
2 结果与分析
2.1β-胡萝卜素含量标准曲线精确称取β-胡萝卜素标准品晶体,用石油醚溶解并稀释成浓度梯度,在其最长吸收波长455 nm下[5]测定其吸光度,以β-胡萝卜素浓度为横坐标,吸光度为纵坐标绘制标准曲线,结果见图1。由图1可知,最大吸收波长为455 nm,其回归方程为y=1.143 8x+0.007 3,R2=0.999 8。可见在该波长下β-胡萝卜素的浓度与吸光度具有良好的线性关系。
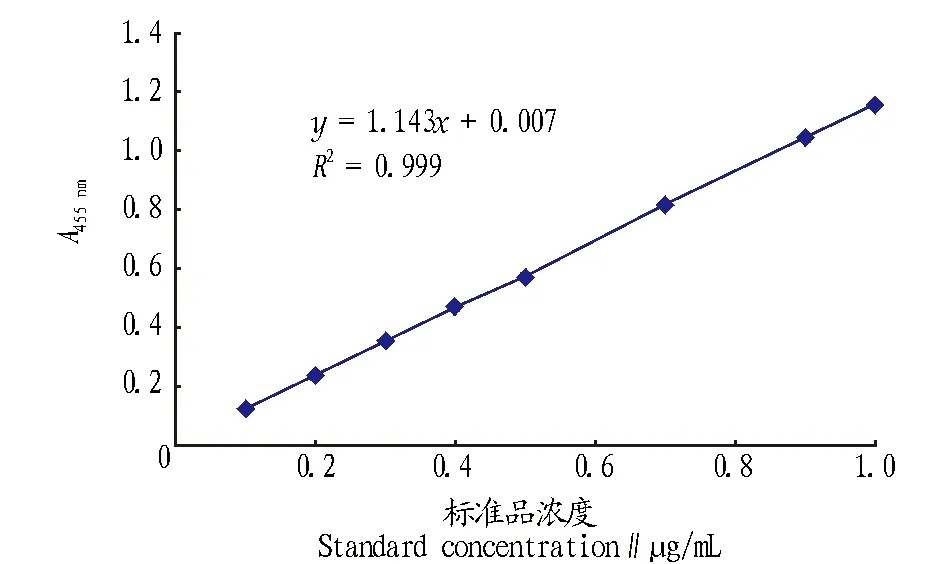
图1 β-胡萝卜素标准曲线Fig.1 The standard curve of β-carotene
2.2正负菌孢子悬浮液接种量对β-胡萝卜素产量的影响将培养好的正负菌孢子以孢子悬浮液的形式按一定比例混合接入种子液培养基的方法[6-7]进行种子液培养,并对正负菌孢子的接种量进行梯度条件试验。
将正负菌孢子悬浮液按照表1的梯度交叉配对接入种子培养基,经过全流程发酵培养,得到β-胡萝卜素产量,并进行等高线曲面绘图分析。

表1 正负菌接种量
由图2可知,最佳接种比例:正菌0.65~0.77,负菌0.055~0.085,正负菌最佳接种比例为8∶1~14∶1。在此接种比例区间,β-胡萝卜素的产量可达1.7~1.8 g/L。在此后的多次试验中,此接种范围内获得的β-胡萝卜素产量无显著差异。为了试验过程中的可操作性,将正负菌接种比例固定为10∶1。
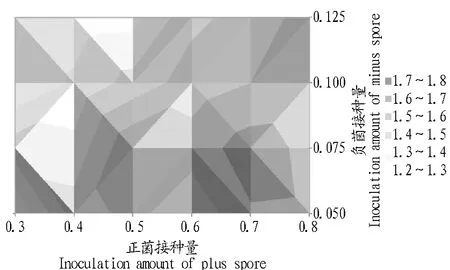
图2 正负菌不同接种量下β-胡萝卜素的产量Fig.2 The β-carotene production with different inoculation amount of plus(+) to minus(-) spores
2.3三孢布拉霉发酵产β-胡萝卜素的初级代谢情况由图3可知,三孢布拉霉菌株接种后立即进入对数生长期,48~52 h到达对数生长末期,培养至52~60 h,由于培养基营养耗尽,菌体生长进入平台期。而β-胡萝卜素的生成迟于生物量的增长,从16 h进入对数生长期,在生物量进入平台期后仍持续增长。随着发酵的进行,生物量和β-胡萝卜素不断增加,发酵液中的糖源不断消耗,残糖不断减少,由于发酵液中糖浓度的降低使得糖的消耗趋缓,在52~60 h需要进行一次补液。

图3 三孢布拉霉发酵产β-胡萝卜素的初级代谢情况Fig.3 Primary metabolism of fermentative production ofβ-carotene by Blakeslea trispora
2.4发酵温度对代谢的影响为了进一步确认最佳补液时间,同时考察温度的影响,选取菌体生长进入平台期的时间节点52和60 h,考察不同发酵温度对菌体生长的影响。由图4可知,60 h的生物量均稍高于52 h的生物量,60 h的β-胡萝卜素产量也稍高于52 h,说明在52~60 h菌体仍缓慢生长。因此,应选择对数生长末期,即52 h进行接种较理想。52 和60 h的生物量与β-胡萝卜素随温度的变化曲线呈高度的相似性,同时在24和27 ℃出现2个峰值,因此,在这2个温度点分别接种至发酵液培养基,继续进行生长曲线的跟踪监测。
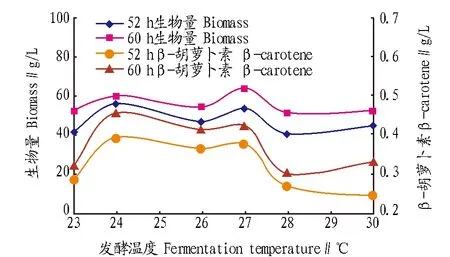
图4 生物量与β-胡萝卜素产量随温度的变化Fig.4 The change of biomass and β-carotene production with temperature
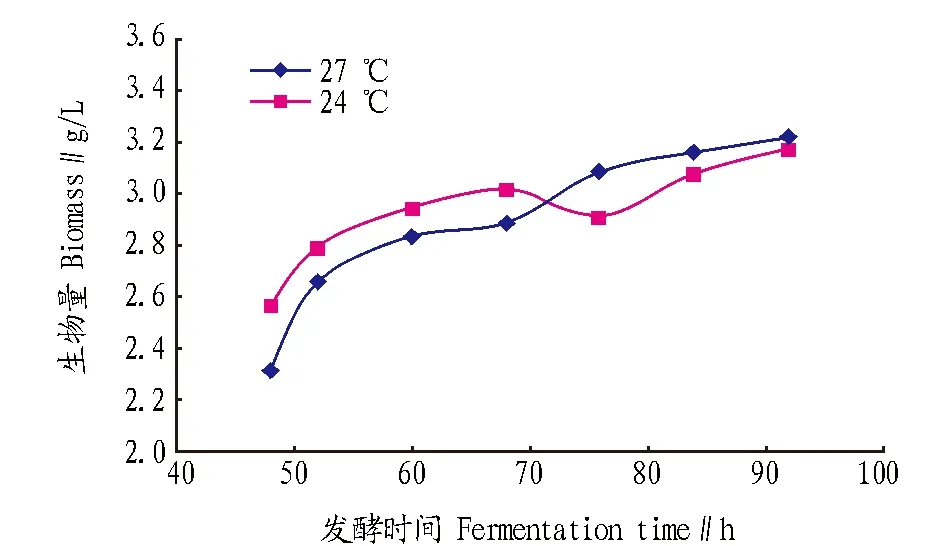
图5 不同温度下的生物量Fig.5 Biomass under different temperature
由图5可知,72 h前24 ℃的生物量高于27 ℃的生物量,而在72 h后,27 ℃的生物量高于24 ℃的生物量,并在发酵终点96 h重新吻合。其原因可能在于三孢布拉霉菌的发酵是由正菌和负菌共同完成,其正菌和负菌的生长条件和生长速度存在一定差异,导致在整体生长情况下呈现2个交替上升的较优发酵生长温度。其机理有待今后进一步探究。根据在接近发酵终点92 h测定的生物量可以看出,27 ℃的发酵生长情况优于24 ℃,因此,确定27 ℃为最佳发酵培养温度。
2.5接种量对代谢的影响种子培养结束后,分别考察将种子液以不同接种比例接入发酵培养基进行全流程培养的发酵结果。由图6可知,接种量为1%~8%,β-胡萝卜素的产量和接种量成正比例提高,接种量达10%时略有下降。
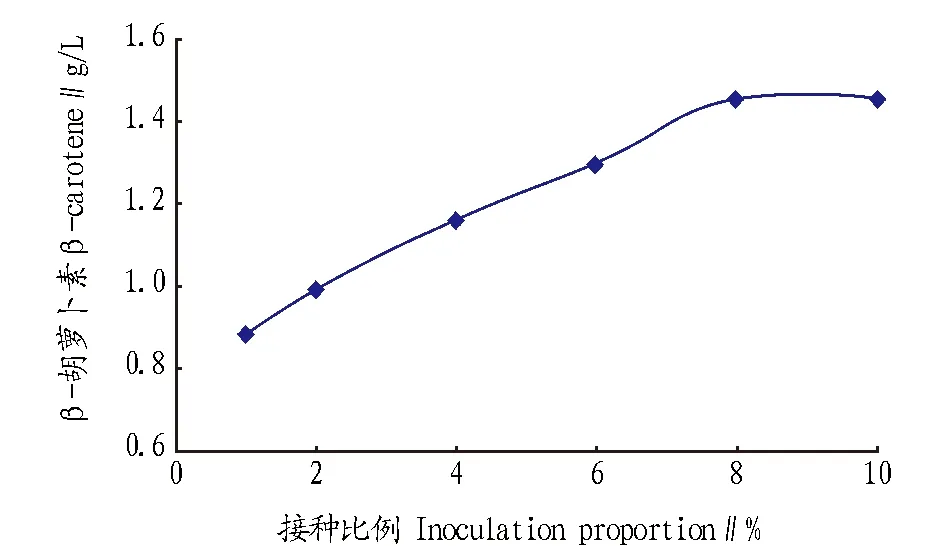
图6 接种量对β-胡萝卜素产量的影响Fig.6 The influence of the inoculation amount on the β-carotene production
由图7可知,尽管在对数生长阶段,即30 h左右,残糖由于消耗迅速而产生波动,但在对数生长末期即52 h左右时,残糖浓度按照1%~8%的接种比例依次递减,与β-胡萝卜素的产量呈较好的相关性,说明接种比例从1%逐步增加到8%的过程中,菌体生长越来越旺盛,糖的消耗越来越多,目标产物β-胡萝卜素的产量也逐步提高。因此,将8%(V/V)的接种比例确定为最佳接种比例。
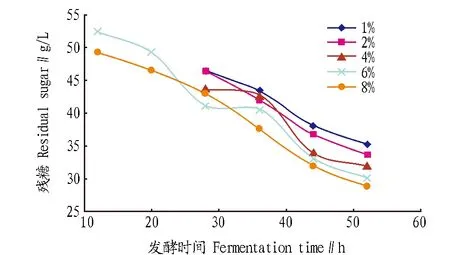
图7 不同接种量的糖代谢情况Fig.7 The carbohydrate metabolism with different inoculation amount
3 结论
该研究利用三孢布拉霉菌发酵生产β-胡萝卜素,研究了菌体相关生长代谢曲线,并在此基础上对发酵条件进行了一定优化。结果表明,最佳正负菌孢子接种比例为正菌∶负菌=10∶1;最佳补液时间为52 h,最佳培养温度为27 ℃,最佳种子液接种比例为8%。
在进行一系列的培养条件优化后,β-胡萝卜素的产量从1.45 g/L提高到2.26 g/L,产量提高了55.9%,取得了较好的效果,为β-胡萝卜素的工业化生产奠定了基础。
[1] 曾强松,童海宝,徐静安,等.三孢布拉霉发酵生产β-胡萝卜素工艺研究[J].工业微生物,2002,32(4): 7-10.
[2] 廖春丽,郭瑞强,陈兰英,等.β-胡萝卜素发酵培养基的优化[J].河南工业大学学报(自然科学版),2008,29(1): 60-64.
[3] 潘鹏,杨斯,蔡俊,等.三孢布拉霉菌产β-胡萝卜素发酵条件的研究[J].食品与发酵科技,2010,46(4): 36-40.
[4] 尹金凤,王志轩,吴欣森,等.三孢布拉氏霉发酵生产β-胡萝卜素的研究进展[J].食品科学,2014(13):316-325.
[5] 王海滨.类胡萝卜素的紫外可见光谱特性及其应用[J].武汉工业学院学报,2004,23(4):11-13.
[6] KIM S W,SEO W T,PARK Y H.Enhanced synthesis of trisporic acid and β-carotene production inBlakesleatrisporaby addition of non-ionic surfactant,Span 20[J].Journal of fermentation and bioengineering,1997,84: 330-332.
[7] 张阳.三孢布拉霉大量产孢条件及发酵动力学研究[D].武汉: 华中科技大学,2013: 13-25.
Metabolic Control of Fermentative Production of β-carotene byBlakesleatrispora
YU Jing-lan,SUN Jian-chun,YANG Ye
(Shanghai Research Institution of Chemical Industry,Shanghai 200062)
[Objective] The aim was to study the metabolic control of fermentative production of β-carotene byBlakesleatrispora,which provide a basis for increasing the production of β-carotene by optimized conditions.[Method] Through determiningβ-carotene content by ultraviolet spectrophotometer,the inoculation ratio of plus(+) and minus(-) spores were optimized.Through study on the metabolic control of efficient synthesis of β-carotene by matedBlakesleatrispora,the optimal medium supply time,culture temperature and inoculation amount was determined.[Result] After above,the optimum conditions were obtained,with the inoculation ratio of plus(+) and minus(-) spores was 10∶1,the time of medium supply was 52 hours,the culture temperature was 27 ℃,the inoculation amount was 8%.[Conclusion] Through study on the metabolic control of fermentation production of β-carotene byBlakesleatrispora, the optimum conditions were obtained.As a result,the production of β-carotene was increased from 1.45 to 2.26 g/L,the rate of increase was up to 55.9%,which lays a foundation for the industrial production of β-carotene.
Blakesleatrispora; β-carotene; Fermentation; Metabolic control
上海化工研究院科研计划项目(1806A-1)。
喻静兰(1981- ),女,湖北武汉人,工程师,硕士,从事功能食品微生物发酵工程研究。
2016-06-30
TS 201.3
A
0517-6611(2016)24-085-03
