超高效液相色谱串联质谱法测定豆芽中4-氯苯氧乙酸的含量
2016-10-14史晓磊
史晓磊
(上海德诺产品检测有限公司,上海 200436)
超高效液相色谱串联质谱法测定豆芽中4-氯苯氧乙酸的含量
史晓磊
(上海德诺产品检测有限公司,上海 200436)
[目的]采用超高效液相色谱串联质谱法建立豆芽中4-氯苯氧乙酸的定性定量分析方法。[方法]样品经0.01 mol/L氢氧化钠溶液提取,Oasis HLB固相萃取小柱净化,C18色谱柱分离,乙腈-0.1%甲酸水溶液为流动相,采用电喷雾离子源多反应监测模式下液相色谱串联质谱法检测,基质曲线外标法定量。[结果]在最佳检测条件下,4-氯苯氧乙酸在20~500 μg/L线性关系良好,相关系数为0.998 1,检出限(S/N=3)为20 μg/kg。在加标水平为20、60、100 μg/kg时的平均加标回收率分别为87.62%、102.10%和100.00%,其相对标准偏差(RSD)分别为3.48%、4.92%和6.59%。[结论]该方法具有灵敏度高、准确度和稳定性良好、操作简捷等的特点,能够满足残留分析的要求。
超高效液相色谱串联质谱法(UPLC-MS/MS);固相萃取(SPE);豆芽;4-氯苯氧乙酸
4-氯苯氧乙酸,又称对氯苯氧乙酸钠,作为一种植物生长调节剂,能有效地提高豆芽产量和质量。很多不法商贩为了利益,违法国家规定,在生产豆芽时继续添加4-氯苯氧乙酸。目前,关于豆芽中4-氯苯氧乙酸的含量分析,大多采用高效液相色谱法[1-8],该方法灵敏度高、分离效果好、定量准确,已被证明是一种成熟的分析方法。然而采用液相色谱进行分析时,被测物与干扰物在色谱柱中具有相同保留时间的现象时有发生,对易污染的样品易造成假阳性。近2年也有研究采用离子色谱法[9]、液相色谱串联质谱法进行测定[10-12]。笔者利用目前国际上最为先进和普遍采用的残留检测技术(LC/MS/MS)和固相萃取(SPE)样品净化前处理技术,建立了豆芽中4-氯苯氧乙酸残留量的液相色谱-质谱/质谱(LC/MS/MS)检测方法和阳性确证方法。
1 材料与方法
1.1仪器与试剂超高效液相色谱-质谱/质谱仪配有电喷雾离子源(UPLC-MS/MS-ESI)(美国Waters公司);Waters ACQUITY UPLC BEH C18色谱柱(2.1 mm i.d.× 100 mm,1.7 μm)和Oasis HLB 固相萃取小柱(60 mg,3 mL)均购自美国Waters公司;电子分析天平(精度为0.0001 g,瑞士METTLER TOLEDO公司);电子分析天平(精度为0.01 g,德国Sartorius ME公司);高速匀浆机(德国IKA T18,3 500~24 000 r/min);涡旋振荡器(美国talboys 230V,500~2 500 r/min);固相萃取仪(安谱公司);冷冻离心机和超纯水仪(美国Thermo Fisher公司)。4-氯苯氧乙酸标准品购于Dr.Ehrenstorfer(德国);甲醇(德国Merck KGaA公司)、乙腈(Sigma公司)、甲酸(Sigma公司)均为HPLC纯;磷酸(H3PO4)、氢氧化钠(NaOH)为分析纯(中国医药上海化学试剂公司);pH试纸(中国医药上海化学试剂公司);试验用水为超纯水。
1.2样品前处理
1.2.1样品提取。称量待测样品5 g(精确至0.01 g)置于50 mL离心管中,加入10 mL 0.01 mol/L氢氧化钠溶液,高速匀浆2 min提取,然后在8 000 r/min下离心5 min,将上清液转移至25 mL容量瓶中。残渣中再加入10 mL 0.01 mol/L氢氧化钠溶液,按上述方法重复提取一次,合并2次提取溶液,用0.01 mol/L氢氧化钠溶液定容至刻度,混匀。准确移取10.0 mL提取液,用50%磷酸溶液调节提取液pH为2.5±0.2,待净化用。
1.2.2样品净化。将全部样品提取液通过已活化(3 mL甲醇、3 mL水)的Oasis HLB固相萃取小柱,上样后再用3 mL磷酸水溶液淋洗,淋洗后在固相萃取装置上真空抽干水分10 min,经4 mL甲醇洗脱,收集至10 mL玻璃试管中,40 ℃氮气吹干,加入1.0 mL 30 %甲醇水溶液,充分旋涡溶解,经0.22 μm滤膜过滤,待LC-MS/MS分析。
1.3仪器条件
1.3.1色谱条件。流动相的组成和梯度见表1。
1.3.2质谱条件。采用1.0 mg/L 4-氯苯乙酸标准溶液在负离子模式下进行母离子全扫描,确定其分子离子,并对仪器电离电压、锥孔电压、离子源温、碰撞能量等参数进行优化。
离子化模式:电喷雾电离(负离子模式);质谱扫描方式:多反应监测(MRM);离子源温度:150 ℃;毛细管电压:1.5 kV;脱溶剂温度:400 ℃;脱溶剂气流:800 L/h;碰撞气:氩气。4-氯苯氧乙酸的质谱参数:母离子(m/z)185.1,子离子(m/z)126.9*、110.9,锥孔电压-18、-18V,碰撞能量-16、-16V。

表1 流动相的组成和梯度
2 结果与分析
2.1样品的净化根据豆芽基质的特点,采用Oasis HLB固相萃取柱净化,并对其净化条件进行试验,以达到Oasis HLB固相萃取柱对4-氯苯氧乙酸分离的最佳净化效果。向空白豆芽基质中加入一定浓度的4-氯苯氧乙酸标准工作溶液,并按优化后的方法通过Oasis HLB固相萃取小柱,收集活化时所用的甲醇、水以及样品流出液、淋洗液和洗脱液于不同试管中,分别检测各流出液中4-氯苯氧乙酸的含量和回收率,以确定Oasis HLB固相萃取小柱对4-氯苯氧乙酸净化的洗脱液最佳收集体积。由图1可知,4-氯苯氧乙酸在Oasis HLB固相萃取小柱上在20 mL前完全流出。因此,选择4 mL洗脱液可最大程度地除去豆芽基质的干扰,同时保证4-氯苯氧乙酸的回收率符合检测要求。
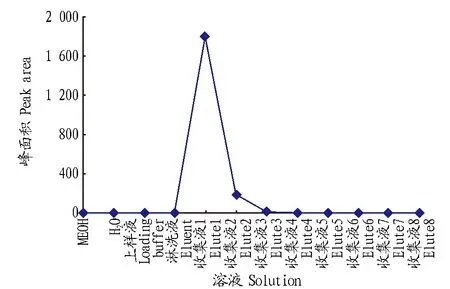
图1 Oasis HLB固相萃取小柱洗脱曲线Fig.1 Elution curve of solid phase extraction of Oasis HLB
2.2色谱条件的优化色谱柱的选择:为了有利于色谱峰的分离及峰形的改善,分别比较2种色谱柱Waters ACQUITY UPLC HSS T3色谱柱和Waters ACQUITY UPLC BEH C18色谱柱对4-氯苯氧乙酸分离程度和响应值的影响。经试验证明,使用C18色谱柱分离效果更好,4-氯苯氧乙酸响应值更高。
流动相的选择:在流动相中加入酸性物质或者缓冲盐,可以增强待测物在色谱柱上的保留效果,并提高分离度,有效改善峰形,比较4-氯苯氧乙酸在3种流动相乙腈-甲酸铵、乙腈-0.1%甲酸水和乙腈-乙酸铵中的分离效果,发现使用乙腈-0.1%甲酸水溶液做流动相时能更好地将待测组分与豆芽基质最大限度地分开。
4-氯苯氧乙酸标准品和豆芽中添加4-氯苯氧乙酸标样的提取离子色谱见图2。

图2 4-氯苯氧乙酸标准品(A)和样品加标(B)提取离子色谱图Fig.2 Extraction ion chromatograms of 4-chlorophenoxyacetic acid standard substances(A),blank bean sprouts sample(B)and fortified sample with 4-chlorophenoxyacetic acid(C)
2.34-氯苯氧乙酸的检出限和线性范围用空白豆芽样品作为基质溶液逐级稀释标准工作溶液,以验证方法的灵敏度,以信噪比(S/N)为3∶1时的浓度确定为检出限(LOD),并配制一系列浓度的标准工作溶液,采用上述色谱条件进行测定,以定量离子的峰面积Y为纵坐标,浓度X(μg/L)为横坐标进行线性回归分析,重复6次,取平均值。结果表明,该方法4-氯苯氧乙酸的最低检出限为20 μg/kg,4-氯苯氧乙酸标准溶液浓度在20~500 μg/L与响应值线性关系良好,回归方程为Y=6.635 66x+85.559,相关系数r=0.998 1。2.4方法的准确度和精密度在不含4-氯苯氧乙酸的豆芽样品中加入标准工作溶液,配制20、60、100 μg/kg 3个水平的加标样品,按优化后的提取方法和色谱条件进行添加回收率试验,结果见表3。由表3可知,在加标水平为20、60、100 μg/kg时平均回收率分别为87.62%、102.10%和100.00%,其RSD分别为3.48%、4.92%和6.59%。表明该研究采用的提取、净化、检测方法具有较高的准确度和较好的重复性,均可满足4-氯苯氧乙酸在豆芽中残留分析的要求。
表3豆芽中4-氯苯氧乙酸标样添加回收率
Table 3Average recovery rate of 4-chlorophenoxyacetic acid in bean sprouts

添加水平Spikedlevelμg/kg试验号Testcode检测值Detectedvaluμg/kg回收率Recoveryrate%平均回收率Averagerecoveryrate∥%相对标准偏差RSD%20118.2391.1387.623.48218.2691.32317.2286.10416.9084.52517.5987.93616.9484.7160163.68106.13102.104.92257.7496.24362.78104.64460.82101.36557.7496.24664.78107.96100191.5091.50100.006.592101.73101.733102.45102.45492.1992.195106.85106.856105.26105.26
2.5样品分析应用该方法对市面上购买的20组豆芽样品进行检测,结果其中2组含有4-氯苯氧乙酸,残留量分别为40.97和29.36 μg/kg。在实验室内分别培育10组不含目标化合物的黄豆芽、绿豆芽样品,采用该方法进行检测,未发现有4-氯苯氧乙酸残留,证明该方法在实践中具有可操作性。
3 结论
该研究采用氢氧化钠溶液提取,经Oasis HLB固相萃取柱净化,液相色谱串联质谱法测定,最终建立了固相萃取-超高效液相色谱串联质谱法测定豆芽中4-氯苯氧乙酸残留量的方法。经验证该方法能够有效地检测4-氯苯氧乙酸在豆芽样品中的残留,并具有灵敏度高、准确度和稳定性良好、操作简捷等特点,满足豆芽样品中4-氯苯氧乙酸残留分析的要求,同时为4-氯苯氧乙酸在其他植物源食品中的残留分析提供参考。
[1] 北京市海淀区产品质量监督检验所(国家食品质量安全监督检验中心).豆芽中4-氯苯氧乙酸 6-苄基腺嘌呤 2,4-滴 赤霉素 福美双的测定:DB11/T 379—2006[S].北京:北京市质量技术监督局,2006.
[2] 吉林农业大学.豆芽中4-氯苯氧乙酸钠的测定 高效液相色谱法:DBS22/009—2013[S].吉林省卫生厅,2013.
[3] 张玉娟,张志强,刘静.豆芽中4-氯苯氧乙酸钠检测现状综述[J].科技风,2014(15):177,195.
[4] 夏慧,陆自强,杨益众.高效液相色谱法测定豆芽中2,4-二氯苯氧乙酸残留[J].扬州大学学报(农业与生命科学版),2011,32(4):86-89.
[5] WONG Y S.Gas liquid chromatography determination of 4-chlorophnoxyacetic acid residues in mung bean sprouts[J].J Assoc Off Anal Chem,1982,65(5):1118-1121.
[6] 劳水兵,刘丽辉,周其峰.2-甲基-4氯苯氧乙酸钠在甘蔗茎和土壤中的残留检测方法[J].广东农业科学,2014(1):137-140.
[7] 黄卫平.高效液相色谱法测定豆芽中4-氯苯氧乙酸钠残留量[J].检验技术,2002,36(1):44-45.
[8] 李小平,蒋经纬,范建中,等.固相萃取HPLC法测定豆芽中4-氯苯氧乙酸钠[J].中国卫生检验杂志,2006,16(3):267-268.
[9] 颜金良,颜勇卿,王立,等.离子色谱法快速测定豆芽中4-氯苯氧乙酸残留量[J].中国卫生检验杂志,2006,16(10):1207-1208.
[10] GE L,PEH C Y C,YONG J W H,et al.Analyses of gibberellins by capillary electrophoresis-mass spectrometry combined with solid-phase extraction[J].Chromatogr A,2007,1159(1/2):242-249.
[11] 张亚莲,柳菡,王岁楼,等.高效液相色谱-串联质谱法测定豆芽中8种药物残留[J].分析测试学报,2015,34(2):164-170.
[12] 谢寒冰,周明莹,赵海峰,等.高效液相色谱-四极杆飞行时间质谱法同时检测豆芽中的3种外源植物激素残留[J].色谱,2014,32(5):493-498.
Determination of 4-Chlorophenoxyacetic Acid in Bean Sprout by UPLC-MS/ MS
SHI Xiao-lei
(Shanghai DtsChina Co., Ltd., Shanghai 200436)
[Objective] To establish a qualitative and quantitative analysis method for 4-chlorophenoxyacetic acid in bean sprout by ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS). [Method] The sample was extracted with 0.01 mol/L sodium hydroxide solution, and cleaned up with Oasis HLB. The separations were performed on a C18 column, with a mobile phase of 0.1% formic acid aqueous solution-acetonitrile and detected by positive-ion electrospray ionization mode and multi-reaction monitoring (MRM) mode. [Result] Under the optimal test condition, 4-chlorophenoxyacetic acid showed good linear relationship within the range of 20 -500 μg/L, with correlation coefficient of 0.998 1. The limit of detection(S/N=3) was 20.0 μg/kg. The average recovery rates at three spiked levels of 20, 60, 100 μg/kg were 87.62%, 102.10% and 100.00%, respectively. The relative standard deviations (RSD) were 3.48%、4.92%and 6.59%, respectively. [Conclusion] This method had the characteristics of high sensitivity and accuracy, which can meet the requirement of retention analysis.
UPLC-MS/MS; Solid phase extraction; Bean sprout; 4-Chlorophenoxyacetic acid
史晓磊(1988- ),男,黑龙江黑河人,助理工程师,硕士,从事质谱分析研究。
2016-07-04
TS 207
A
0517-6611(2016)24-080-02
