水热法制备兼具选择透光性与高吸附特性的(NH4)xWO3纳米晶体
2016-10-14徐文艾康利涛卫爱丽
董 丽,徐文艾,康利涛,卫爱丽
(太原理工大学材料科学与工程学院,太原 030024)
水热法制备兼具选择透光性与高吸附特性的(NH4)xWO3纳米晶体
董丽,徐文艾,康利涛,卫爱丽
(太原理工大学材料科学与工程学院,太原030024)
以(NH4)10W12O41·5H2O,HCl,柠檬酸和N2H4·2HCl为原料,利用水热法制备了铵钨青铜纳米晶,研究了HCl浓度对所制备铵钨青铜(NH4)xWO3纳米晶的影响。实验证实,当HCl浓度低于7.67 mg·mL-1时产物为[001]取向生长的纯六方相(NH4)xWO3纳米棒;HCl浓度增高(9.86和12.05 mg·mL-1)时会生成杂相WO3·H2O和(NH4)10W12O41。吸附实验表明,(NH4)xWO3纳米晶对亚甲基蓝(MB,模拟有机染料污染物)具有优异的吸附性能。并且,吸附在(NH4)xWO3表面的染料经加热处理即可除去,且加热处理后的纳米晶对亚甲基蓝仍具有良好的吸附性能。
水热法; 钨青铜; 选择透光性; 吸附
1 引 言
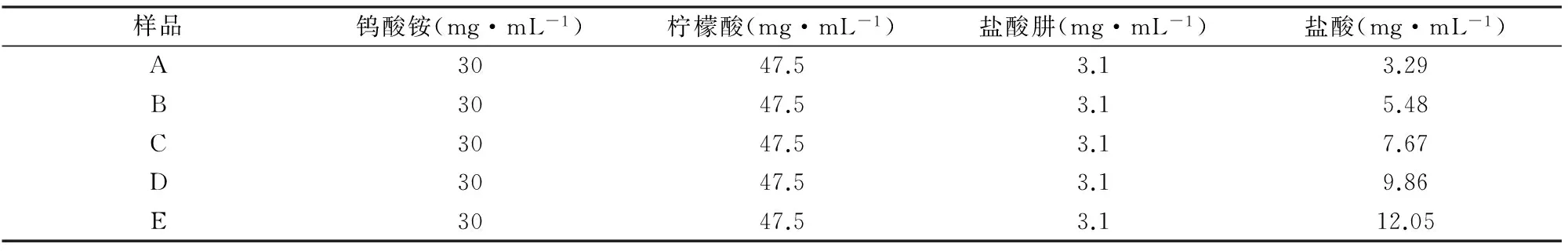
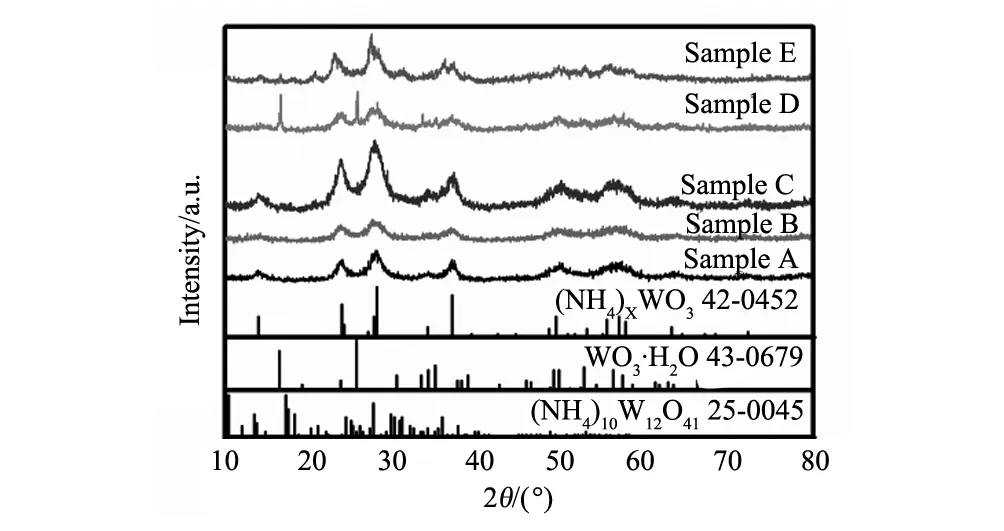
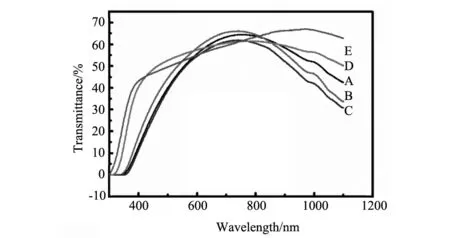
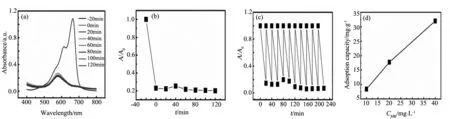
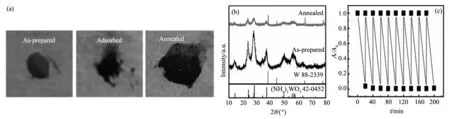
WO3是一种典型的半导体材料,带隙2.5~3.0 eV,非化学计量比化合物丰富,缺陷结构独特,可以衍生出多种功能材料[1]。例如,当在WO3晶格中引入氧空位或者间隙阳离子施主时,可以获得具有透明导电特性的低价态钨氧化物(WO3-x)或者钨青铜材料 (MxWO3, M = Li, Na, K, Rb, Cs, NH4或In, 0 对于光学和吸附应用而言,晶体尺寸与分散性控制是获得优良性能的核心所在。目前已经开发的钨青铜纳米晶合成方法主要有固相反应法、溶剂热法和水热法三种。其中,固相反应法具有成本低,产量大的特点;但该方法所获得的产物形貌可控性差、团聚性强,需要球磨二次细化后方能应用[13]。相对而言,溶剂热法可以一步获得纳米级晶体,产物形貌可以通过反应条件有效调控,后继处理与利用十分方便[14,15]。水热法与溶剂热法均通过液相条件下原料分解、成核、生长获得产物。所不同的是水热法不需消耗有机溶剂,工艺更加环保、经济[16]。但是,由于钨多酸离子在水体系中桥氧缩合速度很快,所以水热法所得钨青铜多为微米级粉体,难以满足光学、吸附等领域的应用要求[17,18]。 为此,本文作者开发了一种六方相铵钨青铜((NH4)xWO3)的一步水热合成工艺,并探讨了还原剂用量、水热温度等工艺条件对 (NH4)xWO3纳米棒形貌和光学性能的影响,深入分析了相关的影响机制。该方法以廉价无机盐为原料、以去离子水为溶剂,可以在100 ℃条件下获得高度分散的纳米级产物(纳米棒状,长6~12 nm,直径20~100 nm)[3,6]。作为上述工作的延续,本文进一步研究了HCl浓度对(NH4)xWO3纳米晶物相、微观结构和光学性能的影响,并考察了所得纳米晶对亚甲基蓝的吸附性能。 2.1实验原料及仪器 主要试剂:钨酸铵((NH4)10W12O41·5H2O),柠檬酸,盐酸肼(N2H4·2HCl),盐酸 (HCl)等,以上试剂均为分析纯,试验用水为二次去离子水。 主要仪器:X射线衍射仪(XPERT-PRO型),场发射扫描电子显微镜(MIRA3 LMH 捷克/TESCAN),场发射透射电子显微镜(JEOL JEM-2010F型),Hitachi UV 3900型分光光度计,Quantachrome Autosorb吸附仪。 2.2纳米晶水热合成 搅拌条件下,将1.9 g 柠檬酸和1.2 g (NH4)10W12O41·5H2O 先后溶于40 mL去离子水中,后加入0.124 g N2H4·2HCl和一定量的HCl分别作为还原剂和沉淀剂。上述溶液72 h搅拌均化后,转移到100 mL的水热釜中100 ℃水热处理24 h,然后自然冷却至室温,用去离子水和乙醇离心清洗数次,在空气中60 ℃干燥获得(NH4)xWO3纳米晶。实验选取了不同的HCl用量以考查其影响,具体配比见表1。 表1 水热法制备(NH4)xWO3纳米晶的原料成分列表 2.3纳米晶的光学性能表征 取0.5 g纳米晶溶于10 mL去离子水中,超声分散处理10 min后取2滴分散液加入比色皿, 用3 mL去离子稀释分散液后,利用Hitachi UV 3900型分光光度计(波长范围200~1100 nm)测试分散液光学性能,根据结果适当调整去离子水的二次加入量,获得可见光透光率相近的光谱曲线,比较不同样品的选择透光性能差别。 2.4纳米晶的吸附性能表征 配制一定浓度的亚甲基蓝水溶液,取0.1 g纳米晶溶于20 mL MB溶液中并避光搅拌20 min,再离心分离出吸附后的亚甲基蓝溶液,用吸光法测定其浓度变化;离心获得的下层纳米晶重新溶于20 mL新鲜的亚甲基蓝溶液中,接着避光搅拌20 min,重复离心分离与浓度测定过程,考查其循环吸附性能。 图1 样品A~E的XRD图Fig.1 XRD patterns of samples A-E 图1为不同HCl用量下所得纳米晶的XRD谱图。由图可知,样品A-C(对应HCl用量:3.29~7.67 mg·mL-1)的XRD峰位置与相对强度与六方铵钨青铜晶体的标准XRD峰匹配的很好;而样品A-C的XRD峰宽化明显,表明这些样品中晶体粒径很小。与样品A~C不同,样品D(HCl用量:9.86 mg·mL-1)在16.5°和25.7°处出现了两个明锐的XRD峰,表明该样品中出现了正交相WO3·H2O物相。样品E(HCl用量:12.05 mg·mL-1)中,正交相WO3·H2O的XRD峰强度明显降低,但在21.1°和37.1°处出现两个微弱的新峰,表明该反应条件下有反应原料(NH4)10W12O41残留。上述结果表明,合适的HCl用量,是获得纯相钨青铜产物的关键工艺因素之一。 图2 样品A(a),B(b),C(c),D(d)和E(e)的SEM图和样品C的氮吸附脱附曲线(f),插图为样品C的孔径分布Fig.2 SEM images of sample A(a),B(b),C(c),D(d) and E(e) and Nitrogen adsorption-desorption isotherm of sample C;Insert: pore-size distribution for sample C 图2a~e为五个样品的典型SEM图。由SEM图可知,所有样品均由纳米级一次粒子组成。由于纳米粒子具有很高的比表面积与表面能,使得干燥后的样品团聚成大块颗粒。氮吸附-脱附测试表明,样品C的比表面积高达99.7 m2·g-1(图2f),对应晶粒直径为9~10 nm。图2f亦知样品C 中孔径主要分布在2~5 nm范围,孔容为7.7×10-2cm3/g (孔隙率~30vol.%)。这些孔应为团聚体中纳米粒子间的堆积孔。 图3是样品A~E的典型TEM图。由图可知,样品A~C(图3a~c) 由直径5~10 nm,长度50~100 nm的短棒状纳米晶组成。图3c插图中的高分辨TEM图显示,垂直于长轴方向为(002)晶面,晶面间距0.375 nm,证明纳米棒沿[001]方向取向生长。不同于样品A~C,样品D和E(图3d~e)中除检测到纳米棒以外,还有少量亚微米的大晶粒。通过XRD与高分辨TEM分析可以断定,这些大晶粒应该是正交晶WO3·H2O 和 (NH4)10W12O41。 显微结构分析结果表明,HCl浓度在3.29~7.67 mg·mL-1范围内时,酸浓度对制备的六方相(NH4)xWO3的相组成和形貌影响不大。当HCl浓度提高到9.86 mg·mL-1时,产物中会出现亚微米级正交相WO3·H2O次晶相;当HCl浓度进一步提高到12.05 mg·mL-1时,产物中残余有未反应的 (NH4)10W12O41相。因此,合适的HCl浓度是水热法制备纯相钨青铜纳米晶的关键因素。 图3 样品A (a),样品 B (b),样品 C (c),样品 D (d)和样品 E (e,f)的TEM图Fig.3 TEM images of sample A (a),sample B (b),sample C (c),sample D (d) and sample E (e,f) 图4 样品A~E分散溶液的透过率光谱Fig.4 Transmittance spectra of the aqueous dispersion of samples A-E 图4为样品在300~1100 nm范围内的透光率曲线。其中,样品A~C近红外透过率较可见光透过率明显偏低,在778 nm处的可见光透过率分别为64.3,65.4和 61.9%,而在1100 nm处透光率分别为42.5,33.7,和 30.8%。因此,样品A~C可以用于制备透明隔热涂层,通过降低玻璃的太阳得热率减小炎热环境中建筑的制冷能耗,起到节约能源和减少CO2排放的效果。但是,样品D和E在近红外区透过率明显偏高;特别是样品E,其红外光透过率明显高于可见光透过率。样品D~E较弱的近红外吸收特性应该与次晶相的出现,以及晶体中的W5+浓度改变有关。 为了进一步探讨样品的吸附能力,作者选取亚甲基蓝模仿有机污染物开展吸附实验。如图5a所示,新鲜的亚甲基蓝溶液(40 mg·L-1)在665 nm处出现了一个强烈的吸收峰(-20 min)。向其中加入(NH4)xWO3纳米晶并避光搅拌20 min以后,离心所得上清液的吸收峰急剧下降(0 min),说明大量的亚甲基蓝被纳米晶吸附而去除,去除率约为~ 80 % (图5b)。此后,即使将吸附时间延长到120 min,溶液中的亚甲基蓝浓度都没有很大变化,表明体系已经基本达到了吸附平衡。 实验进一步进行了低浓度亚甲基蓝溶液的连续吸附实验,所用亚甲基蓝始初浓度为10 mg·L-1,测试结果如图5c所示。由图可知,样品可以连续从低浓度溶液中吸附亚甲基蓝,在11次连续吸附过程中,样品C对亚甲基蓝的吸附去除率基本稳定在80%~95%之间。不同吸附周期内去除率的波动可能与样品的团聚特性有关:随着搅拌时间的延长,纳米晶在搅拌和亚甲基蓝吸附双重作用下团聚性不断降低,从而提升了样品在后续吸附过程中吸附能力。为了证实实验的可重复性,作者重复了三次上述吸附实验,均获得了相近的实验结果。图5d显示了样品对不同浓度下亚甲基蓝均具有较好的吸附能力。 图5 (a)含有100 mg样品C的20 mL,40 mg·L-1亚甲基蓝溶液在不同吸附时间的吸光度曲线; (b)由吸光度曲线 换算获得的样品C对亚甲基蓝的吸附去除率曲线,A-亚甲基蓝初始浓度;A0-吸附后亚甲基蓝残余浓度; (c)100 mg样品C对11个20 mL,10 mg·L-1亚甲基蓝溶液样品的连续吸附去除率; (d)样品C对不同浓度亚甲基蓝溶液中亚甲基蓝的吸附去除率曲线Fig.5 (a)Adsorption spectra of MB solution (initial concentration of 40 mg·L-1,20 mL) in the presence of Sample C (100 mg) at different adsorption time;(b)Adsorption ratios of MB by Sample C at different adsoption time.A-initial MB concentration;A0-residual MB concentration of adsorption; (c) Adsorption ratios of MB (20 mL, initial concentration: 10 mg·L-1) by Sample C (100 mg) in a 11 times continuous adsorption test; (d) Adsorption capacities of MB by Sample C from MB solutions with different MB concentrations 对于吸附剂而言,如何去除吸附剂表面吸附物以重新恢复吸附能力也是一个重要的问题。对于本研究所得的样品,只需将吸附有亚甲基蓝的纳米晶在空气中250 ℃加热2 h,即可去除吸附物,实现吸附剂再生。图6a-b 给出了样品C吸附前(as-prepared),吸附后(adsorbed)和退火后(annealed)的光学照片与XRD图谱。测试结果表明,吸附有亚甲基蓝的纳米晶退火之后出现了少量的金属钨(JCPDS卡片号88-2339),样品颜色变黑,这可能是由于表面吸附的亚甲基蓝还原(NH4)xWO3纳米晶所致。图6c 是退火样品对亚甲基蓝的吸附去除率数据,结果表明退火样品依然可以高效吸附去除水溶液中的亚甲基蓝。其前几次吸附去除率甚至高于未退火样品,这可能与退火过程的脱附效应有关。 图6 (a)不同状态下样品C的光学照片:吸附MB之前(as-prepared),吸附MB之后(adsorbed),吸附退火之后(annealed); (b)样品C退火前后的XRD图谱;(c)退火样品C对MB溶液(初始浓度10 mg·L-1,20 mL)的循环吸附曲线Fig.6 (a)Optical images of different states of Sample C:before adsorption of MB (as-prepared),after adsorption of MB (adsorbed),after adsorption and annealing(annealed);(b)XRD patterns of the Sample C before and after annealed experiments; (c)The circulatory adsorption rate curves of MB solution (initial concentration of 10 mg·L-1, 20 mL) on annealed Sample C 本文探讨了HCl浓度对(NH4)xWO3纳米晶的相组成、形貌和光学性能的影响。实验结果表明合适的HCl浓度对纯相(NH4)xWO3纳米晶生成起到关键作用,且所得纳米晶具有明显的近红外光选择遮蔽特性。吸附实验表明,在不同溶液浓度下(NH4)xWO3纳米晶对亚甲基蓝的吸附性能良好,吸附去除率均值可以达到80%以上。并且,吸附在(NH4)xWO3纳米晶表面的亚甲基蓝染料在空气条件下经250 ℃,2 h加热处理即可去除,且加热后的纳米晶对亚甲基蓝仍具有良好的吸附性能。 [1] Mu W J, Xie X, Li X L, et al. Characterizations of Nb-doped WO3nanomaterials and their enhanced photocatalytic performance[J].RscAdvances, 2014, 4(68):36064-36070. [2] Bocarsly J D, Hirai D, Ali M N, et al. Superconducting phase diagram of InxWO3synthesized by indium deintercalation[J].Epl, 2013, 103(1):17001. [3] Kang L T, Xu W A, Wang K, et al. Transparent (NH4)xWO3colloidal dispersion and solar control foils: Low temperature synthesis, oxygen deficiency regulation and NIR shielding ability[J].SolarEnergyMaterialsandSolarCells, 2014, 128:184-189. [4] Liu J X, Shi F, Dong X L, et al. Morphology and phase controlled synthesis of CsxWO3powders by solvothermal method and their optical properties[J].PowderTechnology, 2015,270:329-336.. [5] Guo C S,Yin S, Dong Q, et al. Simple route to (NH4)xWO3nanorods for near infrared absorption[J].Nanoscale, 2012, 4(11):3394-3398. [6] Wang K, Kang L T, Chen S, et al. Effects of reaction temperature on structure and optical properties of hydrothermally prepared (NH4)xWO3-yand WO3·1/3H2O[J].JournalofInorganicMaterials, 2014, 29(5):550-556. [7] Guo C S, Yin S, Yu H J, et al. Photothermal ablation cancer therapy using homogeneous CsxWO3nanorods with broad near-infrared absorption[J].Nanoscale, 2013, 5(14):6469-6478. [8] Guo C S, Yin S, Yan M, et al. Facile synthesis of homogeneous CsxWO3nanorods with excellent low-emissivity and NIR shielding property by a water controlled-release process[J].JournalofMaterialsChemistry, 2011, 21(13):5099-5105. [9] Guo C,Yin S,Huang L J,et al.Synthesis of one-dimensional potassium tungsten bronze with excellent near-infrared absorption property[J].AcsAppliedMaterials&Interfaces, 2011,3(7):2794-2799. [10] Chen C J, Chen DH. Preparation and near-infrared photothermal conversion property of cesium tungsten oxide nanoparticles[J].NanoscaleResearchLetters, 2013, 8(1):57. [11] Zhu J A, Wang S L, Xie S H, et al. Hexagonal single crystal growth of WO3nanorods along a [110] axis with enhanced adsorption capacity[J].ChemicalCommunications, 2011, 47(15):4403-4405. [12] Liu B X, Wang J S, Wu J S, et al. Controlled fabrication of hierarchical WO3hydrates with excellent adsorption performance[J].JournalofMaterialsChemistryA, 2014, 2(6):1947-1954. [13] Takeda H, Adachi K. Near infrared absorption of tungsten oxide nanoparticle dispersions[J].JournaloftheAmericanCeramicSociety, 2007, 90(12):4059-4061 [14] Choi H G,Jung Y H,Kim D K.Solvothermal synthesis of tungsten oxide nanorod/nanowire/nanosheet[J].JournaloftheAmericanCeramicSociety, 2005, 88(6), 1684-1686. [15] Guo C S,Yin S,Zhang P L,et al.Novel synthesis of homogenous CsxWO3nanorods with excellent NIR shielding properties by a water controlled-release solvothermal process[J].JournalofMaterialsChemistry, 2010, 20(38), 8227-8229. [16] Gu Z,Ma Y,Zhai T,et al.A simple hydrothermal method for the large-scale synthesis of single-crystal potassium tungsten bronze nanowires[J].Chemistry-AEuropeanJournal, 2006, 12(29):7717-7723. [17] Guo J, Dong C, Yang L, et al. A green route for microwave synthesis of sodium tungsten bronzes NaxWO3(0 [18] Santato C,Odziemkowski M,Ulmann M,et al.Crystallographically oriented mesoporous WO3films: synthesis, characterization, and applications[J].JournaloftheAmericanChemicalSociety, 2001,123(43):10639-10649. Hydrothermally Prepared (NH4)xWO3Nanocrystals with Selectively Transmittance and Strong Adsorption Ability DONGLi,XUWen-ai,KANGLi-tao,WEIAi-li (College of Materials Science and Engineering,Taiyuan University of Technology,Taiyuan 030024,China) This article describes a facile hydrothermal synthesis method to prepare (NH4)xWO3nanocrystals with (NH4)10W12O41·5H2O, HCl and N2H4·2HCl as raw materials. Experimental results show that pure hexagonal (NH4)xWO3nanorods with a [001] preferential growth direction could be obtained with HCl concentration below 7.67 mg·mL-1. Higher HCl concentration results in the formation of WO3·H2O (9.86 mg·mL-1) and (NH4)10W12O41(12.05 mg·mL-1). The (NH4)xWO3nanocrystals exhibit excellent adsorption ability for methylene blue (MB), a typical organic dye. Importantly, the adsorbed dye could be simply removed after heating in air. The heated nanocrystals exhibits still good adsorption ability for MB in aqueous solution. hydrothermal;tungsten bronze;spectrum-selectivity;adsorption 国家自然科学基金(51502194);山西省青年科技研究基金 (2014021019-4) 董丽(1989-),女,硕士研究生.主要从事纳米材料的制备工作. 康利涛,讲师. TB383 A 1001-1625(2016)07-2029-062 实 验
3 结果与讨论


4 结 论
