土壤宏基因组中芽孢杆菌信号肽的克隆及分析
2016-10-14唐国鑫陈宁
唐国鑫,陈宁
(1.天津科技大学生物工程学院,天津300457;2.中国科学院天津工业生物技术研究所,天津300308)
土壤宏基因组中芽孢杆菌信号肽的克隆及分析
唐国鑫1,2,陈宁1*
(1.天津科技大学生物工程学院,天津300457;2.中国科学院天津工业生物技术研究所,天津300308)
从土壤宏基因组中筛选获得在芽孢杆菌中高效分泌重组蛋白的信号肽。通过数据分析,将预测到的信号肽DNA片段与蛋白酶基因融合,在枯草芽孢杆菌(Bacillus subtilis)WB800和地衣芽孢杆菌(Bacillus licheniformis)DL6中表达,进行胞外蛋白酶酶活测定。筛选得到25个可能来源于G+菌的信号肽序列,胞外蛋白酶活性分析的结果显示,有14个信号肽具有较好的分泌蛋白酶的能力,其中引导效果最好的信号肽(sig20)是蛋白酶自身信号肽的1.64倍。将高分泌信号肽转化到地衣芽孢杆菌中,证实其在地衣芽孢杆菌同样具有较好的引导效果。应用生物信息学与宏基因组学相结合的方法,可有效获得高效的芽孢杆菌信号肽序列,为蛋白质高效分泌表达系统的构建提供丰富的表达元件。
宏基因组;信号肽;芽孢杆菌;蛋白酶
众所周知,芽孢杆菌被作为工业中外源蛋白表达的优良宿主。它们的发酵成本相对低廉[1]。其中的枯草芽孢杆菌和地衣芽孢杆菌已通过美国食品药物管理局一般认为安全(generallyreeonized as safe,GRAS)认证[2-3]。同时,芽孢杆菌可直接将表达产物分泌到培养基中[4],简化了目的产物的提取和纯化过程。有相关报道,芽孢杆菌分泌外源目标蛋白最高可达到20~25 g/L[5]。
信号肽是一段通常位于分泌蛋白的新生肽链N端的氨基酸序列,并将新生的肽链引导到细胞特定的部位。信号肽一般含15~45个氨基酸残基[6],一般分为三个区域:带正电的N端,含有碱性氨基酸,可与细胞膜上的易位蛋白和带负电的磷脂相互作用[7-8];中间为疏水的H区,含大量疏水氨基酸;C端为加工区,含小分子的氨基酸,是信号肽的切割位点[9-10],信号肽酶识别出信号肽C端的切割位点,将信号肽从成熟蛋白上切除[11]。
筛选高效信号肽是提高蛋白质分泌量的一个有效手段。BROCKNEIER U等[12]筛选到了对角质酶分泌引导效率不同的信号肽;DEGERING C等[13]通过筛选,获得了7个枯草芽孢杆菌蛋白酶(BPN′)的野生型信号肽引导效率高的信号肽。范鑫[14]通过筛选24个枯草芽孢杆菌信号肽,其中最好的信号肽YnfF使木聚糖酶的胞外酶活达到37.2 U/mL。
宏基因组是由HANDELSMAN J等[15]于1998年首次提出的概念。其定义为自然环境获得的样品中所有微生物基因组的总和。自然环境中超过99%的微生物不能通过传统的方式培养,这极大的限制了人们认识和了解微生物[16]。宏基因组学以环境中全部微生物的脱氧核糖核酸(deoxyribose nucleic acid,DNA)作为研究对象。相对于传统的筛菌方法获得的微生物基因资源,宏基因组学避免了微生物分离培养的难题,极大的拓展了对微生物资源的利用[17-19]。
本研究通过生物信息学的方法从宏基因组数据中获得信号肽,在枯草芽孢杆菌(B.subtilis)WB800得到有效的表达和分泌,进一步对5条胞外蛋白酶活性较好的信号肽在地衣芽孢杆菌中进行了验证,并对这些信号肽进行了结构解析,为蛋白高效分泌表达体系的构建奠定了较好的基础。
1 材料与方法
1.1材料与试剂
1.1.1菌株和质粒
大肠杆菌(Escherichia coli)DH5α、枯草芽孢杆菌(Bacillus subtilis)WB800、地衣芽孢杆菌(Bacillus lincheniformis)DL6:本实验室保存菌种;大肠杆菌-枯草杆菌穿梭质粒pHT43:本实验室保存;重组质粒pBE980B-pro(含有由芽孢杆菌组成型启动子P43控制表达的芽孢杆菌碱性蛋白酶基因(pro,GenBank:AR691047),自身携带有一个野生型Pro309信号肽):本实验室构建[20]。
1.1.2试剂及样品
限制性内切酶、T4 DNA连接酶:美国Thermo公司;高保真DNA聚合酶Cobuddy、质粒小提试剂盒、DNA凝胶回收试剂盒:北京康为世纪生物科技有限公司;脱氧核糖核苷三磷酸(deoxy-riborucleo side triphosphate,dNTP)、三磷酸腺苷(adenosine triphosphate,ATP)和氨苄青霉素、卡那霉素、氯霉素等抗生素:北京Solarbio公司;酪蛋白:美国Sigma公司。其他化学试剂均为国产分析纯。
宏基因组来源于天津大港冬季的碱性土壤,土壤宏基因组DNA的提取和纯化采用美国OMEGA土壤DNA提取试剂盒完成,宏基因组DNA序列测定和拼接由苏州金维智公司完成。聚合酶链式反式(polymerase chain reaction,PCR)引物合成和DNA测序均由北京华大基因和苏州金维智公司完成。
1.1.3培养基和溶液
固体LB培养基:5 g/L酵母粉、10 g/L氯化钠、10 g/L蛋白胨、15 g/L琼脂粉,LB牛奶平板添加1%脱脂奶粉用于枯草芽孢杆菌胞外分泌的蛋白酶水解圈分析。
芽孢杆菌电转化复苏培养基为包含0.5 mol/L的山梨醇和0.38 mol/L的甘露醇的LB培养基。
2%酪蛋白溶液:酪蛋白溶于pH9.0甘氨酸-氢氧化钠缓冲液(0.05 mol/L)中,用于测蛋白酶酶活。0.4 mol/L三氯乙酸用于终止蛋白酶反应。
1.2仪器与设备
SPX-150B-Z型生化培养箱、SKY-2111B恒温摇床:上海博迅实业有限公司;ECM399电击仪:美国HarvardApparatus公司;Epoth 2TC酶标仪:美国BioTek公司;紫外酶标板:德国GreinerBio-OneGmbH公司。
1.3试验方法
1.3.1信号肽筛选载体的构建
设计引物up-promoter(5′-CTCGTCAAACATCACCC TCTT-3′)和down-MC(5′-CTTGGAATTGTGCTGAAG CT-3′),以pBE980B-pro质粒为模板,扩增获得包含pro基因完整表达盒的片段。PCR程序为:预变性98℃,3 min;扩增:95℃,20s,52℃,20s,72℃,45s,30个循环;补齐:72℃,10min。将PCR产物纯化后与经过SmaⅠ-NheⅠ双酶切并平端化处理的pHT43载体部分连接,获得了重组质粒pHT43-pro,该质粒去除了原质粒上由异丙基-β-d-硫代半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)诱导的外源基因表达片段,可组成型表达芽孢杆菌蛋白酶。
再设计引物mPro 5′-GCTAAGGATCCGCTGAAGAA GCAAAAGAAAAATA-3′(下划线处为BamHⅠ酶切位点),以pHT43-pro质粒为模板,down-MC为下游引物,扩增出不含信号肽的蛋白酶成熟肽基因片段,PCR程序与前文一致。用BamHⅠ和PstⅠ切下蛋白酶基因,同样的酶切下pHT43-pro的pHT43载体部分,连接后得到重组质粒,命名为pHT43-mpro(mpro为不含信号肽的芽孢杆菌蛋白酶成熟肽基因片段),该质粒用于不同信号肽的筛选。土壤宏基因组预测获得的信号肽DNA序列分别与蛋白酶基因进行融合,获得含有不同信号肽的重组质粒pHT43-SP-mpro。
1.3.2枯草芽孢杆菌和地衣芽孢杆菌的转化及初筛
枯草芽孢杆菌和地衣芽孢杆菌的转化均采用相同的电击转化的方式,取5~10 μL(约500 ng)质粒与100 μL B.subtilisWB800感受态细孢混合,放入预冷的2 mm电击杯中,冰浴2 min后取出,置于电击仪中,用1 750 V的电压电击,电击后立刻加入1 mL复苏培养基,37℃、220 r/min复苏培养3 h,涂布于含有10 μg/mL氯霉素和1%脱脂奶粉的LB平板,37℃过夜培养,观察菌落和水解圈。通过测定蛋白水解圈大小与菌落直径的比值,进行初筛。
1.3.3蛋白酶酶活测定
配制不同质量浓度的酪氨酸溶液,读取其在波长280nm下的吸光度值,以酪氨酸质量浓度为纵坐标,以波长280nm下的吸光度值为横坐标,绘制标准曲线[21]。结果显示酪氨酸质量浓度在0~400 μg/mL范围内具有很好的线性关系,R2为0.999。酶活定义为在50℃、pH 9.0条件下,每分钟蛋白酶水解酪蛋白产生1 μg的酪氨酸为一个酶活单位(U)[21],酶活计算公式如下:

式中:X—酶活,U;269.8—标准曲线的斜率;Y—OD280nm;2.266—截距;4—稀释倍数,即1 mL反应体系里实际只含1/4毫升上清液;10—反应时间,min。
将重组B.subtilisWB800在37℃,220 r/min培养24 h的培养液以12000r/min离心1min沉淀菌体,取250 μL上清液在50℃水浴中温浴2 min后,加入pH 9.0的2%酪蛋白溶液250 μL,50℃保温10 min,立刻加入500 μL浓度为0.4 mol/L三氯乙酸终止反应,12 000 r/min离心10 min,取200 μL上清液于酶标仪中测定OD280nm。
2 结果与分析
2.1宏基因组信号肽数据库的建立
土壤宏基因组DNA的抽提、纯化依照说明书的方法进行,最终获得的DNA纯度A260nm/A280nm为1.87,质量浓度228.8 ng/μL,符合宏基因组DNA测序的要求,并由苏州金维智公司进行了高通量测序和初步的拼接注释。结果表明该测序具有较好的质量。通过数据拼接,获得了37 284个大于500 bp的片段,初步比对获得了70 072个可能的基因。利用在线蛋白数据库(http://www.ebi.ac.uk/interpro/)分析,并结合在线信号肽预测工具SignalP 4.1 Server(http://www. cbs.dtu.dk/services/SignalP/),最终获得了398个可能含有信号肽序列的新基因(与Genbank数据比对,全肽序列的同源性≤90%),构建了含信号肽序列的基因数据库(数据未显示)。再根据蛋白的同源性关系,筛选了其中可能来源于G+菌的含有可能的分泌性信号肽的新基因34个,对这些基因N端编码的70个AA用SignalP 4.1 Server进行分析,获得了可能的信号肽序列和信号肽酶的切割位点,将这些信号肽序列在信号肽数据库(http://www.signalpeptide.com/)中进行比对分析,结果发现预测的信号肽均为新的信号肽序列,其序列被用于在芽孢杆菌中进行外源蛋白的分泌表达分析。
2.2信号肽的初筛

图1 不同信号肽-蛋白酶产生的水解圈Fig.1 Hydrolyzed circles of different signal peptides-protease
将不同的信号肽插入到信号肽筛选载体pHT43-mpro的BamHⅠ位点处,与芽孢杆菌碱性蛋白酶基因pro融合,成功构建了25个信号肽重组质粒,获得的重组质粒电转化到B.subtilisWB800中,进行初筛。根据水解圈与菌落比值大小并与含野生型信号肽质粒pHT43-pro的重组菌株进行对比,结果见图1(未完全列出),将不同水平的信号肽分成了四组:高分泌组包括sig8、sig12、sig13、sig20、sig27、sig34;中等分泌组包括sig18、sig24、sig26、sig28、sig30、sig31、sig37、sig40;低分泌组包括sig15、sig21、sig29、sig32、sig36、sig41,差分泌组包括sig17、sig22、sig35、sig38、sig39。其中高分泌组的水解圈比值高于野生型,中等分泌组的水解圈比值与野生型相当,差分泌组的水解圈很小,有的甚至难以测定。
2.3胞外分泌蛋白酶活性定量分析
挑取出高分泌组和中等分泌组的B.subtilisWB800重组菌株,接种于2 mL含氯霉素10 μg/mL的LB培养基中,37℃,220 r/min过夜培养,将该种子液按2%接种量接种于5 mL含氯霉素10 μg/mL的LB培养基的大试管中,37℃,220 r/min继续震荡培养24 h,离心后去除菌体,取上清液测定蛋白酶的活性。以同样培养条件的含pHT43-pro质粒的B.subtilisWB800为阳性对照,含pHT43-mpro质粒的B.subtilisWB800为阴性对照(该菌株丧失了胞外分泌蛋白酶的能力),测定其相对酶活,即扣除阴性对照后的酶活。对比分析含不同信号肽的重组菌株的蛋白酶的胞外分泌能力,将不同信号肽引导的蛋白酶胞外酶活与Pro309信号肽进行比较,结果见表1。每个菌株做5个平行试验。
同时,利用SignalP4.1Server信号肽分析工具对这25个预测的信号肽以及Pro309信号肽进行分析,从肽链长度、D值(D值对区分是否为分泌蛋白具有重要作用)、N端正电荷数(根据预测结果对N区的划分,统计N区氨基酸携带的净正电荷数)和信号肽的疏水百分比(疏水氨基酸数量占信号肽总氨基酸数量的百分比)这四个方面进行对比,按胞外酶活排序,结果见表1。
表1结果显示初筛的14个信号肽,可在枯草芽孢杆菌中有效的表达分泌芽孢杆菌碱性蛋白酶。高分泌组的胞外蛋白酶活性是野生型的1.4倍以上,其中含有信号肽sig20(氨基酸序列:MKRLISTLLIGILLTASAPSAFAKPD)的重组菌株的胞外蛋白酶的活性是野生型的1.64倍;中等分泌组的胞外蛋白酶活性是野生型的0.8~1.4倍,这一结果与水解圈法得到的结果基本一致。
这26个信号肽长度大多在24~36个氨基酸,平均长度为28.3,长度分布比较随机。统计得出引导效率最高的前11个信号肽(野生型信号肽Pro309以及效率高于野生型的信号肽)平均D值为0.694,最差的后15个信号肽(效率低于野生型信号肽)平均D值为0.552。推测D值越高,胞外酶活越高,但这并不是绝对的,如排名第5的sig34的D值只有0.525,而排名第18的sig15的D值却达到0.851。从表中可以发现,N区正电荷数在2~4的时候,信号肽倾向于效率较好。有的信号肽,如sig34和sig21却并不遵循这个规律。信号肽的疏水比例则与信号肽是否能成功插入细胞膜有关,然而,统计发现这26个信号肽的疏水比例大多在50%~70%随机分布。

表1 不同信号肽与野生型信号肽引导效率的比值Table 1 Guide efficiency ratio of different signal peptides and wild-type signal peptide
2.4高分泌信号肽在地衣芽孢杆菌中的表达
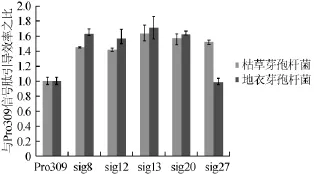
图2 含不同信号肽的重组菌株的相对胞外蛋白酶酶活Fig.2 Relative extracellular protease activity in recombinant strain containing different signal peptides
将含高分泌组信号肽(sig8、sig12、sig13、sig20、sig27)的重组质粒转化到B.lincheniformisDL6中,筛选出阳性克隆,用与B.subtilisWB800同样的方法培养和测定上清液中的蛋白酶活性。结果发现,在地衣芽孢杆菌中,与野生型信号肽Pro309相比,除sig27外(sig27在枯草芽孢杆菌和地衣芽孢杆菌中的蛋白酶分泌量分别是野生型信号肽的1.52倍和0.98倍),其余几个信号肽的相对胞外蛋白酶活性与在B.subtilisWB800中相似,结果见图2。由图2可知,这些信号肽在地衣芽孢杆菌中也可以有效地引导分泌蛋白酶。
3 结论
本研究应用生物信息学和宏基因组学相结合的方法,从土壤宏基因组中筛选出25个信号肽并成功在枯草芽孢杆菌中得到了分泌表达,其中最好的信号肽sig20对蛋白酶的分泌表达是蛋白酶野生型信号肽的1.64倍。此外,将部分信号肽应用于地衣芽孢杆菌,也得到了较好的效果。结果表明,从宏基因组中获得信号肽来提高蛋白的分泌水平是一种行之有效的办法。
通过分析信号肽的长度、D值、N端正电荷数和信号肽的疏水百分比,试图找出信号肽分泌效率的规律,预测影响信号肽强弱的关键结构和位点。然而,这些因素与信号肽的强弱之间并没有明显的或者绝对的规律,并不能覆盖影响信号肽功能的所有因素,说明宿主对信号肽的识别和蛋白的分泌是非常复杂的。因此,构建高效的信号肽筛选和评价体系对于获得高效信号肽的是十分重要的。本研究筛选到的新的信号肽,为在芽孢杆菌中高效分泌表达目标蛋白提供了新的信号肽资源和表达元件。
[1]FU L L,XU Z R,LI W F,et al.Protein secretion pathways in Bacillus subtilis:implication for optimization of heterologous protein secretion[J].Biotechnol Adv,2007,25:1-12.
[2]陈向东.枯草芽孢杆菌作为生防制剂在农业上的应用[J].微生物学通报,2013,40(7):1323-1324.
[3]王光强.枯草芽孢杆菌中Sec分泌途径底物特性及非经典分泌途径的研究[D].无锡:江南大学,2013.
[4]王培立,王平,田健,等.芽孢杆菌高效分泌表达异源蛋白的研究进展[J].生物技术进展,2015(2):95-102.
[5]SCHALLMEY M,SINGH A,WARD O.Developments in the use of Bacillus species for industrial production[J].Can J Microbiol,2004,50:1-17.
[6]CHOO K H,RANGANATHAN S.Flanking signal and mature peptide residues influence signal peptide cleavage[J].BMC Bioinformatics,2008,9(Suppl 12):S15.
[7]ISMAIL N F,HAMDAN S,MAHADI N M,et al.A mutant L-asparaginase II signal peptide improves the secretion of recombinant cyclodextrin glucanotransferase and the viability ofEscherichia coli[J].Biotechnol Lett,2011,33:999-1005.
[8]DEUERLING E,MOGK A,RICHTER C,et al.The ftsH gene ofBacillussubtilisis involved in major cellular processes such as sporulation,stress adaptation and secretion[J].Mol Microbiol,1997,23(5):921-933.
[9]JONET M A,MAHADI N M,MURAD A M A,et al.Optimization of a heterologous signal peptide by site-directed mutagenesis for improved secretion of recombinant proteins inEscherichia coli[J].J Mol Microbiol Biotechnol,2012,22:48-58.
[10]SHENG C,BIN L,RUOYU H,et al.The number of signal peptide cleavage site is critical for extracellular production of recombinant Thermobifidafuscacutinase[J].Process Biochem,2011,46:1867-1870.[11]TJALSMA H,BOLHUIS A,JONGBLOED J,et al.Signal peptide-dependent protein transport inBacillus subtilis:a genome-based survey of the secretome[J].Microbiol Mol Biol R,2000,64(3):515-547.
[12]BROCKMEIER U,CASPERS M,FREUDL R,et al.Systematic screening of all signal peptides fromBacillus subtilis:a powerful strategy in optimizing heterologous protein secretion in gram-positive bacteria[J]. J Mol Cell Biol,2006,362(3):393-402.
[13]DEGERING C,EGGERT T,PULS M,et al.Optimization of protease secretion inBacillus subtilisandBacillus licheniformisby screening of homologous and heterologous signal peptides[J].Appl Environ Microbiol,2010,76(19):6370.
[14]范鑫.外源木聚糖酶在枯草芽孢杆菌中信号肽筛选[D].杨凌:西北农林科技大学,2011.
[15]HANDELSMAN J,RONDON M R,BRADY S F,et al.Molecular biological access to the chemistry of unknown soil microbes:a new frontier for natural products[J].Chemistry and Biology,1998,5(10):R245-R249.
[16]张冰,崔岱宗,赵敏.宏基因组学技术及其在微生物学研究中的应用[J].黑龙江医药,2014,27(2):267-271.
[17]王光龙.利用功能宏基因组技术对北极、大西洋海底沉积物中的新型蛋白酶、酯酶进行筛选、鉴定和性质研究[D].济南:山东大学,2014.
[18]斯日古楞,特木仑,明亮,等.宏基因组学及其应用前景[J].中国畜牧兽医,2014,41(3):115-118.
[19]于雷,于丽,张薇,等.宏基因组技术及其在酶制剂中的应用[J].食品科学,2013,34(9):404-407.
[20]甄杰,胡政,李树芳,等.一个新型耐热普鲁兰酶的结构与功能[J].生物工程学报,2014,30(1):119-128.
[21]胡政.碱性蛋白酶菌株的选育及其酶学性质的研究与应用[D].天津:中国科学院天津工业生物技术研究所,2014.
TANG Guoxin1,2,CHEN Ning1*
(1.College of Biotechnology,Tianjin University of Science and Technology,Tianjin 300457,China;2.Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
Signal peptide,efficiently secreting recombinant proteins inBacillussp.was obtained from soil metagenome.After database analysis,the predicted signal peptide DNA fragment was fused with a protease gene,and then expressed inBacillus subtilisWB800 andBacillus licheniformis DL6 to measure the extracellular protease activity.Totally 25 signal peptide sequences which may derived from G+bacteria were screened,extracellular protease activity results showed that there were 14 signal peptides had excellent ability of secreting protease.One of the signal peptides,named sig20,was 1.64 times of its own protease signal peptide,which performed the optimal secretion ability.The high secretion signal peptides were transformed intoB.licheniformisand the results confirmed the similar secretion ability inB.subtilis.By combining bioinformatics and metagenomics methods,effectively Bacillus signal peptipe sequence could be obtained,which provided a rich expression elements for expression and secretion of recombinant proteins.
metagenome;signal peptide;Bacillus;protease
0254-5071(2016)06-0138-05
10.11882/j.issn.0254-5071.2016.06.029

2016-01-15
国家高技术研究发展计划‘863计划’项目(2014AA021303,2014AA021302);天津市应用基础与前沿科学研究计划(13JCYBJC39500)
唐国鑫(1991-),男,硕士研究生,研究方向为芽孢杆菌信号肽的筛选与改造。
陈宁(1963-),男,教授,博士,研究方向为氨基酸与有机酸发酵。
