一株凡纳滨对虾源鳗弧菌群体感应信号分子的检测
2016-10-13潘玉荣张彩丽朱素芹孙秀娇曾名湧
潘玉荣 张彩丽 朱素芹 孙秀娇 曾名湧
(中国海洋大学食品科学与工程学院,青岛 266003)
一株凡纳滨对虾源鳗弧菌群体感应信号分子的检测
潘玉荣 张彩丽 朱素芹 孙秀娇 曾名湧
(中国海洋大学食品科学与工程学院,青岛 266003)
旨在检测从凡纳滨对虾体内选取的一株鳗弧菌的群体感应信号分子。利用报告菌株结合薄层层析法鉴定鳗弧菌(Vibrio anguillarum,VA)分泌的高丝氨酸内酯类(AHLs)信号分子,利用哈维氏弧菌V. harveyi JMH597 和 V. harveyi JAF375作为报告菌株分别检测了VA分泌的AI-2和CAI-1信号分子活性与细菌密度的关系。结果表明,VA能分泌3种类型的信号分子:AHLs信号分子、AI-2信号分子和CAI-1信号分子,其中分泌的AHLs有N-3-羟基-己酰基-高丝氨酸内酯(3-OH-C6-HSL)、N-3-辛酰基-高丝氨酸内酯(C8-HSL)和N-3-氧代-辛酰基-高丝氨酸内酯(3-oxo-C8-HSL)。VA分泌的AHLs、AI-2和CAI-1均具有密度依赖性。
鳗弧菌;群体感应;AHLs信号分子;AI-2 类信号分子;CAI-1 类信号分子
群体感应[1](Quorum sensing,QS)是指细菌能自发产生、释放一些特定的信号分子,细菌通过感知其浓度变化来调节群体行为的现象。这种特定的信号分子又称为自身诱导物(autoinducer,AI),随细菌密度的增加而增加,当自诱导物浓度达到一定阈值时能启动细菌中特定基因的表达来调控细菌的生物行为,如毒素、抗生素和胞外酶的产生,群集运动,生物膜形成和生物发光等[2]。QS系统由自诱导物分泌蛋白,感受蛋白及下游调控蛋白组成。目前已报道的信号分子主要有:革兰氏阴性菌(G-),一般利用酰基高丝氨酸内酯类信号分子(Acyl-homoserine lactones,AHLs);革兰氏阳性菌(G+),一般利用寡肽类信号分子(Autoinducing peptides,AIPs);还有一类是存在于G+菌与 G-菌中作为种间交流的信号分子——呋喃酰硼酸二酯(Autoinducer-2,AI-2)[3]。
鳗弧菌为有鞭毛的革兰氏阴性细菌,无荚膜,不形成芽孢,能运动,具有典型的弧菌属细菌特征。当水产养殖动物在不良环境条件下遭遇不利刺激或受伤时,会诱发疾病的产生。鳗弧菌引起的水产养殖动物疾病在世界范围内流行,可感染鱼虾贝等。随着研究的深入,已发现群体感应系统与微生物致病性有着密切的联系,群体感应系统不仅调控病原菌致病初期阶段的侵袭定殖以及毒力基因的表达,还调控其耐药性的产生,这就为人们提供了一种病原菌防控新思路——从干扰密度感应系统入手预防和治疗微生物疾病。因此,研究水产品中鳗弧菌群体感应可以为水产养殖疾病的防治以及开发鳗弧菌病防治药物提供理论指导。
本研究从凡纳滨对虾体内选取一株鳗弧菌VA,利用群体感应报告菌株紫色杆菌(Chromobacterium violaceum)CV026和根癌农杆菌(Agrobacterium tumefaciens)A136(pCF218)(pCF372),以及哈维氏弧菌V. harveyi JMH597和V. harveyi JAF375,检测和研究其群体感应信号分子类型及其与细菌密度间的关系,旨为今后通过鳗弧菌群体感应系统调控其致病性提供基础实验数据。
1 材料与方法
1.1 材料
1.1.1 菌株、培养基与培养条件 本研究中使用的菌株质粒如表1所示。所有菌株均保存于30% 甘油中,置于 -20℃下冻藏。使用前,将储存的菌液按 1∶100 的比例接种于对应的液体培养基过夜活化。其中哈维氏弧菌使用AB培养基,根癌农杆菌(Agrobacterium tumefaciens,A136)和紫色杆菌(Chromobacterium violaceum,CV026)使用LB培养基,其中CV026 可检测碳链长度从C4-C8的AHLs,而A136可检测碳链长度为C4-C14和3-oxo-C4-3-oxo-C12的AHLs。CV026 和 A136 本身均不产生 AHLs,当存在外源 AHLs 时,紫色杆菌 CV026 将产生紫色杆菌素;A136表达 lacZ基因,分解X-gal产生蓝色。鳗弧菌使用 2216E培养基,A136体系需加入终浓度50 mg/L壮观霉素和终浓度4.5 mg/L 四环素;CV026体系需加入终浓度20 mg/L卡那霉素。所有菌株的培养条件均为温度30℃、摇速160 r/min。细菌生长密度用OD600表示。

表1 供试菌株和特征
1.1.2 主要试剂和仪器 壮观霉素、四环素、卡那霉素、AHLs标准品(C6-HSL、C8-HSL、N-3-oxo-C6-HSL、N-3-oxo-C8-HSL)等均购自Sigma公司(美国);X-gal(5-溴-4-氯-3-吲哚-β-D-半乳糖苷)购自Solarbio公司;RP-C18 F254s反相薄层板购自德国Merck公司;菌株的荧光强度用荧光酶标仪(Bio-tek,Vermont,USA)测定。
1.1.3 培养基 AB培养基配方:0.3 mol/L NaCl,0.05 mol/L MgSO4,0.2%酪蛋白氨基酸,用1 mol/L KOH调至pH为7,121℃灭菌30 min备用。100 mL母液加入2 mL 50%无菌甘油,1 mL 1 mol/L无菌PBS(pH=7),1 mL 0.1 mol/L灭菌L-精氨酸。
1.2 群体感应AHLs信号分子的检测
1.2.1 粗提液的制备 将VA接种在2216E液体培养基中,30℃、160 r/min培养过夜,取100 mL菌液,离心取上清,用含 0.5%甲酸的乙酸乙酯萃取3次,混合有机相,旋蒸至干,溶于二甲亚砜,-20℃保存备用。
1.2.2 平板划线法检测AHLs 按照文献[10]的方法,采用平行划线法,以报告菌株本身作阴性对照,C6-HSL作为A136阳性对照,紫色杆菌31532作为CV026阳性对照。30℃培养过夜,观察颜色变化。
1.2.3 TLC-biosensor检测AHLs 根据文献[11]将1 μL AHLs提取物与信号分子标准品分别点样于C18反相薄层层析板上,以甲醇/水(3∶2,体积比)为展开剂展开,无菌风吹干。将A136报告菌株菌液与含0.7%琼脂的LB混合均匀,低于42℃铺于TLC板上,凝固。30℃ 密闭容器中培养24-48 h,观察颜色变化。AHLs经薄层层析展开后,A136会在AHLs存在的区域水解X-gal呈现蓝色斑点。根据斑点位置以及形状,分析AHLs的类型。
1.2.4 鳗弧菌AI-2类信号分子的检测 AI-2型信号分子的检测方法参考文献[11],V. harveyi JMH597培养过夜至OD600约为1.0,用新鲜的AB培养基按1∶3 000比例稀释菌液,28℃孵育2 h。在96孔黑色酶标板中加入20 μL不同时间段VA无菌上清液和180 μL JMH597的稀释液,每个样品重复4次,28℃静止培养3 h,用荧光酶标仪检测其于460 nm波长处的荧光值,每隔15 min测一次,直至AB培养基对照到达最低。其中以0 h无菌上清和BB152的无菌上清液分别为空白对照和阳性对照,AB培养基作对照菌株的空白对照。AI-2信号分子相对强度(%)=(样品上清的荧光值/阳性对照的荧光值)×100%,以阳性对照的荧光值作为100%。
1.2.5 鳗弧菌CAI-1类信号分子的检测 CAI-1类信号分子的检测条件参考文献[12]略做改动,活化好的V. harveyi JAF375培养过夜达到OD600约为1.0,按1∶10 000的比例稀释到新鲜AB培养基。在96孔酶标板中加入100 μL不同时间段的鳗弧菌VA无菌上清液和100 μL稀释后的报告菌液,30℃培养4 h。用荧光酶标仪检测其460 nm处荧光值,每隔15 min测一次,直到AB培养基值达到最小。其中E. coli DH5α和V. harveyi BB120培养于LB肉汤制备的无菌上清液分别为阴性和阳性对照,2216E液体培养基和LB肉汤分别作为待检菌株和对照菌株的空白对照。CAI-1信号分子相对强度(%)=(样品上清的荧光值/阳性对照的荧光值)×100%,以阳性对照的荧光值100%。
2 结果
2.1 鳗弧菌VA 的AHLs信号分子的检测
2.1.1 平板划线法 A136能检测较宽范围内的AHLs且具有高灵敏性,CV026只能检测短链AHLs,且需要较高的阈值。利用报告菌株检测VA产生AHLs的结果(图1)显示,VA能诱导A136启动lac Z基因分泌β-半乳糖苷酶水解X-gal使平板变蓝,表明鳗弧菌VA能够分泌AHLs类信号分子,但VA不能诱导报告菌株CV026产生紫色色素,可能由于其产生的信号分子为长链AHLs或者产生的AHLs浓度未达到CV026的检测限。VA自身变蓝是由于VA自身能够分泌β-半乳糖苷酶水解X-gal变蓝。
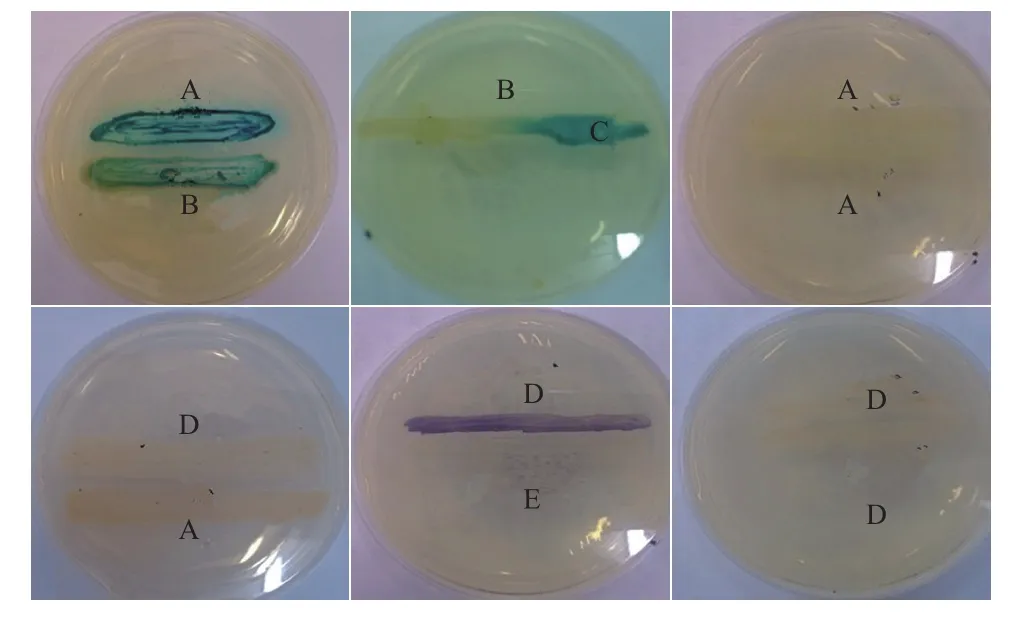
图1 利用根癌农杆菌A136和紫色杆菌CV026检测VA信号分子
2.2.2 薄层层析法检测AHLs类型 利用C18反相薄层层析法对VA产生的AHLs种类进一步研究。结果(图2)显示,VA的AHLs粗提液可以产生3个蓝斑,其中两个分别与标准品C8-HSL、O-C8-HSL相一致,因实验室所存标准品种类有限,另一个没有匹配,从迁移值来看,其比O-C6-HSL大,推测其为极性更大的OH-C6-HSL。
VA不同生长阶段AHLs活性的检测结果(图3)显示,随着培养时间延长,AHLs信号分子活性先升高后降低,在对数生长末期(培养时间为18 h)达到最大值。检测VA培养液pH值发现,随着培养时间的延长,培养液的pH一直保持上升趋势,初始pH值为6.83(3 h,OD600约0.10),最后pH值达到8.92(30 h,OD600约1.0),由于AHLs在碱性条件下容易发生降解,推测进入稳定期后VA的AHLs活性的下降,可能是因为培养液pH的不断升高导致AHLs降解。
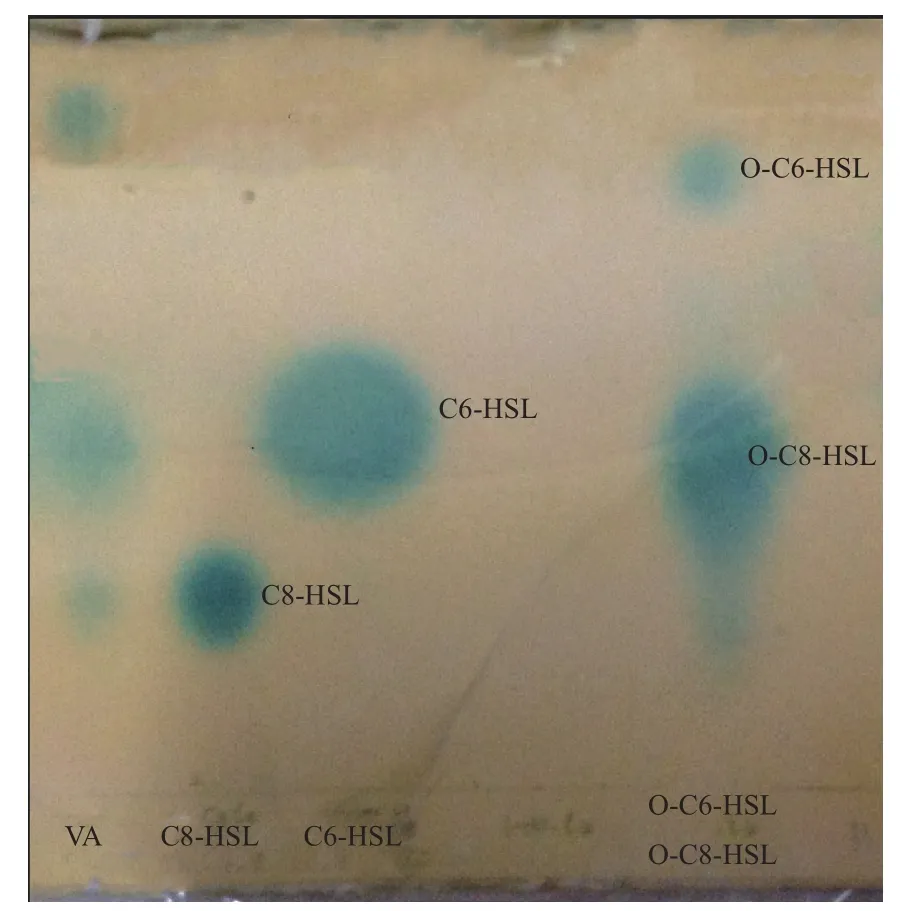
图2 TLC检测VA信号分子的种类

图3 报告平板法检测VA不同时间分泌AHLs活性(A)和 AHLs所诱导变色直径与细菌密度间关系(B)
2.2 鳗弧菌VA的 AI-2信号分子活性随生长变化规律
VA的AI-2信号分子活性随其生长的变化规律如图4所示。该菌的AI-2类信号分子的活性随着生长密度的增加先升高后降低,与空白培养基对照相比,VA在对数前期(6 h,OD600≈0.15)就表现出明显AI-2活性,随后AI-2迅速积累,到对数中期(12 h,OD600≈0.6)时达到最高(约为峰值的83%),随后有所下降,到30 h时其活性仍约为最高值的37%。该结果表明VA分泌的AI-2信号分子活性具有一定的生长密度依赖性。
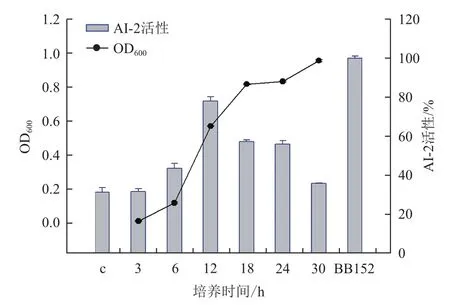
图4 鳗弧菌VA不同生长阶段的AI-2活性
2.3 鳗弧菌VA的CAI-1信号活性变化规律
CAI-1的检测主要根据环境中存在的CAI-1会诱导报告菌株JAF375发光,荧光强度的大小反应CAI-1含量的多少。图5显示,3 h时(OD600约0.1)即显示很高的荧光强度,随后处于波动状态。由于该检测体系中报告菌株与VA无菌上清的比例为1∶1,12 h前发光强度较强源于VA无菌上清中培养基含有的丰富营养物质促进了报告菌株的生长,对检测结果造成一定干扰。12 h后,VA与体系中的营养物质处于平衡状态,荧光强度的变化主要为CAI-1引起,结果显示,VA的CAI-1信号分子活性先升高后降低,最高活性出现在24 h(OD600≈0.9),约为阳性对照的60%,表明VA能够产生CAI-1信号分子。体系中的营养物质对检测过程存在一定干扰,Defoird[13]探索了更改报告菌株和无菌上清的比例来优化实验条件,发现只有在比例1∶1时较合适。
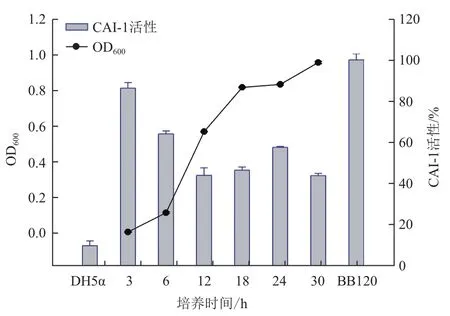
图5 鳗弧菌VA不同生长阶段的CAI-1活性
3 讨论
弧菌病是养殖及野生海水鱼的重要疾病之一,已成为世界流行的一种细菌性病害,给水产养殖业造成了严重的影响和巨大经济损失[14]。已报道的鳗弧菌毒力因子有pJM1铁离子转运系统、脂多糖、生物膜胞外酶等[15]。大量的研究表明,细菌的毒力因子受群体感应系统的调控,因此,对致病菌群体感应信号分子的检测和分析是研究其群体感应系统的基础。
目前,以AHLs介导的革兰氏阴性菌的群感应机制(LuxI/LuxR)已被广泛研究。鳗弧菌中具有与群体感应系统LuxI/R 同源的VanI/R调控系统[16]。不同生长环境下以及不同血清型的鳗弧菌分泌信号分子的类型有所差异,本实验检测了从冷藏的腐败凡纳滨对虾中分离的一株 VA 的群体感应AHLs信号分子,根据Rasmussen等[17]报道鳗弧菌通常情况下不产生C4-HSL和C6-HSL,但是能够产生OH-C6-HSL,因此推测没有匹配的蓝斑为OH-C6-HSL。结果表明该菌能分泌3种AHLs,即OH-C6-HSL、3-oxo-C8-HSL和C8-HSL。对VA的AHLs的动力学研究表明,对数末期之前,菌体浓度与AHLs分泌量呈正相关,而在稳定期以后,随着细菌的衰亡及环境的变化,AHLs处于下降趋势,AHLs在一定范围内具有密度依赖性。
AI-2类信号分子是目前已知的唯一一种在革兰氏阴性菌和革兰氏阳性菌中都存在的群体感应信号分子,被认为是种间交流的信号分子。VA的AI-2信号分子在对数生长初期迅速积累,在对数生长末期达到最高活性水平,进入稳定期后开始有所降低,但仍保持较高的活性水平。已有研究报道哈维氏弧菌明胶酶和卵磷脂酶的产生受AI-2正调控[18],我们前期的研究也发现VA具有较强的蛋白酶、明胶酶和卵磷脂酶分泌能力,在VA中,AI-2对胞外酶的调控关系需要进一步的研究,这也为开发新的AI-2型群体感应抑制剂提供了理论指导。
CAI-1类信号分子分布范围并不广泛,目前仅在弧菌属中发现有CAI-1类信号分子,它被认为是弧菌种间交流的一种信号分子[12]。Milton等[19]报道,大部分鳗弧菌能够产生CAI-1信号分子,但是,目前的研究发现霍乱弧菌的CAI-1类信号分子能够影响线虫的趋化运动,有利于线虫避免有害因素[20]。这纠正了以往人们认为CAI-1信号分子仅限于弧菌种间交流的认识。本研究发现鳗弧菌能够产生CAI-1信号分子,进入稳定期后出现密度依赖性,相对于AI-2,VA分泌CAI-1能力较低。细菌的生理行为和过程是受多种QS系统调控的,QS系统的调控是通过细菌分泌的信号分子来实现的。鳗弧菌VA产生的信号分子对其代谢的调控还需要进一步的研究。本实验结果为研究鳗弧菌致病性与群体感应系统之间的关系奠定了基础,也为开发新的群体感应抑制剂提供了理论指导。
4 结论
本研究鉴定了腐败凡纳滨对虾中鳗弧菌VA分泌的群体感应信号分子类型,即AHLs、AI-2和CAI-1。其中AHLs信号分子有C8-HSL、O-C8-HSL和OH-C6-HSL。以上3种类型的群体感应信号分子均具有密度依赖性。
[1]Miller MB, Bassler BL. Quorum sensing in bacteria[J]. Annu Rev Microbiol, 2001, 55(1):165-199.
[2]March JC, Bentley WE. Quorum sensing and bacterial cross-talk in biotechnology[J]. Curr Opin Biotechnol, 2004, 15(5):495-502.
[3]刘鹏, 张月娟, 赵廷昌. 细菌群体感应系统的研究进展[J].中国农学通报, 2007, 6:467-472.
[4]Bassler BL, Greenberg EP, Stevens AM. Cross-species induction of luminescence in the quorum-sensing bacterium Vibrio harveyi[J]. J Bacteriol, 1997, 179(12):4043-4045.
[5]Henke JM, Bassler BL. Three parallel quorum-sensing systems regulate gene expression in Vibrio harveyi[J]. J Bacteriol, 2004,186(20):6902-6914.
[6]Mok KC, Wingreen NS, Bassler BL. Vibrio harveyi quorum sensing:a coincidence detector for two autoinducers controls gene expression[J]. The EMBO journal, 2003, 22(4):870-881.
[7]Freeman JA, Bassler BL. A genetic analysis of the function of LuxO,a two-component response regulator involved in quorum sensing in Vibrio harveyi[J]. Mol Microbiology, 1999, 31(2):665-677.
[8]Chu W, Vattem DA, Maitin V, et al. Bioassays of quorum sensing compounds using Agrobacterium tumefaciens and Chromobacterium violaceum[M]. Quorum Sensing Humana Press, 2011:3-19.
[9]Henke JM, Bassler BL. Quorum sensing regulates type III secretion in Vibrio harveyi and Vibrio parahaemolyticus[J]. J Bacteriol,2004, 186(12):3794-3805.
[10]孙秀娇, 朱素芹, 张彩丽, 等. 凡纳滨对虾源不动杆菌群体感应信号分子分离鉴定及其调控[J]. 微生物学通报, 2015, 2(42):437-443.
[11] Li X, Han Y, Yang Q, et al. Detection of quorum sensing signal molecules and mutation of luxS gene in Vibrio ichthyoenteri[J]. Res microbiol, 2010, 161(1):51-57.
[12] 杨倩. 弧菌科细菌及鲶鱼爱德华氏菌密度感应系统的研究[D]. 青岛:中国海洋大学, 2011.
[13]Defoirdt T, Verstraete W, Bossier P. Luminescence, virulence and quorum sensing signal production by pathogenic Vibrio campbellii and Vibrio harveyi isolates[J]. Journal of Applied Microbiology,2008, 104(5):1480-1487.
[14]高冬梅, 李健, 王群. 鳗弧菌灭活疫苗对牙鲆免疫效果的研究[J]. 海洋水产研究, 2004, 25(1):486-492.
[15]Crosa JH, Walsh CT. Genetics and assembly line enzymology of siderophorebiosynthesis in bacteria[J]. Microbiol Mol Biol Rev,2002, 66(2):223-249.
[16]Croxatto A, Chalker VJ, Lauritz J, et al. VanT, ahomologue of Vibrio harveyi LuxR, regulates serine, metalloprotease, pigment, and biofilm production in Vibrio anguillarum[J]. J Bacteriol, 2002,184(6):1617-1629.
[17]Rasmussen BB, Nielsen KF, Machado H. Global and phylogenetic distribution of quorum sensing signals, acyl homoserine lactones,in the family of vibrionaceae[J]. Mar Drugs, 2014, 12(11):5527-5546.
[18]白方方, 张晓华. 哈维氏弧菌密度感应系统对几种胞外酶的活性影响[J]. 中国海洋大学学报:自然科学版, 2010, 6:91-95.
[19] Milton DL. Quorum sensing in vibrios:complexity for diversification[J]. Int J Med Microbiol, 2006, 296(2):61-71.
[20] Werner KM, Perez LJ, Ghosh R, et al. Recognizes a bacterial quorum-sensing signal molecule through the AWCON neuron[J]. J Biol Chem, 2014, 289(38):26566-26573.
(责任编辑 马鑫)
Detection of Quorum Sensing Signal Molecules in Vibrio anguillarum Isolated From Litopenaeus vannamei
PAN Yu-rong ZHANG Cai-li ZHU Su-qin SUN Xiu-jiao ZENG Ming-yong
(College of Food Science and Engineering,Ocean University of China,Qingdao 266003)
The aim of the present study was to detect and analyze quorum sensing of Vibrio anguillarum(VA)isolated from spoiled Litopenaeus vannamei. AHLs activities of VA were detected by reporter strains(Chromobacterium violaceum CV026 and Agrobacterium tumefaciens A136)combined with TLC method. Report strains V. harveyi JMH597 and V. harveyi JAF375 were used to detect the activity of AI-2 and CAI-1. The result indicated that AHLs(3-OH-C6-HSL, C8-HSL and 3-oxo-C8-HSL)、AI-2 and CAI-1 were secreted by VA andthe activity of the signal molecules were density-dependent.
Vibrio anguillarum;Quorum sensing;AHLs;AI-2;CAI-1
10.13560/j.cnki.biotech.bull.1985.2016.03.023
2015-03-16
国家自然科学基金项目(31071613)
潘玉荣,女,硕士研究生,研究方向:群体感应抑制剂;E-mail:944193302@qq.com
曾名湧,男,教授,博士生导师,研究方向:水产品高值化利用;E-mail:mingyz@ouc.edu.cn
