H2O2预氧化对BFA复合融雪剂性能的影响及其融雪机理
2016-10-13韩永萍龚平刘红梅周文平贺志福
韩永萍,龚平,刘红梅,周文平,贺志福
H2O2预氧化对BFA复合融雪剂性能的影响及其融雪机理
韩永萍,龚平,刘红梅,周文平,贺志福
(北京联合大学生物工程学院,生物质废弃物资源化利用北京市重点实验室,北京 100023)
针对H2O2预氧化对生化黄腐酸(BFA)钙盐复合物的融雪化冰性能影响及其机理进行了研究。结果表明,在H2O2与BFA质量比为1.5、pH 7.5、35℃的最佳预降解条件下反应120 min,可使BFA钙盐复合物的冰点降低27%。紫外光谱、红外光谱及凝胶色谱分析结果表明,BFA经H2O2氧化降解后,一些复杂的芳香族有机物发生降解甚至开环、不饱和脂肪烃被氧化,产生了大量小分子羧酸、醇、酚及烯烃等有机物。它们在Ca2+的络合作用下形成了小分子聚合物或共聚物,在融雪化冰中起主要作用。增加BFA结构中的COOH、OH和phOH等亲水性基团含量是提高BFA钙盐复合融雪剂性能的关键。
融雪剂;生化黄腐酸;H2O2;降解;融雪化冰性能
引 言
融雪剂已经成为快速除雪、保障北方城市雪天交通的必需手段。氯盐型融雪剂具有融雪效果好、来源广泛、价格低廉等优势,但对路基路面、混凝土和金属具有较强的腐蚀性,并危害植物和土壤环境而亟需被替代[1]。20世纪90年代初,美国对CMA(醋酸钙镁盐)有机融雪剂的开发使用为融雪剂的研究指明了方向[2]。为了降低制备成本,酯、糖、纸浆等生产工业废液及马铃薯、城市垃圾等发酵液被作为有机融雪剂的生产原料进行了广泛研究[3-5]。同时,为了充分利用氯盐的良好融雪效果,将其与醋酸钙镁盐复配或加入偏硅酸钠等缓蚀剂,开发出一系列低氯环保型融雪剂[6-8]。
黄腐酸(FA)是一种以多元醌和多元酚为芳香核芯的高聚物,连接有强亲水性的COOH和OH[9]。生化黄腐酸(BFA)一般由微生物发酵植物秸秆获得,除基本结构外,还含用一定量可降低冰点的糖类、醇类及氨基酸、蛋白质、核苷酸等物质,来源广泛,价格低廉,有改良土壤、刺激作物生长、改善农产品质量等功效[10]。从植物营养、生产成本以及废弃物资源化利用等方面考虑,BFA是一种理想的环保型有机融雪剂原料。但目前将BFA作为融雪剂尚未有报道,各种有机融雪剂的融冰机理也不明确。
本课题组将BFA与钙盐进行复配,其融雪性能、金属腐蚀性及对植物种子相对受害率均接近或满足北京市地方标准中Ⅰ类融雪剂要求。在研制过程中还发现,尽管BFA有较强的吸水性能,但因溶解后溶液黏度较大会影响融雪效果。此外,BFA呈棕黄色,融雪化冰后残留下来的棕色液体会给路面带来不洁的感官。
H2O2在水溶液中可离解成,诱发产生具有极强氧化作用的,对有机物具有很强的氧化降解作用[11]。研究表明,黄腐酸经H2O2氧化后,其中以羧酸、醇、胺、酯为代表的可降低冰点的官能团明显增加[12]。而且,H2O2降解有机物还具有不引入其他杂质的优势,能对一些生色的有机基团进行氧化分解。
为此,本文就H2O2预氧化对BFA钙盐复合融雪剂的性能影响进行了研究。在此基础上,通过对BFA降解前后分子结构表征,初步探讨BFA钙盐复合物的融雪化冰机理,为环境友好、植物营养型的BFA融雪剂开发奠定理论基础。
1 试验材料与方法
1.1 主要原料及试剂
BFA(棕黄色,粒径0.178 mm,有效成分含量>97%,溶解度为45 g·L-1),由江西省萍乡市乐乐腐殖酸厂提供;醋酸钙、氯化钙、H2O2、氯氧化钡、醋酸钡、氢氧化钠、溴化钾、醋酸等试剂均为分析纯,由天津市福晨化学试剂厂提供。
1.2 主要仪器
Yaxin-0232型热电偶测温仪(用于冰点测定),JMD2004型低温恒温反应槽,pHS-3C精密pH计,TU-1810紫外可见分光光度计,FTIR-650 型红外光谱仪,LC-10AD凝胶色谱仪(RID 10A示差检测器、工作站为CLASS-VP,日本岛津公司提供)。
1.3 试验方法
首先称取9 g BFA溶解于123 ml蒸馏水中,加入30% H2O2在设定条件下对BFA进行氧化降解,反应结束后立即将降解液置于0℃±1℃低温恒温箱中0.5 h,取出反应液按质量比BFA:醋酸钙:氯化钙=1:1:1配制成固含量为18%的复合溶液[融雪剂北京市地方标准(DB11T 161—2012)中冰点测定浓度要求]。
1.4 分析检测方法
1.4.1 冰点下降率 按照《发动机冷却液的冰点测定》(SH/T 0090—91),对BFA降解前后配制的钙盐复合溶液进行冰点下降试验,分别测得冰点0和,可得冰点下降率为

1.4.2 BFA的含氧酸性基团测定 总酸性基含量采用氢氧化钡滴定法测定,羧基含量采用醋酸钡滴定法测定,酚羟基等于总酸性基与羧基之差[13]。
1.4.3 BFA氧化降解前后的结构表征 为了进一步研究BFA经H2O2氧化降解后分子结构的改变,以及钙盐的加入对BFA分子存在形态的影响,试验采用紫外分光光度计、红外光谱和凝胶色谱对降解前后的BFA及其钙盐复配物进行分析。
紫外色谱分析:移取氧化降解前后的BFA溶液稀释成3 g·L-1,分别用紫外分光光度计进行全波长扫描。
红外光谱分析:取氧化降解前后的BFA溶液冷冻干燥,再分别与溴化钾混合、研磨、压片,用红外光谱仪在4000~400 cm-1范围内进行扫描分析。
凝胶色谱分析:流动相为0.2 mol·L-1醋酸+ 0.1mol·L-1醋酸钠缓冲液,色谱柱为日本产TSKG4000SW。设定柱温和检测池温度为30℃,流速为1.0 ml·min-1。样品加蒸馏水稀释成3 g·L-1,经0.45 μm过滤器过滤,每次进样20 μl。
2 试验结果与讨论
2.1 H2O2预氧化对BFA钙盐复合融雪剂性能的影响
融雪剂的性能评价指标主要有冰点和化冰速率,鉴于使用差重法测定的化冰速率人为操作误差较大,本研究主要对样品的冰点进行考察。H2O2氧化降解有机物的主要影响因素有H2O2用量、反应时间、反应温度、反应pH及各种催化剂等。本研究旨在通过H2O2预氧化改变BFA的分子结构,而非矿化成CO2和H2O,故不考虑使用催化剂。
2.1.1 H2O2投加量的影响 室温,在H2O2与BFA质量比分别为0.5、1.0、1.5、2.0和2.5条件下进行预氧化时,BFA钙盐复合物的冰点下降率随BFA降解时间变化见图1。

图1 H2O2投加量对BFA钙盐复合物冰点下降的影响
由图1可看出,BFA经H2O2预氧化降解后,其与钙盐复合物的冰点明显下降,且下降率随H2O2用量增加而增大。当系统投加H2O2与黄腐酸的质量比为0.5、降解60 min后,冰点下降了7.45%;在相同的降解时间内,用量比为2.5时冰点下降了20.31%。
BFA经H2O2预氧化降解开始的45 min内,复合物冰点下降率与降解时间几乎呈线性增长。对其进行线性回归处理,得到H2O2用量比为0.5、1.0、1.5、2.0和2.5条件下,复合物冰点下降速率常数分别为0.124、0.178、0.238、0.295和0.539,对应的相关系数2值为0.996、0.978、0.983、0.990和0.996。由此,可将复合物冰点下降随BFA降解时间变化曲线大致分成线性增长(降解45 min内,曲线的线性相关系数2>0.97)、缓慢增长期和持恒期(降解30 min内,冰点下降率变化<2% )3个阶段。其中,H2O2用量比为0.5和1.0体系,持恒期出现在BFA降解120 min左右;用量比为1.5和2.0体系的持恒期约出现在90 min;用量比为2.5体系的持恒期出现在60 min。
可见,H2O2用量越高,反应初期的复合物冰点下降速率常数越大,较短的降解时间内即可实现BFA钙盐复合物冰点的大幅度降低,进入持恒期也越早。
推测为BFA钙盐复合物的冰点下降与BFA氧化效率直接相关。H2O2加入BFA溶液后引发自由基链反应[14],即H2O2首先分解生成,而属于亲核试剂,可继续引发H2O2分解产生,具体反应如下。
鉴于反应进入持恒期后,BFA复合物冰点下降有限,从经济和效率角度考虑,通过H2O2预氧化降低BFA钙盐复合物冰点,H2O2与黄腐酸的最佳质量比为1.5,降解时间为120 min。
2.1.2 反应温度的影响 H2O2与BFA的质量比为1.5、反应时间为120 min,BFA钙盐复合物的冰点下降率随预氧化反应温度的变化见图2。
由图2可知,在低温阶段,H2O2产生的反应速率随着温度升高而增大,BFA钙盐复合物的冰点下降率也随之提高。当温度达到35℃时,复合物冰点降低率达到了最大值26.43%。再进一步提高反应体系温度,H2O2因温度过高分解产生O2而被消耗[16],同时高温也可导致BFA不稳定组分发生降解,进一步被体系中的氧化生成CO2和H2O,致使BFA溶液中融雪化冰的有效成分降低,复合物的冰点几乎不发生变化。
由试验结果初步确定,BFA预氧化降解体系的最适温度为35℃。
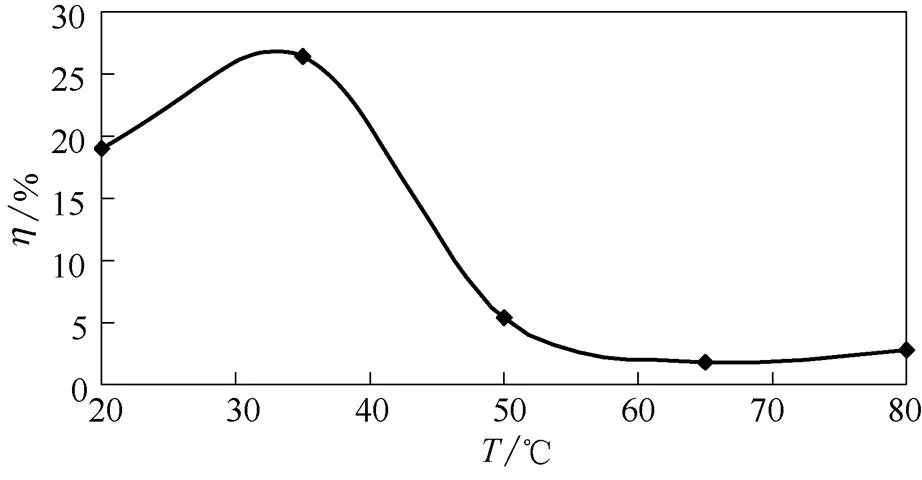
图2 反应温度对BFA钙盐复合物冰点下降率的影响
2.1.3 pH的影响 在H2O2与BFA质量比为1.5、温度为35℃条件下对BFA进行预氧化,BFA钙盐复合物的冰点下降率随预氧化反应体系pH 的变化见图3。

图3 反应体系pH对BFA钙盐复合物冰点下降率的影响
反应体系pH对BFA的氧化降解影响较大。由反应(1)可知,碱性条件有利于生成,进而促进产生。同时,体系pH升高,BFA分子因结构中的COOH等弱酸基团电离为COO-呈负电而相对舒展,降低了攻击位阻效应[17]。图3也表明,BFA预氧化降解体系的pH越高对复合物的冰点下降越有利。当体系pH≥7.5后,尤其在反应初期60 min内,复合物的冰点迅速下降;进一步将pH升高至8.5,复合物的冰点下降有限,至反应达到120 min时,甚至较pH为7.5的降解体系低近2%。分析认为是高pH环境使得体系中在短时间内大量产生而出现累积,进而加速H2O2自身分解所致。
由试验结果确定,BFA预氧化降解体系的最适pH为7.5。
2.2 BFA钙盐复合物的融雪机理研究
2.2.1 BFA钙盐复合物的融冰现象 将BFA与钙盐按比例研磨混匀后涂于冻冰表面。在冰面融化过程中发现,冻冰在融化的同时表层出现了体积膨胀;倾倒出融化和松动的冰水混合物后,可以看出棕色的复合物已经渗入到冰的内部(图4)。说明BFA钙盐复合物除了融冰外,还对冰层有松动作用。推测与BFA结构中富含COOH、OH等亲水基团有关,它们能与H2O分子形成氢键,小分子BFA借此向冰层内部扩散,从而破坏冰层内部H2O分子间的作用力。

图4 BFA钙盐复合物融冰前后的表观现象
2.2.2 BFA降解前后及与钙盐复配物的融雪性能和分子量变化 固含量为6% BFA溶液降解前后、12%钙盐溶液(醋酸钙:氯化钙为1:1)及BFA钙盐复合融雪剂的冰点如图5所示。
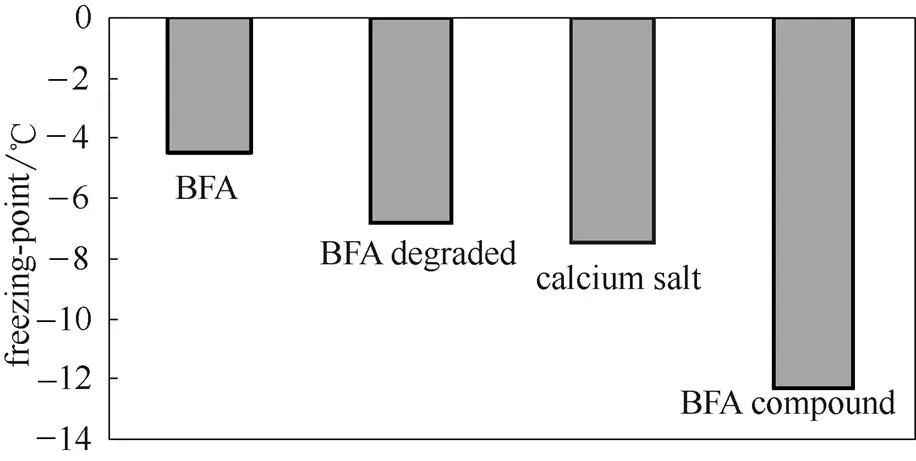
图5 BFA降解前后及与钙盐复配物的融雪性能
由图5可以看出,BFA经H2O2氧化降解后溶液冰点降低了51%,接近质量浓度为其两倍的钙盐溶液;与钙盐复配后冰点进一步下降,达到了-12.6℃,较质量浓度相同的钙盐降低了64%。这说明钙盐的引入明显增加了BFA的融雪性能。
BFA在最适条件下经H2O2氧化降解后再与钙盐进行复配,过程产物经凝胶色谱分析见图6。

图6 BFA降解前后及与钙盐复配物的凝胶色谱图
由图6(a)可以看,BFA经H2O2降解后,9.35 min处的宽大吸收峰消失,且在14.51 min处的吸收峰较13.24 min处增大。由此可见,体系中的优先攻击高分子量的BFA,几乎将其全部转变为小分子。这一点在Sarathy等[18]的研究中也得到证实。降解后BFA与钙盐的复配物出现了分子量分布较为集中的单一吸收峰,由出峰时间13.52 min可推测出其峰值分子量略高于降解后BFA溶液中最小分子量[图6(b)],且浓度增加了近10倍。这一方面说明H2O2并未将BFA彻底矿化成CO2和H2O;另一方面,由于Ca2+能与COOH或OH发生较强的络合作用[19],复合物溶液中的Ca2+将降解产生的各种小分子有机物、甚至无法被本试验条件下检测到的小分子连接在一起,形成分子量更为集中的小分子聚合物。
结合BFA与钙盐复配后融雪性能明显提高的现象,可说明在Ca2+桥键作用下形成的小分子BFA聚合物在融雪化冰过程中起着关键性的作用。
2.2.3 BFA降解前后结构表征 由图7可看出,与BFA相比,降解后BFA紫外色谱图中260 nm左右的吸收峰变小,在310 nm左右出现了新的吸收峰。通常芳环的主要紫外特征吸收峰出现在260 nm左右,而不饱和CO等生色基团的吸收峰在300 nm左右[20]。
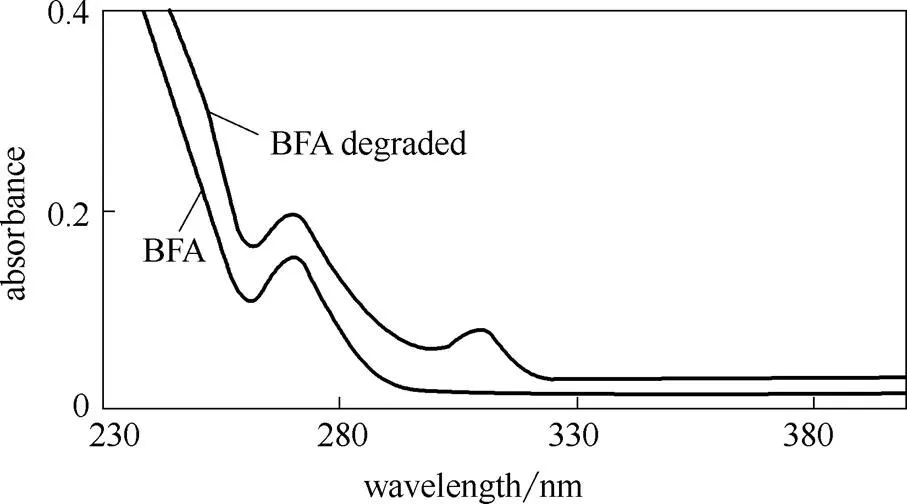
图7 BFA降解前后的紫外色谱图
红外光谱图中,3500 cm-1左右为氢键缔合的OH振动吸收峰,1700 cm-1为羧基和羰基中CO伸缩振动吸收峰,1200 cm-1为酚羟基中CO振动吸收峰。与BFA对比,图8中降解后BFA红外光谱图中的这几处特征吸收峰显著加强。1680~1640 cm-1处的CC特征峰有可能因CO吸收峰过强而被掩盖。而1500~1450 cm-1附近的芳环特征峰和2300 cm-1附近CC特征峰减弱。
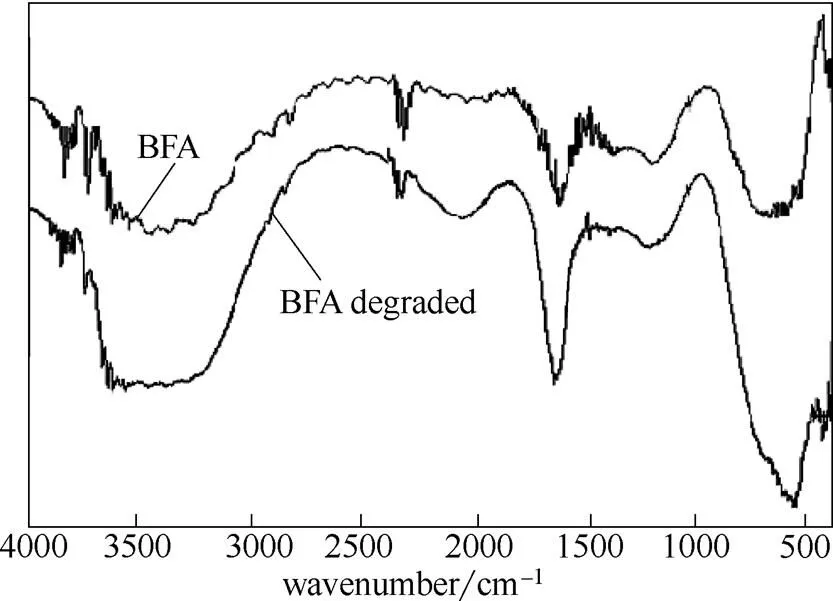
图8 BFA降解前后的红外光谱图
结合紫外色谱图可推测出,BFA经H2O2氧化降解后,结构发生了较大改变,一些复杂的芳香族有机物发生降解甚至开环、不饱和烃被氧化,产生了大量小分子羧酸、多元醇、酚及烯烃等有机物。这是因为主要通过脱氢和加成作用与有机物反应,即可通过加成反应途径与BFA中的芳香结构和CC不饱和结构反应,生成酚、醚、烯等中间产物;还能使CC结构发生脱氢反应生产醇或环氧类化合物[12]。这些中间产物可被进一步氧化成有机酸类物质。李静等[21]利用GC/MS等手段分析H2O2氧化降解腐殖酸体系中极性官能团也证实了这一点。
可见,BFA经H2O2氧化降解后,其小分子有机物结构中富含COOH、OH、phOH(酚羟基)及CC等,加入的Ca2+通过与COOH或OH产生较强的桥键作用,可将这些小分子有机物形成类聚羧酸、多元醇及羧酸与烯烃等的共聚物。
对BFA降解前后的溶液进行酸性基团检测,结果见表1。

表1 BFA降解前后含氧酸性基团含量
表1中数据进一步表明,BFA经H2O2氧化降解后产生大量羧基和酚羟基,总酸性基增加近1倍。其中,羧基增加了106.64%,酚羟基增加了约75%。
根据前面的试验结果,在以降低BFA钙盐复合物冰点为响应因子获得的BFA最佳预氧化条件下降解,BFA结构中的COOH增加量大大超过phOH。相对于phOH,BFA结构中的COOH含量对融雪化冰性能的提高更为有利。
2.2.4 BFA钙盐复合物融雪机理探讨 根据文献,羧酸的共聚体有较强的吸水能力,多元醇可使冰点降低,聚羧酸衍生物以及烯烃与羧酸的共聚体可使冻结迟延[22]。BFA经H2O2氧化降解后,在加入的Ca2+的桥键作用下,也可以形成小分子的类聚羧酸、多元醇及羧酸与烯烃等的共聚物。
由此推测BFA钙盐复合物的融冰机理如下。
(1)BFA中的类聚羧酸及羧酸和烯烃等共聚体中极性基团首先通过氢键作用将冰雪表面或地面的自由水和结合水吸收,致使冰雪表面饱和蒸气压降低,促进冰雪融化;同时部分BFA小分子在氢键作用扩散进入冰层的内部使其体积膨胀,松动冰层。
(2)多元醇和引入的盐离子(Cl-)等使融化后冰(雪)水冰点下降。
(3)类聚羧酸衍生物以及羧酸与烯烃等共聚体稳定了体系的过冷状态,最大限度地推迟了冻结时间。
此外,棕黄色的BFA钙盐复合溶液还有利于吸热,从而促进溶化后的冰水蒸发。
3 结 论
本文就H2O2预氧化降解对BFA钙盐复合物融雪化冰性能的影响及其融雪机理进行了研究。结果表明,BFA通过H2O2预氧化降解可有效降低其与钙盐复合物的冰点,在pH 7.5、H2O2与BFA质量比1.5、35℃的最佳降解条件下反应120 min,可将其冰点降低近27%。
BFA降解前后的结构表征发现,BFA经H2O2氧化后,结构发生了较大改变,一些复杂的芳香族有机物发生降解甚至开环、不饱和脂肪烃被氧化,产生了大量小分子羧酸、醇、酚及烯烃等有机物,其中羧基增加超过了1倍,酚羟基增加了约75%。
融雪化冰机理探讨中发现,BFA钙盐复合物中Ca2+络合作用形成的小分子聚合物或共聚物在融雪化冰中起主要作用,增加BFA结构中的COOH、OH和phOH亲水性基团含量是提高BFA融雪化冰性能的关键。
References
[1] 孙婷婷.化学融雪剂对高速公路路旁土壤中水溶性盐离子含量及氮素转化的影响 [D]. 沈阳: 辽宁大学, 2013 SUN T T. Effect of deicing salts on the content of water-soluble salt ions and nitrogen transformation in highway roadside soil [D]. Shenyang: Liaoning University, 2013.
[2] 许英梅, 刘倩, 仉传华, 等.CMA类环保型融雪剂的应用研究进展 [J]. 化学世界, 2011, (7): 404-406. XU Y M, LIU Q, ZHANG C H,. Research progress on application of CMA environmentally friendly deicer [J]. Chemistry Word, 2011, (7): 404-406.
[3] 梁西良, 崔宝军, 白雪峰, 等.高效环保融雪剂的研究 [J]. 化学与粘合, 2014, 36 (2): 146-149. LIANG X L, CUI B J, BAI X F,. Study on highly effective snow-melting agent with environment-friendly [J]. Chemistry and Adhesion, 2014, 36 (2): 146-149.
[4] 陈文洁. 马铃薯发酵制备有机融雪剂的工艺研究 [D]. 太原: 中北大学, 2014. CHEN W J.Studies on preparation of organic deicers by potato fermentation [D]. Taiyuan: Zhongbei University, 2014.
[5] 栾国颜, 刘洋, 王鹏, 等.生物质制备环保型融雪剂的实验研究 [J].吉林化工学院学报, 2011, 28 (9): 1-4. LUAN G Y, LIU Y, WANG P,. Preparation of the environmentally friendly deicer from biomass by experiment [J]. Journal of Jilin Institute of Chemical Technology, 2011, 28 (9): 1-4.
[6] 宋礼慧, 靳志玲, 刘安双. 环保型融雪剂的高效缓蚀剂的研制 [J]. 无机盐工业, 2012, 41 (8): 15-17. SONG L H, JIN Z L, LIU A S. Study on highly effective corrosion inhibitor compound for snow-melting agent with environment- friendly [J]. Inorganic Chemicals Industry, 2012, 41 (8): 15-17.
[7] 王萌, 李晓林, 杜丹超, 等. 一种有机无机复合环保融雪剂的制备及性能研究 [J]. 现代化工, 2014, 34 (12): 66-69. WANG M, LI X L, DU D C,. Preparation and performance of organic-inorganic composite environmental protection deicers [J].Modern Organic Morphology, 2014, 34 (12): 66-69.
[8] 龙江虹, 曾平, 阳杰, 等.环境友好型氯盐融雪剂的研制 [J].中国井矿盐, 2014, 45 (5): 1-7. LONG J H, ZENG P, YANG J,. Development of environmentally friendly chloride agent for snow melting [J]. China Well and Rock Salt, 2014, 45 (5): 1-7.
[9] 陈文求, 王仁宗, 陈敏杰, 等.腐植酸的降解研究及进展 [J]. 化工进展, 2013, 32 (S1): 207-212. CHEN W Q, WANG R Z, CHEN M J,. Degradation research and progress of humic acids [J].Chemical Industry and Engineering Progress, 2013, 32 (S1): 207-212.
[10] 杨光, 孙晓然, 赵艳琴, 等.黄腐酸的物质基础及药理活性研究进展[J].广州化工, 2014, 42 (10): 15-17. YANG G, SUN X R, ZHAO Y Q,.Material basis and pharmacological activity of fulvic acid [J].Guangzhou Chemical Industry, 2014, 42 (10): 15-17.
[11] 王春霞, 彭安, SCHMITT P H, 等. 不同来源腐殖酸的光解及过氧化氢对其影响 [J]. 环境科学学报,1996, 16 (3): 270-275.WANG C X, PENG A, SCHMITT P H,. Photodegradation of fulvic acids of various origins and the effects of hydrogen peroxides [J]. Acta Scientiae Circumstantiae, 1996, 16 (3): 270-275.
[12] 金鹏康, 王晓昌, 白帆. 腐植酸臭氧氧化和过氧化氢催化氧化处理特性比较 [J]. 环境化学, 2005, 24 (5): 533-537. JIN P K, WANG X C, BAI F. Comparison of the characteristics of ozonation and hydrogen peroxide catalytic oxidation on the treatment of humic acids [J].Environmental Chemistry, 2005, 24 (5): 533-537.
[13] 张水花, 李宝才, 张惠芬, 等. 年青褐煤H2O2降解生产黄腐酸工艺及产物性质 [J]. 化学工程, 2010, 38 (4): 85-88. ZHANG S H, LI B C, ZHANG H F,. Oxidation degradation technology with H2O2for producing fulvic acids from brown coal and properties of products [J]. Chemical Engineering (China), 2010, 38 (4): 85-88.
[14] 蒋胜韬, 祝建中, 管玉江, 等.非均相类Fenton法降解硝基苯化工废水的效能及其机制 [J]. 化工学报, 2014, 65 (4): 1488-1494. JIANG S T, ZHU J Z, GUAN Y J,. Performance of heterogeneous Fenton-like system for degradation of nitrobenzene- containing wastewater [J]. CIESC Journal, 2014, 65 (4): 1488-1494.
[15] 李学艳, 高乃云, 沈吉敏, 等. O3/H2O2降解水中致嗅物质2-MIB的效能与机理 [J]. 环境科学学报, 2009, 29 (2): 344 -352. LI X Y, GAO N Y, SHEN J M,. Efficiency and mechanism of degradation of 2-MIB by O3/H2O2in water [J]. Acta Scientiae Circumstantiae, 2009, 29 (2): 344 -352.
[16] 胡立红, 薄采颖, 周静, 等.响应面法优化木质素氧化降解工艺及反应活性研究 [J]. 工程塑料应用, 2015, 43 (11): 95-98. HU L H, BO C Y, ZHOU J,. Optimization of lignin oxidation degradation technology by response surface methodology and its reactive activity [J].Engineering Plastics Application, 2015, 43 (11): 95-98.
[17] 吴德礼, 段冬, 马鲁铭.黄铁矿烧渣催化H2O2氧化废水中难降解污染物 [J]. 化工学报, 2010, 61 (4): 1001-1008. WU D L, DUAN D, MA L M. Fenton-like oxidation of refractory organic contaminants in wastewater using pyrite cinder at neutral pH [J]. CIESC Journal, 2010, 61 (4): 1001-1008.
[18] SARATHY S R, HOHSEN I M. The impact of UV/H2O2advanced oxidation on molecular size distribution of chromophoric natural organic matter [J]. Environmental Science and Technology, 2007, 41 (24): 8315 -8320.
[19] 彭茜, 冉德钦, 王平, 等.不同pH值下腐殖酸反渗透膜污染中的界面相互作用解析 [J]. 中国环境科学,2011, 31 (4): 616-621. PENG Q, RAN D Q, WANG P,. Analysis of interfacial interactions in reverse osmosis membrane fouling by humic acid Effect of solution pH [J].China Environmental Science,2011, 31 (4): 616-621.
[20] 高鸿宾.有机化学[M]. 4版. 北京: 高等教育出版社, 2004: 129.GAO H B. Organic Chemistry [M]. 4th ed. Beijing: Higher Education Press, 2004: 129.
[21] 李静, 曲久辉, 刘会娟, 等.臭氧氧化水中黄腐酸过程中有机物的形态变化 [J].中国科学(B辑: 化学), 2008, 38 (1): 67-71. LI J, QU J H, LIU H J,. Change of the organic morphology during the treatment of humic acids in water by ozonation [J].Science in China(Series B:Chemistry), 2008, 38 (1): 67-71.
[22] SHAUN S. Theory of water transport in melting snow with a moving surface [J].Cold Regions Science and Technology, 2000, (31): 47-57.
Effect of H2O2oxidation on property of BFA compound snow-melting agent and its snow-melting mechanism
HAN Yongping, GONG Ping, LIU Hongmei, ZHOU Wenping, HE Zhifu
(Beijing Key Laboratory of the Resource Utilization of Biomass Waste, Biochemical Engineering College, Beijing Union University, Beijing 100023, China)
Biochemical fulvic (BFA) was degraded by hydrogen peroxide (H2O2) before it compounded with calcium salts to be the snow-melting agent. The effect of H2O2concentration, temperature and pH on the freezing point of BFA compound was studied, and its snow-melting mechanism was analyzed by UV, FTIR and GPC. The optimal conditions in degradation were as follows: ratio of H2O2to BFA was 1.5 ml/g, temperature 35℃ and pH 7.5, at which BFA had been degraded for 120 min and the freezing point of BFA compound reduced by about 27%. The results showed that H2O2resulted in the ring opening of some complex aromatic hydrocarbon and oxidation of some unsaturated aliphatic hydrocarbons to produce lots of small-molecular carboxylic acid, alcohol, phenol and alkene arose, which formed some copolymer under Ca2+complexation. They played the dominant role in ice or snow melting. The experiment results indicated that it was key in improving the property of BFA snow-melting agent and increasing the hydrophilic functional groups of carboxy (COOH), hydroxyl (OH) and phenolic hydroxyl (phOH) in BFA.
snow-melting agent; biochemical fulvic; hydrogen peroxide; degradation; performance of melting ice
2016-03-31.
HAN Yongping, hypyyt@163.com
10.11949/j.issn.0438-1157.20160408
TQ 041.8
A
0438—1157(2016)10—4461—07
北京市教委科技提升项目(PXM2014-0142309- 07-000080)。
2016-03-31收到初稿,2016-06-22收到修改稿。
联系人及第一作者:韩永萍(1971—),女,博士,副教授。
supported by the Science and Technology Foundation of Beijing Municipal Education Commission (PXM2014-0142309-07- 000080).
