添加剂改性Fenton体系中Fe2+再生过程及机制的对比
2016-10-13周伟赵海谦高继慧吴少华
周伟,赵海谦,高继慧,吴少华
添加剂改性Fenton体系中Fe2+再生过程及机制的对比
周伟1,赵海谦2,高继慧1,吴少华1
(1哈尔滨工业大学能源科学与工程学院,黑龙江哈尔滨150001;2东北石油大学土木建筑工程学院,黑龙江大庆 163318)
Fe2+的再生直接决定Fenton体系产生的能力。选取羟胺、对苯二酚、对苯醌、亚硫酸钠4种典型添加剂,通过分析不同改性Fenton体系中Fe2+浓度、H2O2浓度、氧化还原电极电位(ORP),揭示了Fe2+再生机制的差异,并进一步分析了不同添加剂与体系中H2O2及的反应情况。结果表明:NH2OH能快速使Fe2+再生,但伴随其消耗,Fe2+浓度不断降低。对苯二酚、对苯醌具有相似效果,两者均可大大强化Fe2+的再生。与NH2OH不同,两者在体系中可迅速建立醌循环,持续还原Fe3+,且以两种物质或其组合均可建立循环。与上述机理均不同,Na2SO3会先与及H2O2反应,因而不能有效还原Fe3+。实验还发现添加剂均存在与的反应,其中Na2SO3还会消耗H2O2。
Fenton;Fe2+再生;自由基;罗丹明B;还原;水溶液
引 言
Fenton体系(Fe2++H2O2)具有反应速率快、控制简单、毒性低等特点,在污水处理中得到了广泛的应用,已有大量学者对其机理及应用展开了研究[1-4]。然而,Fenton体系的一些固有缺陷限制了其进一步广泛应用。如高的H2O2投加量、严格的pH范围、铁污泥的累积等,这造成了Fenton体系氧化效率的降低,并且需要额外的分离步骤[5]。Fenton体系的这些缺陷可以通过技术的发展而被减弱。近些年,对于Fenton体系的优化,研究者采用了加入添加剂、过渡金属离子代替Fe2+、均相Fenton、UV/Fenton、微波-Fenton等方案,一定程度上改善了Fenton体系的缺陷,扩大了其应用范围[1,5-7]。
反应(1)与反应(2)是Fenton体系的两个核心反应[8]。可以看出,反应(1)的速率常数远大于反应(2),反应启动后,Fenton体系在产生的同时,Fe2+被氧化成Fe3+。如果溶液中的Fe2+难以得到有效再生,Fenton反应将转化成类Fenton反应(Fe3++H2O2),处理效果变差[4]。而前文中提到的Fenton反应的缺陷最终可归因于Fe3+向Fe2+转化速率太慢[1]。Huang等[9]认为,在Fe2+/Fe3+循环中,Fe2+再生是速率控制步骤,任何提高Fe3+还原的方法都将加速的形成。电-Fenton体系可实现Fe2+的原位再生,得到了研究者的关注[10-11],然而,该体系存在能耗高、电流效率低等问题。光-Fenton体系可以一定程度实现Fe2+的再生,同时降低反应能耗,也得到了研究者的关注[12-13]。


在使用添加剂强化Fenton体系方面,已有部分研究[1-2,5,9]。羟胺作为一种还原剂,被用在邻菲啰啉法中测定溶液中总铁含量[14]。Li等[1]比较了羟胺改性的Fenton体系与原Fenton体系的差别,并探讨了羟胺强化Fenton反应脱除苯甲酸的机理。杜瑛珣等[4]在研究Fenton处理对氯酚过程中,发现其分解的中间产物能对Fe3+产生还原作用,研究发现该物质为对苯二酚。对苯二酚作为强还原剂,被Fe3+氧化为对苯醌。而Ma等[3]指出,对苯醌可与Fenton体系中另一活性氧自由基HO2·反应,产物为对苯二酚,其速率常数为1×109mol-1·L·s-1。反应方程见式(3)~式(7)[3,5]。Na2SO3作为一种常见的还原剂,可对Fe3+产生还原作用,但目前尚无文献报道Na2SO3对Fenton体系的作用机理。虽然上述添加剂都可再生Fe2+,但Fe2+再生存在几种不同的机制,现有研究对不同机制之间的对比研究和细节讨论缺乏。同时,对苯二酚、对苯醌都可建立醌循环,但由式(3)~式(7)可知,其在机制上存在差异,需进一步揭示。
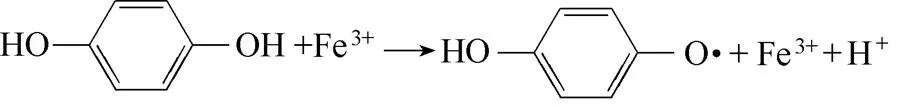
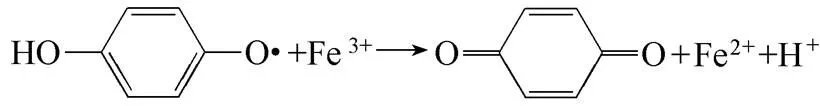



Fenton体系中除了氧化性物种Fe3+,还有H2O2及等氧化性物种。目前研究中较少涉及添加剂与其他氧化性物种(H2O2、)的反应问题。然而,由还原剂改性的Fenton体系能否稳定还原Fe3+,必然还和还原剂与H2O2及的反应问题直接相关。因此,本文拟进一步分析还原剂与体系中H2O2及的反应特性,以完善改性Fenton体系Fe2+再生的相关机制。
1 实验部分
1.1 试剂
实验中所用30%双氧水(H2O2)、七水硫酸亚铁()、罗丹明B(RhB,C28H31ClN2O3)、邻菲啰啉()、二甲基亚砜(DMSO)、盐酸羟胺()、对苯二酚(C6H6O2)、对苯醌(C6H4O2)、亚硫酸钠(Na2SO3),均为国产分析纯,由Milli-Q(Millipore,18.2 MΩ·cm)超纯水配制。
1.2 仪器
紫外-可见分光光度计,新世纪T6型,北京普析通用。滴定仪,ZDJ-5型,上海雷磁。ORP复合电极,501型,上海雷磁。磁力搅拌器,C-MAG HS7型,德国IKA。超纯水机,Master-s型,上海和泰。
1.3 实验方法
反应体系总体积为200 ml,由混合两个100 ml的体系作为反应起点。其中100ml溶解RhB及Fe2+的混合物,另外100 ml溶解H2O2。两份溶液均用0.1 mmol·L-1的稀盐酸调节初始pH为3.0。称量好的添加剂在混合两份溶液的同时加入反应体系中。反应过程中保持均匀搅拌的状态,在0.5、1、2、4、6、9、12、15 min 8个时间点取样,按照既定流程进行Fe2+、H2O2、RhB等浓度的测量,实验进行温度为(25±1)℃,在磁力搅拌器上进行,转速300 r·min-1,搅拌子尺寸27 mm。
2.2节中工况如下:(H2O2)30 mmol·L-1,(Fe2+)1 mmol·L-1,(RhB)2 mmol·L-1,(添加剂)5 mmol·L-1。2.3节中在研究与H2O2反应时,(C6H6O2)(C6H4O2)(H2O2)5 mmol·L-1,在研究与Fe3+作用时,(C6H6O2)(C6H4O2)(Fe3+)1 mmol·L-1。2.4节中研究对Fe3+还原作用时,Na2SO3及Fe3+均为1 mmol·L-1;研究与 H2O2反应时,Na2SO3及H2O2均为5 mmol·L-1。2.5节中NH2OH及H2O2均为5 mmol·L-1。
由于罗丹明B(RhB)易于通过常规仪器分光光度计检测,无毒无害,是水处理领域最常用的模拟污染物之一,因此2.3节中用RhB作为目标污染物,通过其脱色率来进一步表征对苯二酚及对苯醌对Fenton体系的强化作用。
1.4 分析方法
H2O2浓度测试采用钛盐光度法[15],溶液中Fe2+浓度采用邻菲啰啉分光光度法测量[16],罗丹明B浓度采用分光光度计在554 nm波长处定量检测,依据标准曲线计算浓度[17]。以二甲基亚砜(DMSO)为捕获剂,使用高效液相色谱法测试DMSO浓度,通过DMSO浓度的减少量计算体系浓度[18]。
2 结果与讨论
2.1 传统Fenton体系Fe2+再生过程分析
根据文献报道,Fe2+/H2O2体系中Fe3+和Fe2+之间的转化涉及与H2O2、、、等之间的反应。



式(1)与式(2)说明,Fe2+与H2O2反应生成Fe3+,同时Fe3+也能与H2O2反应生成Fe2+,但速率常数2很小,与1相差4个数量级。由此可见,仅考虑与H2O2反应时,体系中应以Fe3+为主。式(8)说明,Fe2+也会在强氧化剂的作用下生成Fe3+。式(9)与式(10)说明,与Fe2+的反应速率常数是其与Fe3+的4倍左右,说明该对反应的结果也应以Fe3+为主。而式(11)与式(12)说明,仅考虑的作用时,溶液中应以Fe2+为主。然而,本文前期研究已证明,体系中的产量极少[21],故忽略式(11)与式(12)的影响。综合上述分析,不存在添加剂时,溶液中Fe2+与Fe3+转化的结果以Fe3+为主,这与众多实验结果相符[1,9-10]。
2.2 改性Fenton体系Fe2+、H2O2浓度变化
2.2.1 Fe2+浓度变化 图1为添加剂改性的Fenton体系及原始Fenton体系中Fe2+浓度随时间的变化规律。Fenton反应启动后,溶液中的Fe2+通过反应(1)很快被氧化成Fe3+,而Fe3+通过反应(2)的再生速率很慢。Li等[1]实验发现,在Fenton反应开始的1 min内,超过70%的Fe2+被转化成Fe3+,2 min后几乎所有的Fe2+全部转化成Fe3+。图1中显示结果与此相同,Fenton体系中Fe2+在反应进行0.5 min后剩余量仅为初始量的3%左右。

图1 不同体系中Fe2+浓度变化
体系加入对苯二酚或对苯醌后[(C6H6O2/ C6H4O2)0:(Fe2+)05:1],Fe2+的变化规律与原Fenton体系大不相同。在0.5 min时,Fe2+浓度均在初始浓度的95%以上。这是因为对苯二酚通过反应(3)~(5)快速地将Fe3+还原,而对苯醌则通过反应(6)、(7)快速地捕捉,生成对苯二酚,继而通过反应(3)~(5)将Fe3+还原。由此可见,两种添加剂都能使溶液中Fe2+浓度维持在接近初始浓度的水平。而体系加入NH2OH后,Fe2+能迅速再生,而2 min时,Fe2+浓度降为初始浓度的68.4%;15 min时,Fe2+浓度已逐步下降为初始浓度的6.8%。
体系加入Na2SO3后,Fe2+浓度与原Fenton体系几乎相同,这与其他添加剂的作用规律存在很大差异。继续向反应液中添加0.378 g Na2SO3后,测量发现溶液中Fe2+浓度仍然很低,继续添加1.26 g后,发现Fe2+迅速被还原,接近1 mmol·L-1,结果如图2所示。而此时测量发现溶液中几乎无H2O2。推测原因是会以极快的速率与强氧化性的反应,同时也可以与H2O2反应。因此,推测本工况下添加的Na2SO3会优先与及H2O2反应,其次才会还原Fe3+。而进一步的证明,将在2.4节讨论。

图2 Na2SO3改性Fenton体系中Fe2+浓度变化
氧化还原电位(ORP)是反映溶液氧化-还原能力的综合参数,对Fenton体系具有指示作用。高迎新等[22]、赵云等[23]、Chen等[24]均认为Fenton体系的ORP反映了溶液中Fe2+/Fe3+的比例。Chen等[24]在研究中采用ORP作为还原产物对Fe2+再生作用程度的指标,以实时监测Fe3+还原的过程。因此,本文进一步采用ORP电极监测了4种改性Fenton体系中ORP的变化过程,以进一步揭示改性体系Fe2+再生过程的差异,结果见图3。由图3可知,Fenton体系启动后,ORP迅速上升,之后保持不变,这与Fenton启动后溶液中Fe2+迅速转变为Fe3+的过程相对应。常规Fenton体系的终态ORP为510 mV,而对苯二酚、对苯醌、羟胺改性的Fenton体系ORP最低可降到396.3、439.8、466.6 mV,而Na2SO3改性的Fenton体系ORP几乎没有变化。由图3(a)可见,加入对苯二酚或对苯醌后,ORP迅速降低,之后出现上升。这是由于对苯二酚可通过式(3)~式(5)迅速还原Fe3+,而对苯醌可与反应生成对苯二酚[式(6)、式(7)],进而还原Fe3+,因此ORP出现下降。同时,对苯醌的下降曲线存在明显“迟滞”,约20 s左右。这是因为其先要生成对苯二酚,继而才能还原Fe3+的缘故。而曲线出现上升,则说明两体系中添加剂可能存在消耗,因而不能持续还原Fe3+。进一步的分析,将在2.3节中讨论。由图3(b)可知,加入Na2SO3,ORP几乎不变化,与图1、图2的结果相符。而加入NH2OH后,ORP出现先迅速降低、后迅速升高的情况,这说明NH2OH可还原Fe3+,但其本身存在消耗,因而不能持续还原Fe3+,该现象与图1中Fe2+浓度变化的结果相符。实验过程中,监测了上述体系pH的变化情况,除了羟胺改性Fenton体系外,其余体系pH变动范围极小,在±0.2以内。羟胺-Fenton体系在15 min时pH为2.47,可能是由于羟胺还原产物造成的。

图3 不同改性Fenton体系中ORP的变化
2.2.2 H2O2浓度变化 图4是不同体系中H2O2浓度的变化过程。显然,添加剂的加入显著提高了H2O2的消耗量。原因在于,添加剂加入体系后(除Na2SO3外),会快速还原Fe3+,从而加速反应(1)的进行,造成H2O2消耗量的增大。由Li等[1]的结论可知,改性Fenton体系的产量将有很大提升,而此时的有效利用问题便至关重要,这是本文下一步要探究的内容。而对体系还原Fe3+机制的进一步揭示,需直接研究几种添加剂与溶液中活性物质(Fe3+、H2O2、)的反应特性,这将在2.3节及2.4节中讨论。

图4 不同Fenton体系中H2O2浓度变化
2.3 NH2OH及醌循环对Fe2+再生机制的差异
对苯二酚、对苯醌加入Fenton体系后,可能的消耗途径众多。为此单独研究了两者与H2O2及Fe3+的反应特性,以进一步明晰其在改性Fenton体系中的作用机制,结果如图5所示。初始H2O2浓度均为5 mmol·L-1,而对苯二酚、对苯醌与H2O2的反应体系中,H2O2几乎未被消耗,说明两者不与H2O2反应。而对Fe3+的还原实验中,发现对苯醌单独存在时,几乎不能还原Fe3+,而对苯二酚能以极快的速率还原Fe3+,生成Fe2+,该过程溶液的UV-vis光谱图如图6所示。对苯二酚的特征吸收峰为220 nm和287 nm,加入Fe3+后溶液的光谱图发生了明显变化。0.5 min时245 nm处出现了明显的吸收峰,而对苯二酚在287 nm处的特征吸收峰降低。随着反应的进行,溶液在245 nm处的峰继续增高,287 nm处的峰继续降低。在15 min反应基本进行完毕。对苯二酚作为一种强还原剂,可被氧化为对苯醌。对苯醌分子中具有两个羰基,两个碳碳双键,在245 nm处出现强的吸收谱带[25]。这进一步验证了对苯二酚与Fe3+的反应产物是对苯醌。图5中Fe2+与图1中Fe2+浓度变化不同的原因,在于Fenton体系可以向对苯醌提供,生成对苯二酚,进而使Fe2+再生。
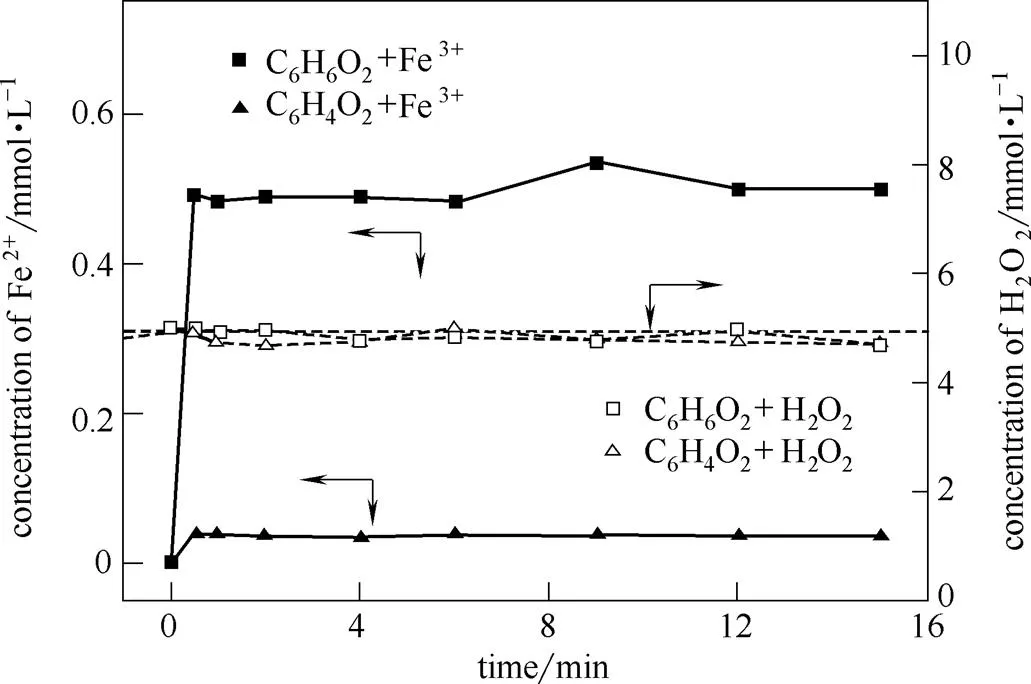
图5 对苯二酚及对苯醌体系中H2O2及Fe2+浓度变化

图6 对苯二酚与Fe3+反应过程中溶液紫外-可见吸收光谱
由上述分析可知,对苯二酚、对苯醌加入体系后,可建立循环,不断动态还原Fe3+,使Fe3+浓度在较长时间内保持稳定,而NH2OH通过消耗自身而促进Fe3+的还原,因而伴随其消耗,Fe2+浓度会从峰值不断降低。
图1、图3的结果均说明,以加入对苯二酚或对苯醌作为循环起点,对体系体现出相似的效果。为此,进一步研究了2.5 mmol·L-1对苯二酚及2.5mmol·L-1对苯醌混合体系对模拟污染物RhB的降解过程。结果如图7所示。可见,以对苯二酚、对苯醌或者两者混合物加入体系后,对RhB具有相似的降解规律,且在反应初期,速率远大于原Fenton体系。这说明醌循环的建立,可能与两种添加剂的总量有关,与循环建立的起点无关。15 min时,改性体系的脱除率略低于原Fenton体系,这说明对苯二酚、对苯醌对生成的可能具有双重作用。一方面,通过建立醌循环强化Fe2+再生,从而提升产量;另一方面,两者也会消耗部分,造成与目标污染物RhB反应的减少。15 min时的脱除率是上述因素综合作用的结果。
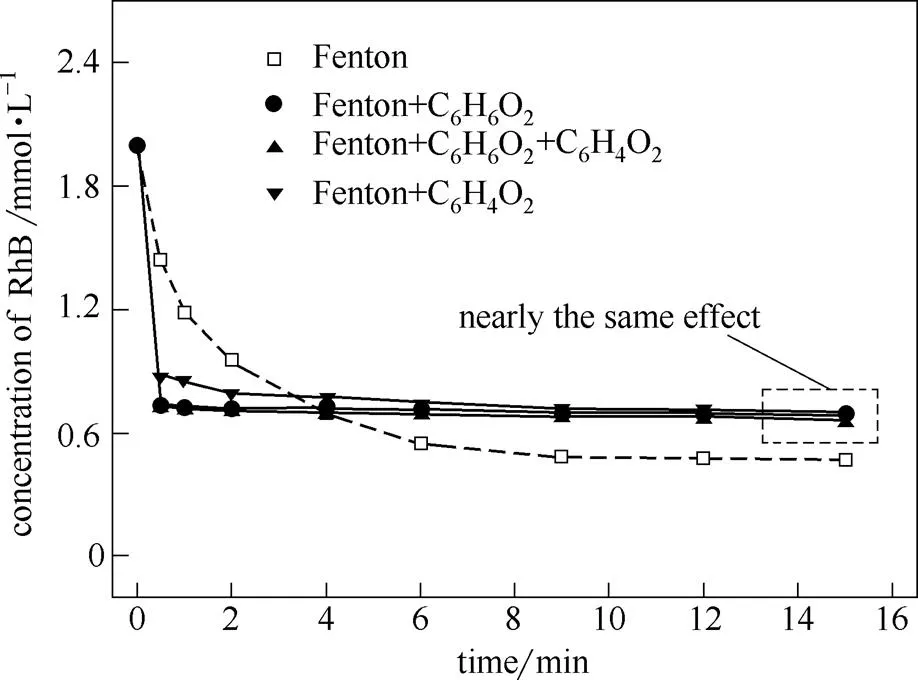
图7 不同Fenton体系中RhB浓度变化
2.4 Na2SO3对Fe2+的再生作用
由于SO32-会以极快的速率与强氧化性的反应[((5.1×109mol-1·L·s-1)],这会对原Fenton体系造成重要影响,同时为验证2.2.1节中的推测,进一步探究了与Fe3+及H2O2的反应规律,如图8所示。可知与及H2O2均会发生反应,反应初期速率较快,后期速率较慢。然而,当体系中同时存在Fe3+、H2O2及时,会优先与及H2O2反应(H2O2是的产生源,因而消耗本质上是消耗了H2O2),最后才能与Fe3+反应,这也是出现图2中添加足量Na2SO3后,Fe3+才可被还原的原因。
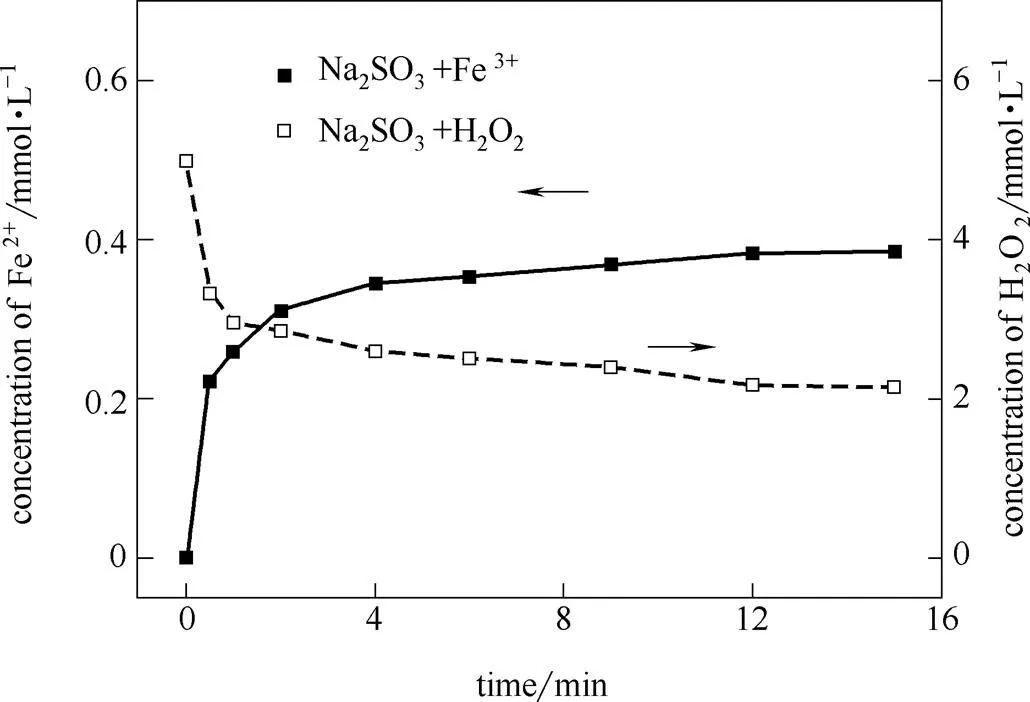
图8 Na2SO3体系中H2O2及Fe3+浓度变化
向Fenton体系加入添加剂的目的是强化Fe3+的还原。然而,Fenton体系中还存在H2O2、等主要氧化性物质,添加剂是否会与之反应,直接关系到体系稳定还原Fe3+的能力。2.3节及2.4节已证明,对苯二酚、对苯醌不与H2O2反应,而Na2SO3会与H2O2反应,同时也会与发生快速反应。
根据文献[26],NH2OH在Fenton体系下,与的反应较弱。因此,为探索对苯二酚、对苯醌与、NH2OH与H2O2的反应,本文进行了针对性的实验研究。由于Fenton体系中H2O2浓度、浓度受反应本身及外加添加剂的双重影响,直接通过Fenton体系中上述物种的浓度变化无法准确获知添加剂与其的反应。因此采用紫外光照射的TiO2悬浮体系作为产生源[27],研究对苯二酚、对苯醌与的反应,借助两物质UV-vis光谱的特征吸收峰287、245 nm(2.3节)来判断是否与反应,结果如图9所示。

图9 TiO2光催化体系中对苯二酚及对苯醌吸收谱图的变化
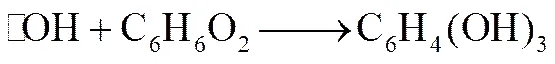

表1 TiO2光催化体系中的浓度
Table 1 concentration in several TiO2 photocatalysis system

表1 TiO2光催化体系中的浓度
Systemconcentration/μmol·L-1 TiO2485.6 TiO2C6H6O246.3 TiO2C6H4O242.1 TiO2Na2SO36.7

图10 NH2OH体系中H2O2浓度变化
综上所述,羟胺、对苯二酚、对苯醌、亚硫酸钠4种添加剂加入Fenton体系后,体系中的物质循环图如图11所示。其中Na2SO3对Fenton体系中Fe3+没有还原作用,反而会首先消耗及H2O2。而NH2OH及对苯二酚、对苯醌对Fe3+有良好的还原作用。由于NH2OH会通过反应而消耗,其对Fe2+的再生作用逐渐减弱,而对苯二酚或对苯醌可通过建立醌循环,持续还原Fe3+,使得溶液中Fe2+浓度维持在较高水平。然而,由于会通过反应(13)、(14)消耗部分对苯二酚及对苯醌,醌循环可能并不能稳定地使Fe2+持续再生。这个问题值得进一步研究和讨论。

图11 添加剂改性Fenton体系中Fe2+的再生机制对比
3 结 论
羟胺、对苯二酚、对苯醌、亚硫酸钠4种典型添加剂对Fenton体系Fe2+再生机制存在明显差异,且不同添加剂对H2O2、的消耗程度各异,获得的具体结论如下。
(1)羟胺通过自身消耗反应促进Fe3+还原,从而使Fe2+快速再生。但伴随其消耗,Fe2+浓度不断降低。同时实验条件下羟胺对的副作用较小,且不与H2O2反应。
(2)对苯二酚、对苯醌通过建立循环促进Fe3+还原。两者对Fenton体系显示出相似的效果,以两种物质或其组合均可建立循环,使Fe2+在长时间内维持高浓度。然而,实验发现,两者均存在与的反应,这可能使其改性的Fenton体系并不能稳定还原Fe3+,该问题有待于进一步的研究。
(3)Na2SO3改性Fenton体系中,Na2SO3会先与及H2O2反应,因而不能有效还原Fe3+。
References
[1] CHEN L W, MA J, LI X C,. Strong enhancement on Fenton oxidation by addition of hydroxylamine to accelerate the ferric and ferrous iron cycles [J]. Environ. Sci. Technol., 2011, 45 (9): 3925-3930.
[2] ZOU J, MA J, CHEN L W,. Rapid acceleration of ferrous iron/peroxymonosulfate oxidation of organic pollutants by promoting Fe(Ⅲ)/Fe(Ⅱ) cycle with hydroxylamine [J]. Environ. Sci. Technol., 2013, 47 (20): 11685-11691.
[3] MA J H, SONG W J, CHEN C C,. Fenton degradation of organic compounds promoted by dyes under visible irradiation [J]. Environ. Sci. Technol., 2005, 39 (15): 5810-5815.
[4] 杜瑛珣, 周明华, 雷乐成. Fenton处理对氯酚过程中间产物对Fe3+的还原作用 [J]. 化工学报, 2005, 56 (10): 1942-1947. DU Y X, ZHOU M H, LEI L C. Reduction of Fe3+by intermediates during Fenton oxidation of-chlorophenol [J]. Journal of Chemical Industry and Engineering (China), 2005, 56 (10): 1942-1947.
[5] PIGNATELLO J J, OLIVEROS E, MACKAY A. Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry [J]. Crit. Rev. Environ. Sci. Technol., 2006, 36 (1): 1-84.
[6] 存洁, 田森林, 王倩, 等. 二茂铁催化光助非均相Fenton氧化法处理含罗丹明B废水 [J]. 中国环境科学, 2013, 33 (6): 1011-1016. CUN J, TIAN S L, WANG Q,. Photo-assisted degradation of Rhodamine B by Ferrocene-catalyzed heterogeneous Fenton-like reaction [J]. China Environment Science, 2013, 33 (6): 1011-1016.
[7] 潘维倩, 张广山, 郑彤, 等. 微波耦合类Fenton处理水中对硝基苯酚 [J]. 中国环境科学, 2014, 34 (12): 3112-3118. PAN W Q, ZHANG Q S, ZHENG T,. Treatment of-nitrophenol in water by Fenton-like reaction with microwave coupling [J]. China Environment Science, 2014, 34 (12): 3112-3118.
[8] LAAT J D, GALLARD H. Catalytic decomposition of hydrogen peroxide by Fe(Ⅲ) in homogeneous aqueous solution: mechanism and kinetic modeling [J]. Environ. Sci. Technol., 1999, 33 (16): 2726-2732.
[9] HUANG W Y, BRIGANTE M, WU F,. Assessment of the Fe(III)-EDDS complex in Fenton-like processes: from the radical formation to the degradation of bisphenol A [J]. Environ. Sci. Technol., 2013, 47 (4): 1952-1959.
[10] QIANG Z M, CHANG J H, HUANG C P. Electrochemical regeneration of Fe2+in Fenton oxidation processes [J]. Wat. Res., 2003, 37 (6): 1308-1319.
[11] 孙杰, 彭巧丽, 莫文艳. 电芬顿降解X3B中Fe2+/Fe3+催化循环行为 [J]. 中南民族大学学报(自然科学版), 2012, 31 (3): 19-22. SUN J, PENG Q L, MO W Y. Catalytic recycling behavior of the Fe3+/Fe2+system in the electro-Fenton degradation of brilliant Red X3B [J]. Journal of South-Central University for Nationalities (Natural Science Edition), 2012, 31 (3): 19-22.
[12] KAVITHA V, PALANIVELU K. The role of ferrous ion in Fenton and photo-Fenton processes for the degradation of phenol [J].Chemosphere, 2004, 55 (9): 1235-1243.
[13] 刘钰鑫, 喻泽斌, 彭振波, 等. 模拟太阳光协同三维电极/电Fenton降解甲基橙 [J]. 环境工程学报, 2016, 10 (4): 1727-1734. LIU Y X, YU Z B, PENG Z B,. Degradation of methyl orange by simulated solar light combined with three-dimensional electro-Fenton system [J]. Chinese Journal of Environmental Engineering, 2016, 10 (4): 1727-1734.
[14] ZHOU X, MOPPER K. Determination of photochemically produced hydroxyl radicals in seawater and fresh water [J]. Mar. Chem., 1990, 30 (1/2/3): 71-88.
[15] 姜成春, 庞素艳, 马军, 等. 钛盐光度法测定Fenton氧化中的过氧化氢 [J]. 中国给水排水, 2006, 22 (4): 88-91. JIANG C C, PANG S Y, MA J,. Spectrophotometric determination of hydrogen peroxide in Fenton reaction with titanium oxalate [J]. China Water & Wastewater, 2006, 22 (4): 88-91.
[16] 蔡裕丰, 徐立生. 邻菲啰啉直接光度法测定水中总铁 [J]. 环境科学导刊, 2009, 28 (3): 104-106. CAI Y F, XU L S. Detection of total iron in the water by-phenanthroline direct photometry method [J]. Guide of Environmental Science, 2009, 28 (3): 104-106.
[17] 黎朝. MOFs/H2O2反应体系降解罗丹明B的试验研究[D]. 武汉: 武汉理工大学, 2013. LI C. The research on the degradation of Rhodamine B by MOFs/H2O2system[D]. Wuhan: Wuhan University of Technology, 2013.
[18] CHAO T, PENG J F, LIU J F,. Determination of hydroxyl radicals in advanced oxidation processes with dimethyl sulfoxide trapping and liquid chromatography [J]. Analytica Chimica Acta, 2004, 527 (1): 73-80.
[19] HUITE R E, NETA P. Rate constants for some oxidations of S(IV) by radicals in aqueous solutions [J]. Atmos. Environ., 1987, 21 (8): 1743-1747.
[20] ALSUHYBANI A A, HUGHES G. Pulse radiolysis of deaerated hydroquinone solutions [J]. J. Chem. Soc. Pak., 1986, 8 (2): 107-115.
[21] 赵海谦, 高继慧, 周伟, 等. Fe2+/H2O2体系内各种自由基在氧化NO中的作用 [J]. 化工学报, 2015, 66 (1): 449-454. ZHAO H Q, GAO J H, ZHOU W,. Roles of varied radicals in NO oxidation by Fe2+/H2O2system [J]. CIESC Journal, 2015, 66 (1): 449-454.
[22] 高迎新, 张昱, 杨敏. Fenton反应中氧化还原电势的变化规律 [J]. 环境化学, 2004, 23 (2): 135-139. GAO Y X, ZHANG Y, YANG M. Characteristics of ORP in Fenton’s reaction [J]. Environmental Chemistry, 2004, 23 (2): 135-139.
[23] 赵云, 王丽萍, 何士龙, 等. Fenton试剂氧化对硝基酚中氧化还原电位的变化规律 [J]. 环境污染与防治, 2011, 33 (4): 58-65. ZHAO Y, WANG L P, HE S L,. Variation of ORP during-nitrophenol degradation by Fenton oxidation process [J]. Environmental Pollution & Control, 2011, 33 (4): 58-65.
[24] CHEN F, MA W H, HE J J,. Fenton degradation of malachite green catalyzed by aromatic additives [J]. J. Phys. Chem. A, 2002, 106 (41): 9485-9490.
[25] 徐寿昌. 有机化学 [M]. 2版. 北京: 高等教育出版社, 1996: 262. XU S C. Organic Chemistry [M]. 2nd ed. Beijing: Higher Education Press, 1996: 262.
[26] LIND J, MERENYI G. Kinetic and thermodynamic properties of the aminoxyl () radical [J]. J. Phys. Chem. A, 2006, 110 (1): 192-197.
[27] FUJISHIMA A, ZHANG X T, TRYK D A. TiO2photocatalysis and related surface phenomena [J]. Surface Science Reports, 2008, 63 (12): 515-582.
[28] RUSH J D, BIELSKI B H. Pulse radiolytic studies of the reactions ofwith Fe(Ⅱ)/Fe(Ⅲ) ions. The reactivity ofwith ferric ions and its implication on the occurrence of the Haber-Weiss reaction [J].J. Phy. Chem., 1985, 89 (23): 5062-5066.
[29] ROTHSCHILD W G, ALLEN A O. Studies in radiolysis of ferrous sulfate solutions (Ⅲ): Air-free solutions at higher pH [J]. Radiation Research, 1958, 8 (2): 101-110.
Comparison of regeneration mechanism of Fe2+in modified Fenton system
ZHOU Wei1, ZHAO Haiqian2, GAO Jihui1, WU Shaohua1
(1School of Energy Science and Engineering, Harbin Institute of Technology, Harbin 150001, Heilongjiang, China;2Institute of Civil Engineering & Architecture, Northeast Petroleum University, Daqing 163318, Heilongjiang, China)
The regeneration of Fe2+can have a marked effect onproduction in Fenton system. Hydroxylamine hydrochloride, hydroquinone,-benzoquinone and sodium sulfite were used as typical additives. Different regeneration mechanisms of Fe2+were revealed by analysis of Fe2+concentration, H2O2concentration and oxidation-reduction potential (ORP) as well. Furthermore, reactions between additives and H2O2andwere also explored. Results demonstrated that Fe2+was regenerated by hydroxylamine quickly, but concentration of Fe2+gradually decreased with the consumption of hydroxylamine. Hydroquinone and-benzoquinone exerted similar effect on Fenton system, resulting in enhanced regeneration of Fe2+. Quinone cycle could be built once they were added to Fenton system. Therefore, the concentration of Fe2+could maintain a relatively high level in a long period. Quinone cycle can be established by one of the two substances or their mixture. Sodium sulfite reacted withand H2O2, which contributed to a poor performance on Fe3+reduction.
Fenton; regeneration of ferrous ion; radical; Rhodamine B; reduction; aqueous solution
2016-04-07.
Prof. GAO Jihui, gaojh@hit.edu.cn
10.11949/j.issn.0438-1157.20160446
X 511
A
0438—1157(2016)10—4413—09
国家自然科学基金项目(91434134,51276052)。
2016-04-07收到初稿,2016-05-29收到修改稿。
联系人:高继慧。第一作者:周伟(1991—),男,博士研究生。
supported by the National Natural Science Foundation of China (91434134, 51276052).
