厌氧氨氧化工艺处理含海水污水的亚硝态氮抑制及反应动力学
2016-10-13于德爽齐泮晴魏思佳管勇杰
于德爽,齐泮晴,李 津*,魏思佳,管勇杰
厌氧氨氧化工艺处理含海水污水的亚硝态氮抑制及反应动力学
于德爽,齐泮晴,李 津*,魏思佳,管勇杰
(青岛大学环境科学与工程学院,山东 青岛 266071)
采用ASBR厌氧氨氧化反应器,在全海水条件下,通过固定进水NH4+-N 110mg/L,逐渐提高进水NO2--N的方式研究了NO2--N对厌氧氨氧化脱氮的影响及抑制动力学和脱氮过程动力学.结果表明:进水NO2--N浓度达到170mg/L时,厌氧氨氧化反应开始受到明显抑制, NH4+-N的去除率下降8.41%;修正的Logistic过程动力学研究结果显示,进水NO2--N低于151.49mg/L会促进厌氧氨氧化反应的进行,进水NO2--N高于170mg/L时开始抑制厌氧氨氧化反应的进行;Luong模型适合描述全海水条件下高浓度NO2--N对厌氧氨氧化脱氮效能的抑制动力学.Luong模型得到的最大基质转化速率(NRRmax)为0.53kg N/(m3·d),出水NO2--N半饱和常数(S)为0.10mg/L,净生长停止的出水NO2--N浓度(m)为338.22mg/L,Luong动力学常数()为0.41,相关系数为0.97801.
海水;厌氧氨氧化;亚硝态氮;抑制动力学;过程动力学
厌氧氨氧化是一种以NO2-为电子受体, NH4+为电子供体,依靠无机碳源自养,最终产生N2的生化反应[1].NH4+-N和NO2--N作为厌氧氨氧化菌的基质,但二者也会对厌氧氨氧化菌产生强烈的抑制作用[2-3],其中NO2--N的毒性作用更强[2,4].亚硝酸盐是很强的生物抑制剂,研究发现NO2--N对于厌氧氨氧化菌的抑制机理为过量亚硝酸盐抑制厌氧氨氧化关键酶(联氨脱氢酶)活性,造成代谢受阻,同时造成中间产物联氨积累而毒害细胞,由此形成双重抑制效应[4].研究发现进水NO2--N的浓度以及厌氧氨氧化菌在高NO2-- N环境下的暴露时间均会影响厌氧氨氧化菌的活性[5-6].盐度也是影响厌氧氨氧化菌活性的一个重要因素,且不同离子类型的盐对厌氧氨氧化的活性影响作用不同[7].盐度主要通过影响厌氧氨氧化菌细胞渗透压及酶活性来影响微生物的活性[8],长期在高盐环境下可导致厌氧氨氧化菌群发生菌群演变[9-10].目前关于盐度对厌氧氨氧化的研究主要是以NaCl为盐度组分的研究,而关于海水对厌氧氨氧化的影响则较少.海水由于成分复杂,相对于NaCl盐度,海水对厌氧氨氧化菌的影响存在不确定性.
目前对于NO2--N抑制厌氧氨氧化的研究中,在不同的操作条件下得出了较为宽泛的NO2--N抑制浓度.Strous等[3]的研究认为,高于100mg/L的NO2--N可使厌氧氨氧化过程完全停止.Jetten等[5]的研究发现,高于280mg/L的NO2--N可使厌氧氨氧化菌活性完全消失.Dapena-Mora等[2]的研究发现,350mg/L的NO2--N可使比厌氧氨氧化活性(SAA)下降50%.Kimura等[6]的研究则发现,在进水NO2--N高达750mg/L并连续运行7d,厌氧氨氧化菌依然保持10%的活性.这些研究主要是在非高盐度环境下得出的结果,对于在高盐度和NO2--N双重抑制作用下,NO2--N对厌氧氨氧化脱氮的影响鲜有报道.因此,本研究在全海水条件下(盐度约为32‰),通过固定进水NH4+-N浓度为110mg/L,逐渐提高进水NO2--N浓度的方式,研究了NO2--N对ASBR厌氧氨氧化脱氮的影响及NO2--N抑制动力学和厌氧氨氧化脱氮过程动力学,以期为含海水污水的厌氧氨氧化处理提供诸如优化反应器运行条件、评估反应器的脱氮性能等提供理论和技术指导.
1 材料与方法
1.1 试验装置
试验采用ASBR厌氧氨氧化反应器.该反应器总体积为8.0L,有效体积7.0L.整个反应器表面用黑布包裹,防止光线对厌氧氨氧化活性污泥造成负面影响.反应器的外层有(35±2)℃恒温水浴,进水的pH值控制在7.4±0.1.反应器运行一个周期的时间为10.5h,其中进水2min,反应10h,静置25min,出水3min.
在试验开始之前,反应器已经成功实现了海水盐度的驯化.在全海水条件下,反应时间为10h时,NLR可达0.61kg N/(m3·d),NRR可达0.52kg N/(m3·d).反应器内有约占反应器有效体积1/3的块状海绵载体,活性污泥颗粒及絮体几乎都附着在块状海绵上,块状海绵呈现土黄色,内部有大量砖红色颗粒污泥.
1.2 试验废水
试验使用海水(取自黄海青岛麦岛周边)配制模拟废水,配水具体组成成分为(mg/L): KH2PO420,CaCl2·2H2O 107,MgSO4·7H2O 45, KHCO31350,微量元素浓缩液Ⅰ(1mL/L):EDTA 5g/L,FeSO4·7H2O 5g/L,微量元素Ⅱ(1mL/L,g/L): EDTA 15, H3BO30.014, MnCl2·4H2O 0.99, CuSO4·5H2O 0.25, ZnSO4·7H2O 0.43, NiCl2·6H2O 0.19, Na2MoO4·2H2O 0.22, CoCl2·6H2O 0.24, NaSeO4·10H2O 0.21. NH4+-N和NO2--N分别由NH4Cl和NaNO2按需提供,其中进水NH4+-N浓度为110mg/L,进水NO2--N浓度分别为100, 135, 150, 170, 220, 280, 350mg/L.为了提供厌氧环境,人工配制的模拟废水使用高纯氮气吹脱至DO≤0.3mg/L.
1.3 分析项目和方法
NH4+-N纳氏试剂法;NO2--N:N-(1-萘基)乙二胺分光光度法;NO3--N:麝香草酚分光光度法;值: WTW pH/0xi 340i便携式pH计;紫外/可见分光光度计:UV-5200.
1.4 动力学模型
1.4.1 基质抑制动力学模型 基质抑制动力学模型主要有Haldane模型[11-14],Edwards模型[14-15], Aiba模型[13-14,16],Luong模型[14,17].Haldane模型曾被用来描述硝化过程中基质的抑制.Edwards模型被用于描述高基质浓度对微生物生长的抑制.Aiba模型被用于描述乙醇发酵的产物抑制.这3种模型均不能预测出基质完全抑制微生物生长的浓度.Luong模型用于描述基质丁醇抑制酵母生长的过程,它可以给出微生物停止生长时基质的抑制浓度.
Haldan模型:
Edwards模型:
Aiba模型:
Luong模型:
式中:NRR为基质氮转化速率,kg N/(m3·d); NRRmax为最大基质转化速率,kg N/(m3·d);为出水基质浓度,mg/L;S为半饱和常数,mg/L;IH为Haldane抑制动力学常数,mg/L;IE为Edwards抑制动力学常数,mg/L;IA为Aiba抑制动力学常数,mg/L;m为净生长停止的出水基质浓度,mg/L;为Luong抑制动力学常数.
1.4.2 过程动力学模型 对于基质降解过程动力学,不同的模型适用于不同的生物反应器.适用于描述ASBR厌氧氨氧化反应的过程动力学模型主要有修正的Logistic模型[13,18-19],修正的Boltzmann模型[13,18]与修正的Gompertz模型[10,13,18].修正的Logistic模型曾被Wang等[19]用来描述批次试验中以葡萄糖为基质的产氢过程.修正的Gompertz模型被广泛应用于批次实验中发酵产氢过程中基质降解、菌体生长和产物生成等过程[19].修正的Boltzmann模型可被用来指示厌氧氨氧化反应过程的潜力[20],以及受抑制后的恢复过程[18,21].这3种模型都被证实可以用来描述描述ASBR厌氧氨氧化反应器的基质降解过程动力学[13].
修正的Logistic模型:
修正的Boltzmann模型:
修正的Gompertz模型:
式中:NRE为总氮(NH4+-N、NO2--N和NO3--N之和)去除率,%;NREmax为最大总氮去除率,%;max为最大脱氮速率,%/h;为脱氮延迟时间,h;为反应时间,h;NREmin为最小总氮去除率,%;c为反应时间中间值,即反应至NREmin+(NREmax- NREmin)/2所需的时间,h;d为时间常数,h.
2 结果
2.1 NO2--N对反应器运行稳定度性的影响
如图1所示,当进水NO2--N浓度为100mg/L时,厌氧氨氧化反应几乎没有受到NO2--N浓度的抑制,出水NO2--N去除率可达100%,但是出水NH4+-N的去除率却只有约80%,这是由于进水NH4+-N和NO2--N浓度的比值小于1:1.32,造成NH4+-N过量而无法去除.此时NRR的平均值为0.41kg N/(m3·d).当进水NO2--N浓度为135mg/L和150mg/L时,出水NH4+-N去除率可达100%,可以认为进水NO2--N 135,150mg/L没有对厌氧氨氧化菌造成抑制作用,但是出水NO--N的去除率却随着进水NO2--N浓度的提高而开始出现下降,由100%分别降至约97.13%和79.57%, NLR在此阶段稳定在0.52kg N/(m3·d),较前一阶段提升21.2%.之后,随着进水NO--N浓度达到170mg/L时,厌氧氨氧化活性开始受到明显抑制作用,出水NH4+-N的去除率开始出现下降的趋势,其平均值为91.59%,约下降8.41%.NRR下降至0.47kg N/(m3·d),约下降9.62%.随着进水NO2--N浓度的进一步提升,反应器的处理效能进一步降低,当进水NO2--N浓度达到约350mg/L时,出水NH4+-N的去除率下降至36.28%,NRR降至0.20kg N/(m·d).这一结果与Dapena-Mora等[2]的研究结果相类似,其研究结果显示,当进水NO2--N浓度达到350mg/L时,厌氧氨氧化菌的比活性下降50%.
以出水NO2--N浓度作为评估反应器脱氮效能受抑制的影响因子,使用Haldane抑制模型、Edwards抑制模型、Aiba抑制模型和Luong抑制模型对出水NO2--N浓度和基质转化速率(NRR)作抑制动力学模型拟合(表1).
表1 进水NO2--N浓度对反应器的影响
Table 1 The influences of influent NO2--N concentration on the reactor
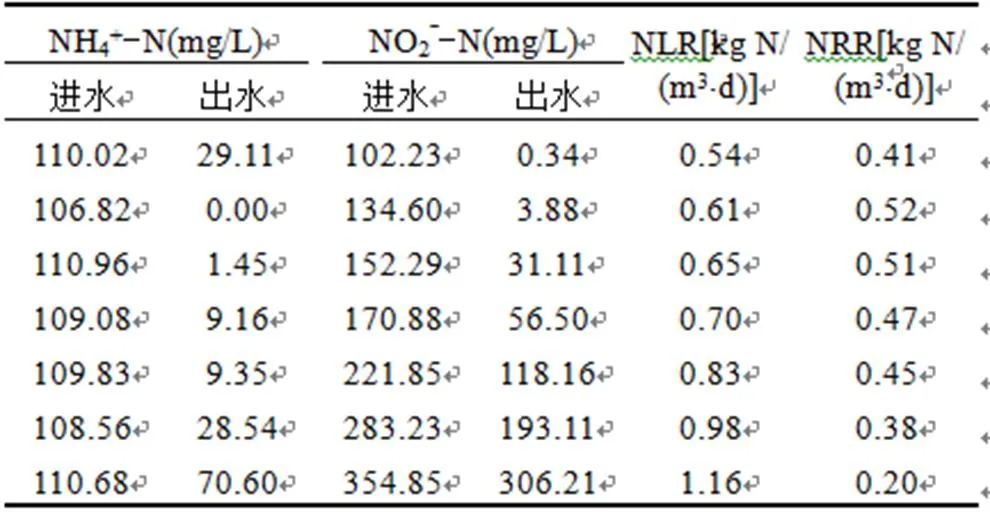
如图2所示,对比2,Luong模型可以较好的拟合全海水条件下NO2--N对ASBR厌氧氨氧化反应器的抑制动力学行为,Haldane模型最不适合,Edwards模型和Aiba模型具有相近的2值,但相对于Luong模型,二者的拟合效果仍然较差.四种模型均给出了最大基质转化速率(NRRmax)的值,但通过比较其相对误差可以发现,Haldane模型给出的NRRmax的相对误差最大,达到7.69%,Aiba模型给出的NRRmax的相对误差为5.77%,Edwards模型的NRRmax的相对误差为3.85%,Luong模型给出的NRRmax的相对误差仅为1.92%,说明Luong模型更适合拟合NO2--N抑制动力学.由图2(d)可以看出,随着出水NO2--N浓度的提高,Luong模型曲线呈现出凸型下降的趋势,表明:随着出水NO2--N浓度的提高,NRR快速下降,并可能出现一个NRR为零的点.Luong模型得到的NRRmax为0.53kg N/(m3·d),半饱和常数(S)为0.10mg/L,净生长停止的出水NO2--N浓度(m)为338.22mg/L,Luong动力学常数()为0.408,模型得到的NRR与实验所得的NRR之间的相对误差为1.38%±1.32%.
2.2 NO2--N对厌氧氨氧化脱氮过程的影响
全海水条件下,如图3所示,易知厌氧氨氧化反应的最大NRE为85.83%,出现在NO2--N浓度为131.61mg/L时.当进水NO2--N浓度大于131.61mg/L时,NRE出现逐渐下降的趋势,当进水NO2--N浓度为276.52mg/L时,NRE仅为39.9%.进水NO--N浓度不高于151.49mg/L时,进水NO2--N几乎不会对厌氧氨氧化的脱氮速率产生明显抑制作用,但当进水NO2--N浓度达到并超过170mg/L时,厌氧氨氧化的脱氮速率会受到其浓度提升的影响而逐渐降低.
由表2可见,3个模型均有较高的相关系数2,但是修正的Boltzmann模型和修正的Gompertz模型所获得的NREmax均与实际试验所得到的值存在较大差异,只有修正的Logistic模型得到的NREmax与实际值更为相近,其平均相对误差仅为1.95%,因此可以判断修正的Logistic模型更适合描述NO2--N非抑制状态下厌氧氨氧化反应的脱氮过程.修正的Logistic模型得到的max随着进水NO2--N浓度的提高而减小,但减小的幅度较小,可以认为进水NO2--N不高于151.49mg/L时,NO2--N几乎不会对厌氧氨氧化的脱氮过程产生明显的抑制作用.
表2 NO2--N非抑制状态下厌氧氨氧化脱氮过程拟合参数
Table 2 Parameters of ANAMMOX process kinetic at non NO2--N inhibition state
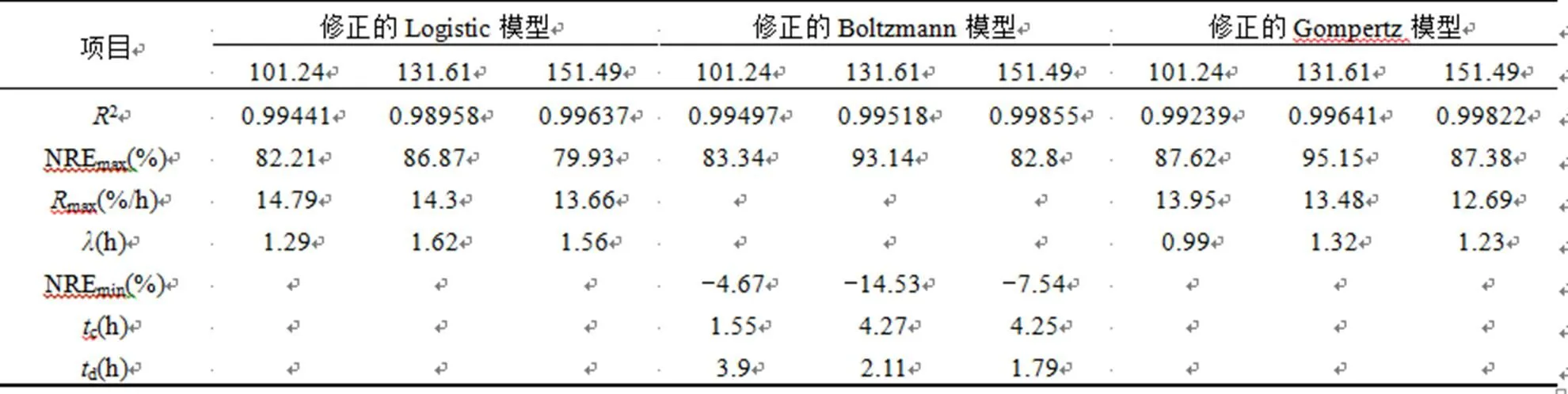
表3可见,3个模型都具有较高的相关系数,对于未完成的周期反应都给出了周期反应结束后的NREmax预测值,但修正的Boltzmann模型和修正的Gompertz模型所给出的NREmax严重偏离理论值,因此修正的Logistic模型更适合描述全海水条件下进水NO2--N有抑制时的厌氧氨氧化脱氮过程.
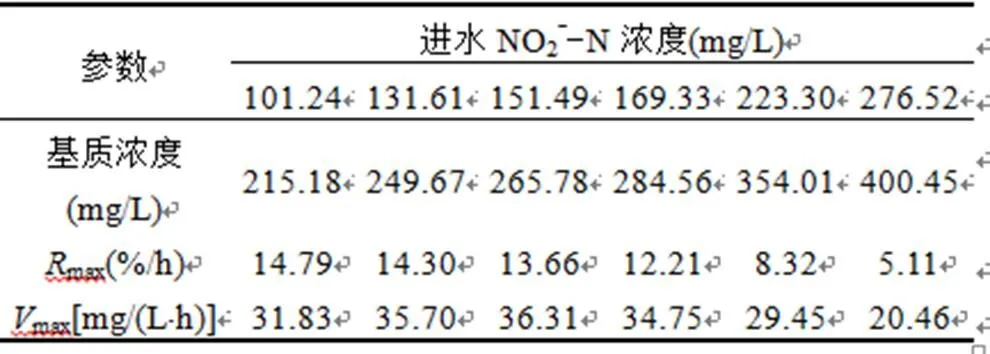
将不同进水NO2--N浓度下修正的Logistic模型得到最大脱氮速率max乘以基质浓度(进水中NH4+-N、NO2--N和NO3--N之和)即可换算成该条件下以浓度表示的最大脱氮速率max[mg/(L·h)],结果如表4所示.当进水NO2--N浓度较低时,max随着NO2--N浓度的提升而不断增加,在NO2--N浓度为151.49mg/L时达到最大值36.31mg/(L·h).随着NO2--N浓度的继续提升,max开始逐渐减小.较低浓度的NO2--N促进了厌氧氨氧化反应,较高浓度的NO2--N抑制了厌氧氨氧化反应,这与祖波[22]的研究相似.
表3 NO2--N抑制状态下厌氧氨氧化脱氮过程拟合参数
Table 3 Parameters of ANAMMOX process kinetic at nitrite inhibition state
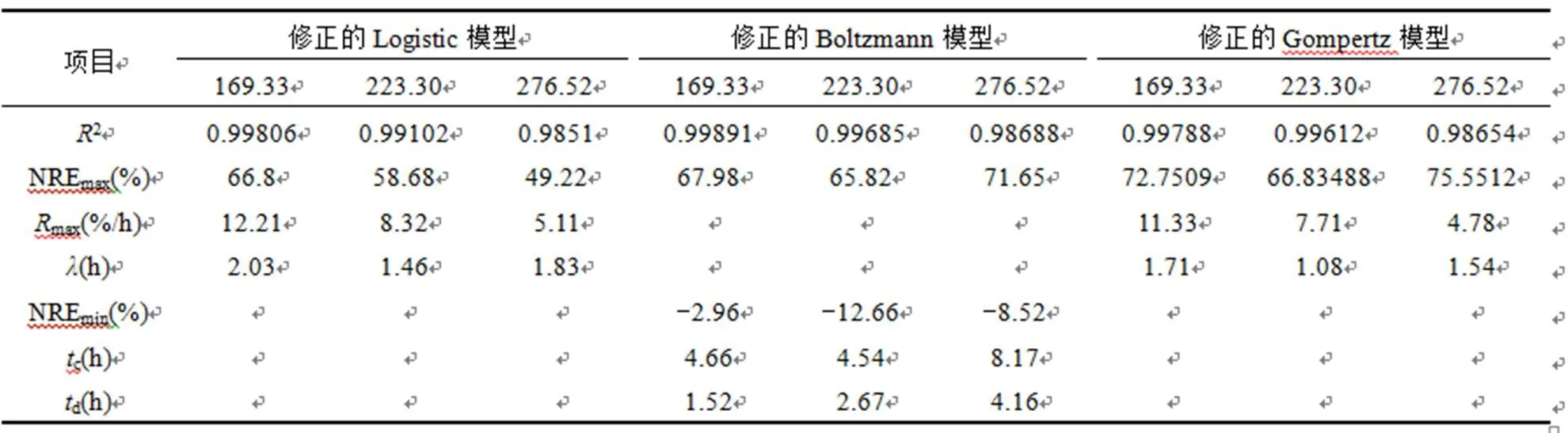
表4 NO2--N浓度对脱氮速率的影响
Table 4 The effect of NO2--N concentration on nitrogen removal rate
3 讨论
对于NO2--N的抑制动力学,文献报道的研究通常使用Haldane模型来描述NO2--N对厌氧氨氧化的基质抑制行为[10,13,22-24],但在本研究中,Haldane模型被证实是最不适合描述全海水条件下NO2--N对厌氧氨氧化菌的基质抑制行为.海水盐度和NO2--N的双重抑制作用可能是Haldane模型、Aiba模型及Edwards模型不适合描述全海水条件下NO2--N对厌氧氨氧化菌的基质抑制行为的原因.另外,通过对比其他研究者的研究可以发现,其他研究者在研究NO2--N的抑制行为时往往在较低的NO2--N浓度下做研究,而未对较高的NO2--N浓度对厌氧氨氧化菌的影响做研究,而较高浓度的NO2--N存在时,厌氧氨氧化菌的活性会急剧下降,在全海水条件下的活性可能会更低,甚至完全失去活性.对于本研究,如果在较低的出水NO2--N浓度(不高于193.11mg/L)下作Haldane模型、Aiba模型、Edwards模型及Luong模型动力学拟合(图4),可以发现Haldane模型、Aiba模型、Edwards模型及Luong模型具有较高且相近的2,4个模型的NRRmax与试验获的最大NRR的相对误差分别为3.85%、1.92%、3.85%、3.85%,但此时Luong模型给出的S值及值不具有生物学意义.出现这个现象的主要原因可能是:对于某些抑制剂,实际操作中发现存在超过某一个浓度值会完全抑制微生物的活性,而Haldane模型、Aiba模型和Edwards模型属于基质抑制作用下微生物无限生长型的模型[17],这是造成Haldane模型、Aiba模型和Edwards模型不适合模拟较高浓度的NO2--N对厌氧氨氧化的抑制作用的原因.因此可以认为:对于高浓度可以使微生物完全失活的抑制剂,Haldane模型、Aiba模型及Edwards模型不适合描述其抑制行为,宜使用Luong模型描述其抑制行为,且Luong模型得出的动力学参数更加具有指导意义,在对全海水条件下厌氧氨氧化反应器的运行条件进行优化时,可以将出水NO2--N浓度控制在338.22mg/L以下,以避免NO2--N对厌氧氨氧化菌产生的强烈抑制作用.
模型,本研究中得出的NO--N抑制常数(447.22mg/L)略低于唐崇俭等[24]的研究结果(632mg/L),远低于金仁村[25]的研究结果(924mg/L).使用Luong模型得到的厌氧氨氧化菌停止生长的出水NO2--N浓度(338.22mg/L)远低于Strous等[3]得到的NO2--N对NH4+-N氧化的抑制系数800mg/L和NO2--N对NO2--N还原的抑制系数1000mg/L.这表明:在全海水条件下,由于海水盐度的抑制作用,厌氧氨氧化菌对NO2--N的耐受力出现下降.在本研究中,当进水NO2--N浓度达到约350mg/L时,厌氧氨氧化菌仍然具有活性,此时反应器的NRR为0.20kg N/(m3·d).这与Strous等[3]、Egli等[26]、Jetten等[5]研究的NO2--N使厌氧氨氧化菌失活的浓度存在较大的差异.Strous等[3]的研究显示,100mg/L的NO2--N浓度会使分散的厌氧氨氧化菌聚合体完全失去活性,Egli等[26]的研究显示,185mg/L的NO--N浓度会使厌氧氨氧化菌完全失活,Jetten等[5]的研究则显示NO2--N浓度高于280mg/L时,厌氧氨氧化菌的活性被完全抑制.全海水条件下,经过海水盐度驯化后的厌氧氨氧化菌对NO2--N的耐受能力未见下降,反而出现增强.这种不同可能有三个方面的原因:(1)与菌群种类的不同有关.有研究认为:不同的厌氧氨氧化菌种对亚硝酸盐的耐受力不同,和对NO2--N的耐受力分别为140mg/L[26]和182mg/L[5].而研究认为经过盐度驯化后的厌氧氨氧化反应器中的优势菌群为[10,27],这在一定程度上解释了本研究中得出的较高的出水NO2--N抑制浓度.(2)与本研究中使用的块状海绵填料有关.填料在反应器内可以作为微生物的载体,并起到一定的“屏障作用”[28-29],使微生物附着在其上面,可提高厌氧氨氧化菌的环境适应能力[30],进而提高了抗基质抑制与抗海水盐度抑制的能力.(3)与前期的海水盐度驯化有关.有研究表明:厌氧氨氧化菌在极端的高盐环境下可以产生更多的胞外聚合物(EPS)来抵御极端的环境[31-32],这些胞外聚合物可用于厌氧氨氧化菌屏蔽部分NO--N毒性.
在盐度和NO2--N双重抑制作用存在时,过程动力学模型的适用性与李伟刚等[13]的研究存在些许的差异,Boltzmann模型并不适合模拟高盐度和NO2--N抑制时ASBR反应器的脱氮过程动力学,这种改变与高盐度和高浓度NO2--N改变厌氧氨氧化菌的某些内在特质(如:酶活性等)的变化有很大关系.
对于是离子态的NO2-(INi)还是游离态的HNO2(FNA)真正对厌氧氨氧化菌产生抑制并没有达成共识.一些学者[33-34]认为,FNA是亚硝酸盐抑制厌氧氨氧化的真正抑制剂,而Lotti等[35]则认为INi是厌氧氨氧化菌真正的抑制剂.比较中立的研究认为,当pH<7.1时,FNA起主要的抑制作用,当pH>7.1时,INi起主要的抑制作用[36].起主要的抑制作用.虽然对于哪种物质起真正抑制作用上存在分歧,但目前的研究普遍认为厌氧氨氧化菌遭到NO2--N抑制后可以通过添加厌氧氨氧化反应的中间产物羟胺或者肼使其恢复活性[3,37].
4 结论
4.1 低浓度(进水不高于150mg/L)的NO2--N会促进厌氧氨氧化脱氮速率,较高浓度(进水高于170mg/L)的NO2--N会抑制厌氧氨氧化反应的进行.进水NO2--N浓度达到170mg/L时,厌氧氨氧化反应器的脱氮效能开始受到明显抑制作用,出水NH4+-N的去除率约下降至91.59%.进水NO2--N浓度达到约350mg/L时,出水NH4+-N的去除率下降至36.28%.
4.2 Luong模型适合拟合全海水条件下出水NO2--N浓度对厌氧氨氧化脱氮效能的抑制动力学行为,模型得到的NRRmax为0.53kg N/(m3·d),半饱和常数(S)为0.10mg/L,净生长停止的出水NO2--N浓度(m)为338.22mg/L,Luong动力学常数()为0.408,相关系数为0.97801.在对全海水条件下厌氧氨氧化反应器的运行条件进行优化时,可以将出水NO2--N浓度控制在338.22mg/L以下,以避免NO2--N对厌氧氨氧化菌产生的强烈抑制作用.
4.3 修正的Logistic模型相较于修正的Boltzmann模型和修正的Gompertz模型更适合描述全海水条件下NO2--N抑制和非抑制状态下厌氧氨氧化脱氮过程动力学.
Strous M, Heijnen J, Kuenen J, et al. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms [J]. Applied Microbiology and Biotechnology, 1998,50(5):589-596.
Dapena-Mora A, Fernández I, Campos J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production [J]. Enzyme and Microbial Technology, 2007,40(4):859-865.
Strous M, Kuenen J G, Jetten M S. Key physiology of anaerobic ammonium oxidation [J]. Applied and Environmental Microbiology, 1999,65(7):3248-3250.
丁 爽.厌氧氨氧化关键技术及其机理的研究 [D]. 杭州:浙江大学, 2014.
Jetten M S, Strous M, Van De Pas-Schoonen K T, et al. The anaerobic oxidation of ammonium [J]. FEMS Microbiology Reviews, 1998,22(5):421-437.
Kimura Y, Isaka K, Kazama F, et al. Effects of nitrite inhibition on anaerobic ammonium oxidation [J]. Applied Microbiology and Biotechnology, 2010,86(1):359-365.
Chen Y, Cheng J J, Creamer K S. Inhibition of anaerobic digestion process: a review [J]. Bioresource Technology, 2008, 99(10):4044-4064.
Yi Y, Yong H, Huiping D. Effect of salt on Anammox process [J]. Procedia Environmental Sciences, 2011,10,Part C(0):2036-2041.
Kartal B, Koleva M, Arsov R, et al. Adaptation of a freshwater anammox population to high salinity wastewater [J]. Journal of Biotechnology, 2006,126(4):546-553.
李智行,张 蕾,陈晓波,等.高效耐海水型厌氧氨氧化污泥的驯化 [J]. 中国环境科学, 2015,(3):748-756.
Sheintuch M, Tartakovsky B, Narkis N, et al. Substrate inhibition and multiple states in a continuous nitrification process [J]. Water Research, 1995,29(3):953-963.
Surmacz-Gorska J, Gernaey K, Demuynck C, et al. Nitrification monitoring in activated sludge by oxygen uptake rate (OUR) measurements [J]. Water Research, 1996,30(5):1228-1236.
李伟刚,于德爽,李 津.ASBR反应器厌氧氨氧化脱氮Ⅱ:反应动力学 [J]. 中国环境科学, 2013,33(12):2191-2200.
金仁村,阳广凤,马 春,等.逆流湍动床短程硝化反应器的运行性能及基质抑制动力学模型 [J]. 环境科学, 2011,32(1):217- 224.
Edwards V H. The influence of high substrate concentrations on microbial kinetics [J]. Biotechnology and Bioengineering, 1970, 12(5):679-712.
Aiba S, Shoda M, Nagatani M. Kinetics of product inhibition in alcohol fermentation [J]. Biotechnology and Bioengineering, 1968,10(6):845-864.
Luong J H T. Generalization of Monod kinetics for analysis of growth data with substrate inhibition [J]. Biotechnology and Bioengineering, 1987,29(2):242-248.
Jin R C, Zhang Q Q, Yang G-F, et al. Evaluating the recovery performance of the ANAMMOX process following inhibition by phenol and sulfide [J]. Bioresource Technology, 2013,142:162- 170.
Wang J, Wan W. Kinetic models for fermentative hydrogen production: a review [J]. International Journal of Hydrogen Energy, 2009,34(8):3313-3323.
Jin R C, Yang G F, Zhang Q Q, et al. The effect of sulfide inhibition on the ANAMMOX process [J]. Water Research, 2013,47(3):1459-1469.
Yang G F, Zhang Q Q, Jin R C. Changes in the nitrogen removal performance and the properties of granular sludge in an Anammox system under oxytetracycline (OTC) stress [J]. Bioresource Technology, 2013,129:65-71.
祖 波.厌氧氨氧化甲烷化反硝化耦合的机理及动力学研究 [D]. 重庆:重庆大学, 2007.
唐崇俭,熊 蕾,王云燕,等.高效厌氧氨氧化颗粒污泥的动力学特性 [J]. 环境科学, 2013,34(9):3544-3551.
唐崇俭,郑 平,陈小光.厌氧氨氧化工艺的基质抑制及其恢复策略 [J]. 应用基础与工程科学学报, 2010,18(4):561-570.
金仁村.自养型生物脱氮反应器性能的研究 [D]. 杭州:浙江大学, 2007.
Egli K, Fanger U, Alvarez P J J, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate [J]. Archives of Microbiology, 2001,175(3):198-207.
Kartal B, Koleva M, Arsov R, et al. Adaptation of a freshwater anammox population to high salinity wastewater [J]. Journal of Biotechnology, 2006,126(4):546-553.
Wiesmann U. Biological nitrogen removal from wastewater [J]. Biotechnics/Wastewater, 1994:113-154.
Antileo C, Werner A, Ciudad G, et al. Novel operational strategy for partial nitrification to nitrite in a sequencing batch rotating disk reactor [J]. Biochemical Engineering Journal, 2006,32(2): 69-78.
于英翠,高大文,陶 或.利用序批式生物膜反应器启动厌氧氨氧化研究 [J]. 中国环境科学, 2012,32(5):843-849.
Jin R C, Ma C, Yu J J. Performance of an Anammox UASB reactor at high load and low ambient temperature [J]. Chemical Engineering Journal, 2013,232(0):17-25.
Ismail S, De La Parra C, Temmink H, et al. Extracellular polymeric substances (EPS) in upflow anaerobic sludge blanket (UASB) reactors operated under high salinity conditions [J]. Water Research, 2010,44(6):1909-1917.
Fernández I, Dosta J, Fajardo C, et al. Short and long-term effects of ammonium and nitrite on the Anammox process [J]. Journal of Environmental Management, 2012,95:S170-S174.
Egli K, Fanger U, Alvarez P J, et al. Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate [J]. Archives of Microbiology, 2001,175(3):198-207.
Lotti T, Van Der Star W, Kleerebezem R, et al. The effect of nitrite inhibition on the anammox process [J]. Water Research, 2012,46(8):2559-2569.
Puyol D, Carvajal-Arroyo J, Sierra-Alvarez R, et al. Nitrite (not free nitrous acid) is the main inhibitor of the anammox process at common pH conditions [J]. Biotechnology Letters, 2014,36(3): 547-551.
Bettazzi E, Caffaz S, Vannini C, et al. Nitrite inhibition and intermediates effects on Anammox bacteria: a batch-scale experimental study [J]. Process Biochemistry, 2010,45(4):573- 580.
* 责任作者, 教授, ljin0532@126.com
Treating sewage with seawater by ANAMMOX process: effects of nitrite and kinetics
YU De-shuang, QI Pan-qing, LI Jin*, WEI Si-jia, GUAN Yong-jie
(School of Environmental Science and Engineering, Qingdao University, Qingdao 266071, China). China Environmental Science, 2016,36(5):1400~1408
An anaerobic sequencing batch reactor (ASBR) was operated to investigate the effects of nitrite on nitrogen removal via ANAMMOX by keeping influent ammonia nitrogen concentration as 110mg/L and increasing influent nitrite concentration at whole seawater condition. The kinetics features were also studied at the same time. ANAMMOX process began to be inhibited when the influent nitrite concentration was 170mg/L, and the ammonia nitrogen removal efficiency decreased 8.41%. The fitting of modified Logistic process kinetics model showed that influent nitrite less than 151.49mg/L would increase the nitrogen removal rate, while influent nitrite higher than 170mg/L would inhibited the nitrogen removal rate. The model of Luong suited to fit the inhibition kinetics with higher nitrite concentration which affected nitrogen removal efficiency. The maximum substrate removal rate (NRRmax) obtained by Luong model was 0.53kg N/(m3·d), and the half-saturation constant (S) was 0.10mg/L. The maximum allowable effluent nitrite concentration above which cells do not grow (m) was predicted to be 338.22mg/L and the correlation () was 0.97801.
seawater;ANAMMOX;nitrite;inhibition kinetics;process kinetics
X703.5
A
1000-6923(2016)05-1400-09
于德爽(1964-),男,山东青岛人,教授,博士,主要从事水处理方面研究.发表论文30余篇.
2015-10-16
国家自然科学基金(51278258;51478229);山东省自然科学基金(BS2015HZ007);山东省高等学校科技计划项目(J15LC61);青岛市应用基础研究项目(13-1-4-203-jch)
