腺病毒介导的BMP-2基因诱导脂肪间充质干细胞向成骨细胞定向分化
2016-10-11邵云峰刘俊杰
邵云峰,刘俊杰,陈 能
实验研究
腺病毒介导的BMP-2基因诱导脂肪间充质干细胞向成骨细胞定向分化
邵云峰,刘俊杰,陈 能
目的探讨人骨形态发生蛋白-2(BMP-2)基因通过腺病毒转染青山羊脂肪间充质干细胞(ADSCs)的可行性及其向成骨细胞定向分化的能力。方法取麻醉状态下青山羊腹股沟脂肪组织,经体外分离培养获得ADSCs,转染以腺病毒介导的人BMP-2基因。倒置相差显微镜观察细胞形态,MTT法检测ADSCs生长增殖情况,免疫细胞化学法对ADSCs细胞进行碱性磷酸酶(ALP)活性测定,SABC法检测ADSCsⅠ型胶原的表达,通过RT-PCR、Western blot法检测BMP-2基因的表达水平。结果转染人BMP-2基因的ADSCs形态规则;细胞生长速度快,且随培养时间的延长逐渐增多(P<0.05);成骨诱导后,转染组细胞ALP活性和Ⅰ型胶原表达强度明显高于未转染组(P<0.05);转染组ADSCs BMP-2基因mRNA水平和蛋白含量均明显强于未转染组(P<0.05)。结论经腺病毒介导的人BMP-2基因转染的青山羊ADSCs在体外诱导培养中可以向成骨细胞定向分化,并保持较强的增殖能力;转染后细胞BMP-2目的基因表达增高。
脂肪间充质干细胞;骨形态发生蛋白质类;腺病毒科;转染;细胞,培养的;细胞分化;成骨细胞
【Abstract】Objective To investigate the feasibility of human bone morphogenetic protein-2(BMP-2)gene transfection into grey goat adipose tissue-derived mesenchymal stem cells(ADSCs)by adenovirus vector,and to explore the directional differentiation potential of ADSCs into osteoblasts.Methods Inguinal fat tissue was excised from anaesthetized grey goat,and then ADSCs were obtained by isolation and culture in vitro.After the human BMP-2 transfection by adenovirus,inverted phase contrast microscope was used to observe the morphology of ADSCs,cell growth was measured by MTT test,alkaline phosphatase(ALP)activity of ADSCswas examined by immunocytochemistry method,expression of collagenⅠ was measured by SABC method,also,expression levels of BMP-2 gene were measured by RT-PCR and Western blot tests.Results After hmuan BMP-2 transfection by adenovirus,the morphology of ADSCs became regular;Cells grew up rapidly with increasing tendency with culture time going by(P<0.05);After osteoinduction,ALP activity and collagenⅠexpression intensity in transfection group showed significant higher than those in control group(P<0.05);The expression levels of mRNA and protein content of BMP-2 in transfection group were significantly higher than those in control group(P<0.05).Conclusion Grey goat's ADSCs transfected by adenovirus vector carrying human BMP-2 gene have the potential of directional differentiation into osteoblasts and good proliferation ability,moreover,the expression of BMP-2 gene become increasing after transfection.
【Key words】Adipose tissue-derived mesenchymal stem cells;Bone morphogenetic proteins;Adenoviridae;Transfection;Cells,cultured;Cell differentiation;Osteoblasts
种子细胞的选择是骨组织工程研究中的基本环节,其核心问题是如何获取性状稳定、增殖及成骨能力强、适合临床应用的种子细胞。脂肪间充质干细胞(adipose tissue-derived mesenchymal stem cells,ADSCs)具有较强的增殖能力和多向分化潜能,并可人工分离、培养及体外扩增,近年来受到研究者的青睐[1-2]。骨形态发生蛋白(bone morphogenetic protein,BMP)是在脱矿化骨及其提取物中发现的一种具有异位成骨能力的生长因子,能够在体内外诱导间充质干细胞分化为成骨细胞,进而诱导新骨形成[3-5]。本实验以青山羊为研究对象,探讨青山羊ADSCs细胞的生长增殖特性,评估人BMP-2基因通过腺病毒转染青山羊ADSCs的可行性及其向成骨细胞定向分化的能力,为其在骨组织工程领域的应用奠定实验基础。
1 材料与方法
1.1 主要试剂及仪器
低糖DMEM培养液、胰酶(Gibco公司,美国),胎牛血清(Hyclone公司,美国),BMP-2 (Santa Cruze公司,美国),碱性磷酸酶(alkaline phosphatase,ALP)试剂盒、Western blot显色试剂盒(北京中山生物技术公司),Ⅰ型胶原酶、地塞米松、维生素C(Sigma公司,美国),Triton X-100、兔抗CD29/CD34/CD44/CD45单克隆抗体、异硫氰酸荧光素(FITC)标记抗兔IgG(北京中杉金桥生物技术有限公司),重组人BMP-2腺病毒载体质粒(pAd-BMP-2)(哈佛大学麻省总医院John F. Mankin教授惠赠),PCR试剂盒(Clontech公司,美国),RT试剂盒(Fermentas公司,加拿大),PCR纯化试剂盒(Roche公司,德国);流式细胞仪(Becton Diskinson公司,美国),倒置相差显微镜(Olimpus公司,日本),CO2培养箱(ThermoForma公司,美国),恒温水浴箱(姜堰市新康医疗器械有限公司)。
1.2 山羊ADSCs的分离、纯化和增殖
取健康3月龄青山羊1只(由中南大学湘雅二医院实验动物部提供),采用3%戊巴比妥钠按30 mg/kg剂量麻醉,无菌条件下取腹股沟皮下脂肪组织于超净工作台内充分剪碎,加入与脂肪组织等体积的0.1%Ⅰ型胶原酶,恒温水浴箱消化60 min,终止消化后以1 000 r/min离心10 min,去除上层脂肪和上清液后,离心管内加入培养液重悬细胞,待细胞均匀分布后接种于培养瓶内,每隔2~3 d更换细胞培养基,待细胞生长至融合率达90%时,按1∶2~1∶3比例传代接种,根据细胞计数法测绘其生长曲线,留取第3代细胞备用。
1.3 流式细胞仪检测细胞表面抗原
予0.25%胰蛋白酶消化收集传3代ADSCs,1 000 r/min离心10 min,PBS重悬细胞。调整细胞浓度至1×106/mL,分装,分别滴加饱和浓度的兔抗CD29、CD34、CD44、CD45单克隆抗体,室温下反应30 min,PBS液洗涤2次,与FITC标记抗兔IgG二抗避光作用30 min,PBS液洗涤并重悬细胞,上机进行流式细胞仪分析。
1.4 pAd-BMP-2重组腺病毒转染ADSCs
取生长良好的第3代青山羊ADSCs于12孔板中培养,pAd-BMP-2重组腺病毒感染细胞后继续培养,倒置相差显微镜观察细胞生长情况及形态变化。将转染BMP-2的ADSCs作为实验组,未转染者为对照组。两组均置于不含BMP-2的成骨诱导培养基(即10 mmol/L β-甘油磷酸钠、50 mg/L抗坏血酸、1×10-8mol/L地塞米松溶于含10%胎牛血清的低糖DMEM液)中进行ADSCs成骨诱导分化。
1.5 MTT法检测细胞生长与增殖
取10枚96孔板,每枚96孔板以5×103/孔的密度将第3代转染或未转染pAd-BMP-2的ADSCs各接种于5个孔中,每孔加入含10%胎牛血清的低糖DMEM液200 μL;另外5个无细胞孔作为空白对照孔,仅加入含10%胎牛血清的低糖DMEM液200 μL。置入37℃、5%CO2培养箱中培养,每三天换液1次,此后每天同一时间分别随机抽取转染、未转染及空白对照孔各1板,MTT法测定光密度(optical density,OD)值。
1.6 ALP活性测定
取生长良好的第三代转染或未转染pAd-BMP-2的ADSCs,以1×105/mL密度接种于24孔板中,每孔500 μL。1 d后分为对照组(不更换培养基)和成骨诱导组(更换成骨诱导培养基进行成骨诱导)。分别于培养3、7、10、14 d收集细胞,调整细胞浓度至1×105/mL,取1 mL细胞悬液进行细胞内ALP活性测定,每个时间点取6孔。将细胞悬液以1 000 r/min离心10 min;弃上清,加入1 mL 1%的Triton X-100,反复吹打,使胞浆外流,收集细胞于EP管内,按试剂盒操作说明进行ALP含量测定。
1.7 SABC法检测Ⅰ型胶原表达
取生长良好的第3代转染或未转染pAd-BMP-2的ADSCs,以1×105/mL密度接种于6孔板中,每孔2 mL。1 d后分为对照组(不更换培养基)和成骨诱导组(更换成骨诱导培养基进行成骨诱导)。诱导7 d时取出盖玻片,采用SABC法检测标本中Ⅰ型胶原表达,以PBS代替一抗作空白对照。
1.8 RT-PCR和Western blot法检测ADSCs BMP-2表达
取生长良好的第三代转染或未转染pAd-BMP-2的ADSCs,以1×105/mL密度接种于6孔板中,每孔2 mL。1 d后分为对照组(不更换培养基)和成骨诱导组(更换成骨诱导培养基进行成骨诱导)。分别于培养7、14 d对BMP-2 mRNA和蛋白表达进行RT-PCR和Western-blot检测。
1.9 统计学方法
应用SPSS 19.0统计软件进行分析,符合正态分布的计量资料以均数±标准差(±s)表示,两组比较采用两独立样本t检验或配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 ADSCs表面抗原检测
流式细胞仪检测结果显示,95%以上的青山羊ADSCs传3代细胞表达CD44和CD29,约5%的细胞表达CD34和CD45,表明分离培养的传3代细胞表型均一,基本符合间充质干细胞的表型特点。
2.2 ADSCs形态特征及pAd-BMP-2转染后生长情况
原代培养的青山羊ADSCs细胞在接种4~6 h后开始贴壁,初为小圆形,培养48 h后可见细胞以群落或散在方式贴壁生长,呈圆形或多角形,细胞折光性好(图1);而转染pAd-BMP-2的ADSCs细胞形态规则且类似于成骨细胞(图2),细胞生长速度快。
2.3 转染组和未转染组ADSCs生长动力学分析
根据MTT法测定的第三代转染或未转染pAd-BMP-2的ADSCs各时间点OD值,绘制出细胞生长曲线(图3)。转染或未转染组ADSCs增殖能力存在差异,生长曲线均呈“S”形。转染组ADSCs经历1~2 d的滞缓期后,3~4 d时进入对数生长期,5 d左右可单层融合,进入生长平台期;未转染组ADSCs增殖能力减弱,平均滞缓期约3 d,接种后5~9 d处于对数生长期,进入平台期时间延长。转染和未转染组ADSCs对数生长期细胞倍增时间分别为(30±6)h和(41±6)h,两组比较,差异有统计学意义(t=2.899,P=0.020)。

图1 原代培养48 h的青山羊脂肪间充质干细胞(×40)充质干细胞(×40)

图2 第三代转染腺病毒介导BMP-2基因的脂肪间
2.4 转染组和未转染组ADSCsALP活性测定
未转染组ADSCs成骨诱导第三天,细胞内ALP水平开始升高,随诱导时间的延长,ALP水平增加更为明显;而转染组ADSCs成骨诱导过程中相同时相点ALP含量显著高于未转染组(P<0.05,图4)。
2.5 Ⅰ型胶原表达
成骨诱导后Ⅰ型胶原免疫细胞化学染色呈阳性,可见棕黄色颗粒分布于细胞胞浆内,胞核周围尤为明显(图5A,5B);未成骨诱导的ADSCs细胞内未见棕黄色颗粒(图5C,5D)。转染组ADSCsⅠ型胶原免疫细胞化学染色表达强度明显高于未转染组ADSCs(图5B,5D)。
2.6 ADSCs BMP-2 mRNA和蛋白表达
RT-PCR检测结果表明,扩增后转染组和未转染组均有BMP-2 mRNA表达。转染组青山羊ADSCs成骨诱导培养7 d时BMP-2 mRNA表达最强,14 d时表达减弱;未转染组BMP-2 mRNA表达量7 d后也随培养时间的延长而逐渐降低。转染组成骨诱导7、14 d时BMP-2 mRNA表达明显高于未转染组(P<0.05,图6)。
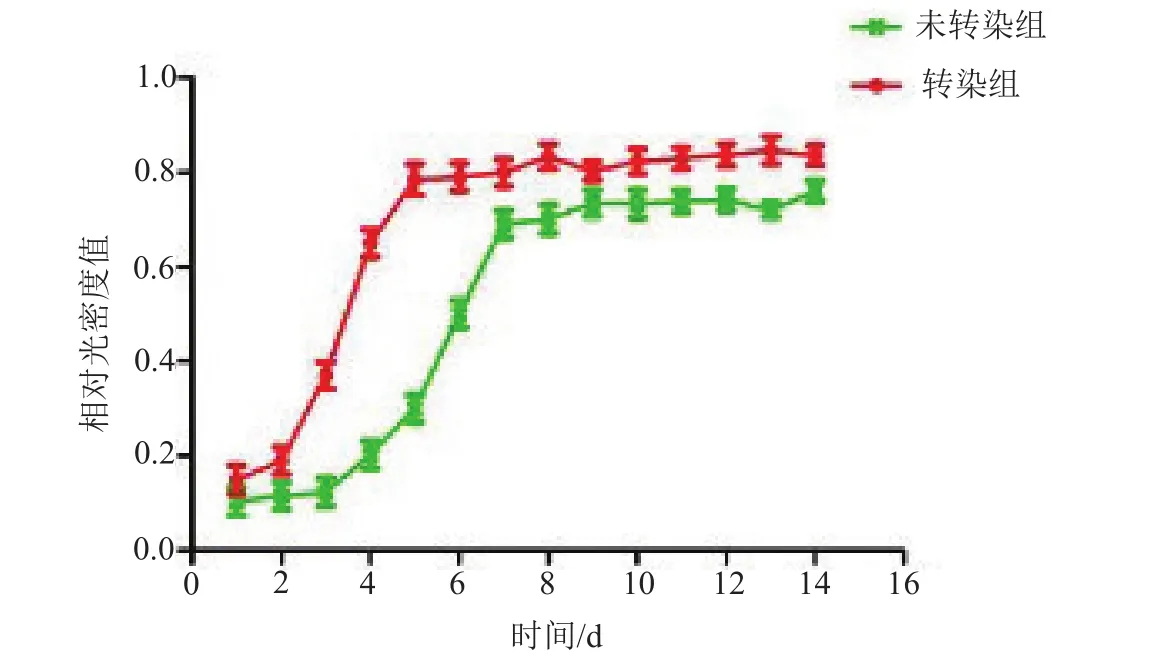
图3 第三代转染和未转染腺病毒介导BMP-2基因的脂肪间充质干细胞生长曲线
Western检测结果表明,转染组和未转染组均有BMP-2蛋白表达。转染组青山羊ADSCs成骨诱导7 d BMP-2蛋白表达最强,14 d BMP-2蛋白表达减弱,提示ADSCs在向成骨诱导过程中BMP-2呈现先增强后减弱的趋势;未转染组BMP-2蛋白表达亦呈现相类似的趋势。转染组成骨诱导7、14 d时BMP-2蛋白表达明显高于未转染组(P<0.05,图7)。
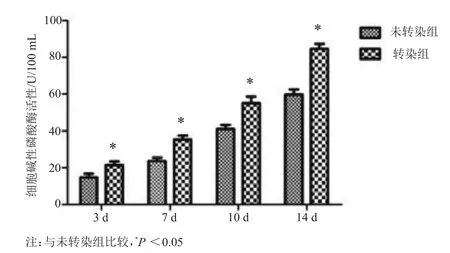
图4 第三代转染和未转染腺病毒介导BMP-2基因的脂肪间充质干细胞碱性磷酸酶活性

图5 转染组和未转染组Ⅰ型胶原免疫细胞化学染色结果(×100)5A未转染组脂肪间充质干细胞(ADSCs)成骨诱导 5B转染组ADSCs成骨诱导 5C未转染组ADSCs未成骨诱导(对照组)5D转染组ADSCs未成骨诱导(对照组)

图6 转染组和未转染组脂肪间充质干细胞BMP-2 mRNA表达RT-PCR结果β-actin为内参
3 讨论
3.1 种子细胞的选择
骨折愈合过程中大段骨缺损、骨不连、肢体短缩等问题一直是骨科领域的治疗难点,如何加快骨再生速度、促进术后骨愈合,是临床上亟待解决的问题。近年来组织工程、干细胞及基因治疗研究的不断深入为解决上述问题提供了新的思路[6-7]。而就骨组织工程领域而言,种子细胞的选择是第一步,也是最为关键的环节[8]。大多学者认为,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是组织工程骨的首选种子细胞[9],但成人骨髓量有限,骨髓中干细胞所占比例少,数量也随年龄增加而呈减少趋势,这在一定程度上限制了BMSCs的应用。ADSCs则易于摆脱伦理、道德、法律等不利因素的限制,提取方法相对简单,从脂肪组织中能获取的数量较多,在体外易于进行分离、培养和扩增等,更重要的是,ADSCs在多次传代培养后仍能维持其基因稳定性,具备了成为骨组织工程理想种子细胞的基本条件,应用前景广阔[10]。
3.2 腺病毒作为目的基因载体的可行性
目前常用的病毒载体主要有腺病毒、逆转录病毒、腺相关病毒等。其中前两种病毒载体应用较为普遍,尤其是腺病毒载体,具有制备简单、转染率高、免疫排斥反应低、外源基因表达水平高、病毒颗粒稳定、无癌变倾向等优点[11]。本实验RT-PCR检测结果显示,ADSCs成骨诱导培养7、14 d,转染组目的基因BMP-2条带明显亮于未转染组,Western blot检测结果也证实成骨诱导培养7、14 d时上清液中检测到BMP-2,且转染组ADSCs BMP-2表达明显高于未转染组。上述结果均提示BMP-2基因已被成功转入ADSCs,腺病毒是该基因的良好载体。
3.3 BMP-2对ADSCs成骨细胞分化的诱导作用
BMP的一个重要生物学作用是诱导未分化的间质细胞分化成为软骨和骨,其中以BMP-2的成骨能力最强。作为启动骨修复过程的关键基因,BMP-2不仅能够促进成骨细胞分化和诱导体外成骨,同时还具有使ADSCs定向分化为成骨细胞的能力,进而起到诱导新骨形成、有效促进机体成骨功能的作用[12-14]。目前BMP-2已广泛应用于骨缺损、骨不连、骨质疏松患者及各种骨科手术,取得了较好的应用效果[15-16]。
本实验采用MTT法检测ADSCs的细胞增殖能力,结果显示,实验组和对照组的生长曲线均呈上升趋势,说明随着时间的延长,细胞数量增多,符合细胞生长的一般规律。转染组ADSCs在体外培养条件下的生长与其他细胞同样经历了生长滞缓期、对数增殖期和生长平台期。转染组和未转染组ADSCs对数生长期细胞倍增时间差异有统计学意义(P<0.05),说明BMP-2在一定时间范围内可能促进ADSCs的增殖,但其对ADSCs增殖的影响是否具有时间和剂量依赖性,仍需进一步的深入研究。

图7 转染组和未转染组脂肪间充质干细胞BMP-2蛋白表达Western blot结果 β-actin为内参
Ⅰ型胶原是构成骨基质的主要成分,它可通过蛋白激酶靶蛋白磷酸化来增加细胞蛋白的合成,还可活化Na+/H+交换系统,促进成骨细胞的黏附、增殖和分化,并可促进新骨形成。本实验通过免疫细胞化学方法检测Ⅰ型胶原的表达情况,发现转染组ADSCs细胞强阳性表达,说明BMP-2可促进ADSCs定向分化,并诱导成骨。
骨细胞群体外实验中ALP活性增高被认为是成骨细胞分化的指标[17]。本实验结果表明,转染BMP-2基因的ADSCs经诱导后ALP表达量增加,提示BMP-2基因可促进ALP的合成和分泌,证实转染后的ADSCs具有向成骨细胞定向分化的能力;RT-PCR和Western检测结果亦提示,转染组ADSCs在成骨诱导培养基中可诱导分化为成骨细胞,并能实现骨诱导因子BMP-2的局部阶段性稳定释放。
总之,我们从青山羊腹股沟脂肪组织中成功获取大量ADSCs,并通过腺病毒将BMP-2基因转染到ADSCs中;转染后的ADSCs不仅成为内源性BMP-2的局部来源,而且还提供了激活BMP-2自身效应的靶细胞,实现了其向成骨细胞的定向分化并保持较强的增殖能力。今后通过一系列的体外研究和动物实验研究,相信ADSCs将有望成为骨组织工程中理想的种子细胞。
[1]Chung DJ,Hayashi K,Toupadakis CA,et al.Osteogenic proliferation and differentiation of canine bone marrow and adipose tissue derived mesenchymal stromal cells and the influence of hypoxia[J].Res Vet Sci,2012,92(1):66-75.
[2]Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13 (12):4279-4295.
[3]Scarfi S.Use of bone morphogenetic proteins in mesenchymal stem cell stimulation of cartilage and bone repair[J].World J Stem Cells,2016,8(1):1-12.
[4] CarreiraAC,AlvesGG,ZambuzziWF,etal.Bone morphogenetic proteins:structure,biological function and therapeutic applications[J].Arch Biochem Biophys,2014 (561):64-73.
[5]徐小良,戴克戎,汤亭亭,等.腺病毒介导的人骨形态发生蛋白2基因修复兔桡骨缺损[J].中华创伤杂志,2002,18(11):677-680.
[6]Amini AR,Laurencin CT,Nukavarapu SP.Bone tissue engineering:recent advances and challenges[J].Crit Rev Biomed Eng,2012,40(5):363-408.
[7]Gamie Z,Tran GT,Vyzas G,et al.Stem cells combined with bone graft substitutes in skeletal tissue engineering[J].Expert Opin Biol Ther,2012,12(6):713-729.
[8]Wang X,Wang Y,Gou W,et al.Role of mesenchymal stem cells in bone regeneration and fracture repair:a review[J]. Int Orthop,2013,37(12):2491-2498.
[9]Dai F,Shi D,He W,et al.hCTLA4-gene modified human bone marrow-derived mesenchymal stem cells as allogeneic seed cells in bone tissue engineering[J].Tissue Eng,2006,12 (9):2583-2590.
[10]Liu G,Zhang Y,Liu B,et al.Bone regeneration in a canine cranial model using allogeneic adipose derived stem cells and coral scaffold[J].Biomaterials,2013,34(11):2655-2664.
[11]van Griensven M,Lobenhoffer P,Barke A,et al.Adenoviral gene transfer in a rat fracture model[J].Lab Anim,2002,36 (4):455-461.
[12]Lee SJ,Kim BJ,Kim YI,et al.Effect of recombinant human bone morphogenetic protein-2 and adiposetissue-derived stem cell on new bone formation in high-speed distraction osteogenesis[J].Cleft Palate Craniofac J,2016,53(1):84-92.
[13]Knippenberg M,Helder MN,Doulabi BZ,et al.Differential effects of bone morphogenetic protein-2 and transforming growth factor-beta1 on gene expression of collagen-modifying enzymes in human adipose tissue-derived mesenchymal stem cells[J].Tissue Eng Part A,2009,15(8):2213-2225.
[14]Schneider H,Sedaghati B,Naumann A,et al.Gene silencing of chordin improves BMP-2 effects on osteogenic differentiation of human adipose tissue-derived stromal cells [J].Tissue Eng Part A,2014,20(1-2):335-345.
[15]黄晖,杨志.骨形态发生蛋白在骨组织工程中的临床应用[J].中国组织工程研究与临床康复,2007,11(2):340-343.
[16]Baltzer AW,Ostapczuk MS,Stosch D,et al.The use of recombinant human bone morphogenetic protein-2 for the treatmentofa delayed union following femoralneck open-wedge osteotomy[J].Orthop Rev,2012,4(1):e4.
[17]Gori F,Thomas T,Hicok KC et al.Differentiation of human marrow stromal precursor cells: bone morphogenetic protein-2 increase OSF2/CBFA1, enhance osteoblast commitment,and inhabits late adipocyte maturation[J].J Bone Miner Res,1999,14(9):1522-1535.
Osteogenic differentiation of adipose tissue-derived mesenchymal stem cells after transfection by adenovirus carrying BMP-2 gene
SHAO Yunfeng,LIU Junjie,CHEN Neng.
Department of Orthopaedics,Shenzhen Shekou People`s Hospital,Shenzhen,Guangdong 518000,China
R329.24,R318.17
A
1674-666X(2016)04-221-07
2016-05-25;
2016-06-19)
(本文编辑:白朝晖)
10.3969/j.issn.1674-666X.2016.04.005
深圳市科创委基金(20150305190447)
518000广东深圳,南山区蛇口人民医院骨科
E-mail:shaoyunfeng2006@163.com
