红花刺槐花粉生活力测定及保存方法
2016-10-10姚砚武
李 娟,姚砚武
(1.河北省沧州市盐山县农林局,河北沧州 061300;2.北京市农林科学院林业果树研究所,北京 100093)
红花刺槐花粉生活力测定及保存方法
李 娟1,姚砚武2*
(1.河北省沧州市盐山县农林局,河北沧州 061300;2.北京市农林科学院林业果树研究所,北京 100093)
[目的]研究红花刺槐花粉活力的测定及保存方法,为红花刺槐的人工杂交授粉提供参考依据。[方法]利用离体培养法、TTC法、I2-KI法测定花粉生活力,同时研究不同保存方法对红花刺槐花粉萌发的影响。[结果]红花刺槐花粉在蔗糖20.0 mg/L+硼酸2.0 mg/L的培养基中萌发率最高(29.56%);I2-KI法不适用于红花刺槐花粉活力的测定,TTC法的测定效果仍有待进一步检验;低温比常温更适于红花刺槐花粉的保存,花粉在0 ℃保存15 d后,萌发率仍达17.67%。[结论]蔗糖20.0 mg/L+硼酸2.0 mg/L为红花刺槐最适培养基组合,低温更适合红花刺槐花粉的保存。
红花刺槐;花粉活力;保存条件
红花刺槐(Robiniahisqida)为种间杂种(R.viscose×R.pseudoacacia),商业上常被称为无刺槐,刺比普通刺槐稍小,属蝶形花科刺槐属落叶乔木[1]。红花刺槐因其花色鲜艳常作为一般观赏型植物引种[2],同时红花刺槐还是优良的蜜源树种[3],穗状花序,花有香味,可食用。刘德光等[2]人对刺槐进行研究认为其结实率低,授粉受精是杂交工作的基础,花粉萌发和生长是授粉受精的关键问题。不同单株、无性系,不同种的红花刺槐,常常花期不遇,有的还表现花粉活力低、不萌发、生长差、难以实现授粉受精,从而导致杂交失败[4]。研究红花刺槐花粉的贮藏方法与生活力对其杂交育种和品种改良都具有重要意义,该研究旨在找出快速准确测定刺槐花粉活力的方法,为红花刺槐的后续杂交育种工作提供数据支撑。
1 材料与方法
1.1材料材料为北京市延庆县石佛寺野生红花刺槐,生长地地理坐标为115°50′E、40°23′N,海拔约为500 m;年平均气温8 ℃,1月最冷,平均气温-8.8 ℃,7月最热,平均气温为23.2 ℃;日照充足,年平均日照时数2 826.3 h,年平均降雨量493 mm。红花刺槐始花期一般为5月中旬,持续到6月初,约15 d。试验所需蔗糖、硼酸、琼脂、亚甲基蓝等药品均由北京化工厂提供;光学显微镜为德国麦克奥迪的Motic B series;培养箱为PYX-250G-A光照培养箱。
1.2方法2016年6月于北京市农林科学院林业果树研究所进行试验。采集即将开放的红花刺槐花蕾,预处理后带回实验室剥取花药,放于白纸上自然阴干24 h,碾压花药使其破裂散粉,过筛后将花粉放入密封小玻璃瓶中,保存待用。1.2.1培养基法测定萌发率。利用蔗糖硼酸培养基培养花粉[5],设置蔗糖浓度为0(清水对照)、10.0、15.0、20.0、25.0和30.0 mg/L共6个处理,硼酸浓度为0(清水对照)、1.0、1.5、2.0和2.5 mg/L共5个处理,共设置30组试验。待培养基冷却后用毛笔将花粉点涂在培养基上,置于25 ℃恒温培养箱保湿培养24 h,在光学显微镜下观测萌发情况,以花粉管萌发的长度超过2倍的花粉直径为萌发花粉。每载玻片取5个视野,统计100 粒,然后计算花粉萌发率,重复3 次[6]。
1.2.2染色法测定生活力。
1.2.2.1TTC法。取少量花粉置于凹载玻片上,滴2滴0.4 g/L TTC 溶液,置于35 ℃恒温箱中15 min,于显微镜下观察,有活力的花粉被染成红色[5]。每载玻片取5个视野,统计100粒,然后统计花粉生活力,重复3次。
1.2.2.2 I2-KI染色法。取少量花粉置于凹载玻片上,滴2滴I2-KI溶液,置于30 ℃恒温箱中20~30 min,在显微镜下观察,有生活力的花粉被染成蓝色,生活力衰弱或内含物少的花粉被染成黄褐色[7]。每载玻片取5个视野,统计100粒,然后统计花粉生活力,重复3 次。
1.2.3不同贮藏时间对花粉生活力的影响。试验分为常温保存(25 ℃)和低温保存(0 ℃),利用优选培养基进行培养,分别设置4个保存天数,从花粉采收后第1天算起,每5 d观察1次,每次观察2个重复,每个重复随机观察5个视野。根据所拍照片,以花粉粒直径为标准,计算花粉管长度为花粉粒直径的倍数(a),当a>1时,即可进行花粉萌发计算,花粉萌发率=观察视野内萌发总数/观察视野内花粉粒总数×100%。根据花粉管的伸长情况可判断花粉的萌发活力,花粉管伸长越快、越长,证明花粉活力越大。花粉保存方法的比较:根据2组不同贮藏条件与保存时间对照,分析花粉管的萌发长度、时间以及花粉活力,以确定花粉的最佳保存方法与时间。
2 结果与分析
2.1不同培养基浓度对红花刺槐花粉萌发率的影响由表1可知,蔗糖和硼酸浓度为0时,抑制红花刺槐花粉的萌发,在恒温箱中培养24 h的花粉萌发率仅有0.32%。当培养基中加入蔗糖和硼酸后,花粉的萌发率明显增高,随着蔗糖和硼酸浓度的增高,花粉的萌发率呈现出先上升再下降的趋势。蔗糖浓度达25.0 mg/L时,培养基中的平均花粉萌发率最高,约为21.15%,而蔗糖浓度为30.0 mg/L时,花粉萌发率明显下降。硼酸浓度为1.5 mg/L时,培养基中的平均萌发率为16.51%,硼酸浓度为2.0 mg/L时,培养基中的平均萌发率为22.98%。所有培养基中,当蔗糖浓度为20.0 mg/L、硼酸浓度为2.0 mg/L时,红花刺槐花粉的萌发率最高,达29.56%,说明只有在适量的蔗糖与硼酸组合中,才能达到相对较高的花粉萌发率。
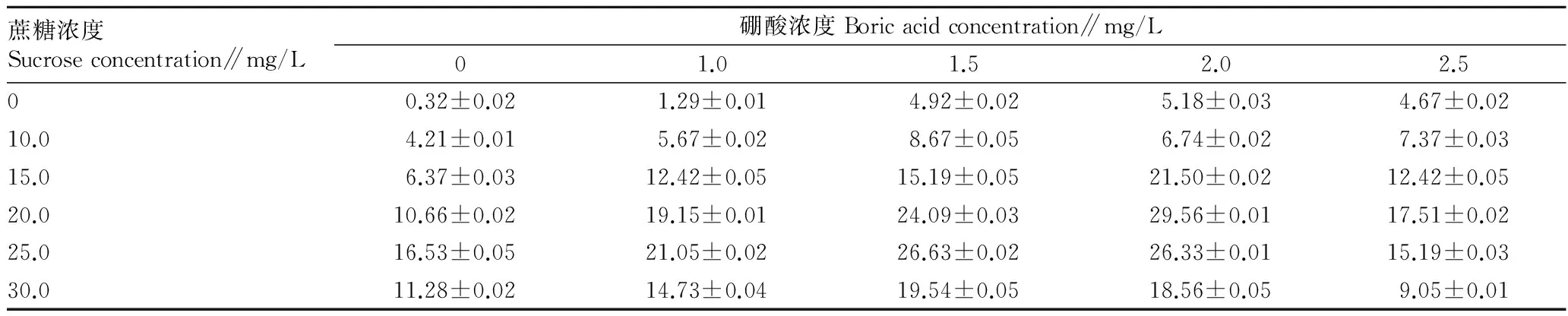
表1 不同培养基浓度对红花刺槐花粉萌发率的影响
2.2不同染色法对红花刺槐花粉生活力测定的效果由表2及图1可知,红花刺槐的花粉经I2-KI染色后,呈现红褐色和黄褐色,与花粉遇I2-KI变蓝色的理论不符,且所有的花粉均有染色,并不能以此说明所有花粉都具有生活力,可见I2-KI染色法不适合红花刺槐花粉生活力的测定。
经0.4 g/L的TTC溶液染色后,84.54%的红花刺槐花粉被染成深红色,10.00%左右的花粉被染成浅红色,未被染色的仅有5.48%,而TTC染色效果与培养基的萌发效果差别较大,TTC染色法是否可以检验花粉生活力有待讨论。

表2 不同染色法对红花刺槐花粉生活力测定的结果
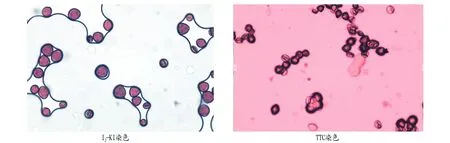
图1 I2-KI及TTC染色结果Fig.1 I2-KI and TTC staining results
2.3不同贮藏时间对花粉生活力的影响利用培养基试验中最优培养基进行不同保存时间红花刺槐的花粉萌发率测试,发现常温保存的花粉萌发更早,花粉管先开始伸长,而低温保存的花粉总体萌发率要高于常温保存的,但花粉管的伸长差距并不明显,花粉管长度基本为花粉粒直径的8~10倍。在常温和低温下保存5 d时,具有最佳萌发率,常温保存萌发率为24.91%,低温保存萌发率为31.82%。由图2和表3可知,低温保存的红花刺槐花粉的萌发率要高于常温保存的花粉,最大差距是在保存10 d时,低温保存的花粉萌发率(20.23%)要明显高于常温保存的萌发率(10.58%)。在保存过程中,由于重叠等原因,一直存在不能吸收培养液的干燥花粉粒,或者吸收了培养液而最终并没有萌发。

图2 红花刺槐在常温与低温条件下保存5 d时的萌发效果Fig.2 The germination effect of Robinia pseudoacacia stored in normal temperature and low temperature for 5 days
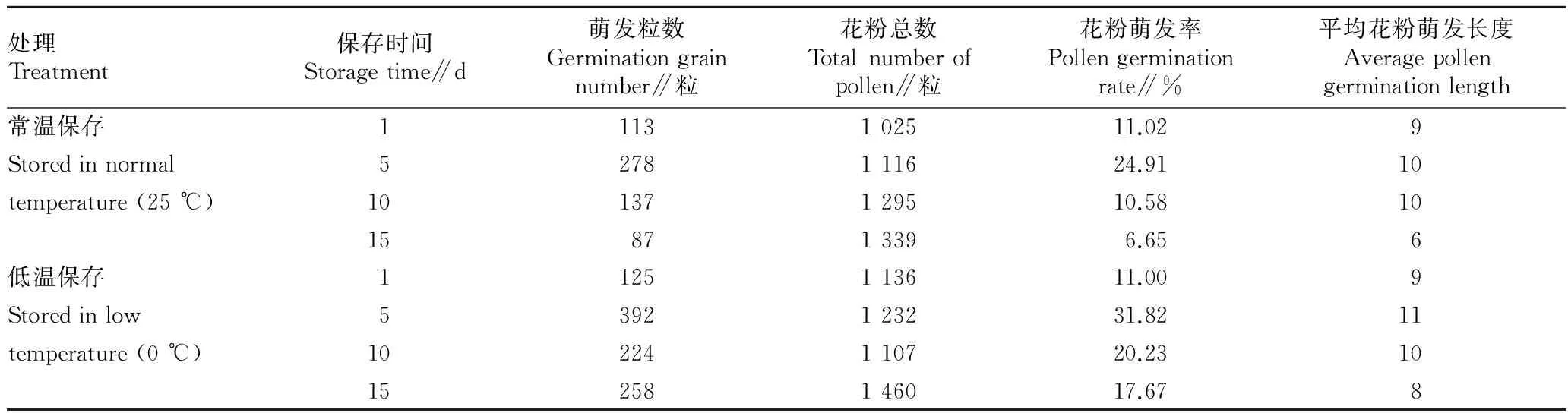
处理Treatment保存时间Storagetime∥d萌发粒数Germinationgrainnumber∥粒花粉总数Totalnumberofpollen∥粒花粉萌发率Pollengerminationrate∥%平均花粉萌发长度Averagepollengerminationlength常温保存1113102511.029Storedinnormal5278111624.9110temperature(25℃)10137129510.5810158713396.656低温保存1125113611.009Storedinlow5392123231.8211temperature(0℃)10224110720.231015258146017.678
注:花粉萌发长度为花粉粒直径的倍数。
Note:The length of pollen germination is multiple of the diameter of pollen grain.
3 结论与讨论
目前,检验花粉生活力的主要方法有染色法、离体萌发法及授粉法等[8-9],人工授粉法是鉴定花粉保存效果比较可靠和精确的方法。花粉活力不仅受遗传因素决定,也受环境因素的影响。贾文庆[10]研究认为,蔗糖不仅可调节花粉的渗透势,还可以作为合成淀粉的原料,促进花粉管的伸长。该试验发现随着蔗糖浓度的增加,红花刺槐花粉萌发率也逐步增大,蔗糖浓度超过25.0 mg/L时,红花刺槐花粉的萌发率降低,与金爱红等[11]发现蔗糖浓度过高会造成花粉的质壁分离,从而抑制花粉萌发的研究结果一致。该试验表明花粉萌发同时受硼酸浓度的调控,只有在适量的蔗糖与硼酸组合中,才能得到相对较高的花粉萌发率,适合刺槐花粉萌发的蔗糖与硼酸组合为蔗糖20.0 mg/L+硼酸2.0 mg/L。
I2-KI染色法是检测花粉生活力的常用方法,花粉粒中含有淀粉,遇I2变蓝,而该试验中花粉染色后呈现红褐色和黄褐色,与所查资料不符,因此判定I2-KI染色法不适用于红花刺槐花粉活力的测定。TTC染色法适用于大多数植物花粉生活力测定,在芍药、油茶等花粉生活力测定中效果明显[12-13]。花粉的着色情况可能受其自身特性影响[14],一般花粉活性越高,其着色程度越深,该试验用0.4 g/L TTC溶液对红花刺槐花粉进行染色后,呈现深红色、浅红色、无色3种情况,染成深红色的花粉粒达总数的85%左右,而培养基的最高萌发率仅有29.56%,可能是由于培养基中存在不能吸收培养液的干燥花粉粒,或者吸收了培养液而最终并没有萌发,染色法测定的是花粉仍具有活力,而活性稍弱的花粉在培养基中可能不能萌发。检测花粉生活力的染色方法还有CAB法、Kew法[15]等,何种染色法适合红花刺槐花粉生活力测定有待进一步研究。
在花粉的超低温保存中,超低温对花粉细胞内含物质是否造成影响也是一个值得研究的问题。研究表明,在牡丹花粉超低温保存前后,可溶性蛋白、脯氨酸、MDA、SOD、CAT、POD及可溶性糖含量均有一定程度的变化[16]。该试验选择常温保存和低温保存2种方法进行比较,红花刺槐花粉开放当天采收,在常温和低温下保存5 d时,具有最佳萌发率,常温保存萌发率为24.91%,低温保存萌发率为31.82%,随着保存时间的延长,花粉的萌发率逐步降低,常温保存的萌发率较低温保存下降更快,常温条件下花粉会更快地失去活
力,不能萌发或不能充分伸长,因此低温更适合红花刺槐花粉的保存。有研究表明国槐花粉在低温下保存的最长时间为39 d[17],而红花刺槐花粉在低温条件下保存的最长时间仍有待研究。
[1] 战臣祥,李观和,袁俊云,等.刺槐良种基因材料收集与选育研究[J].山东林业科技,2010(2):18-21.
[2] 刘德光.香花槐分类地位及不结实现象研究[D].合肥:安徽农业大学,2008.
[3] 凯莱斯台舍.刺槐[M].王世绩,张敦伦,译.北京:中国科学技术出版社,1993.
[4] 姜丽娜,荀守华,孙百友,等.多花刺槐花粉活力测定与保存[J].山东林业科技,2015,45(4):10-15.
[5] 李国树,徐成东,李天星,等.几种杜鹃花花粉生活力研究[J].北方园艺,2010(22):80-83.
[6] 王存纲,晋佳路.刺槐花粉生活力测定方法及贮藏特性[J].南方农业学报,2014,45(8):1443-1446.
[7] 周家杏,曾丽,陶懿伟,等.微型月季花粉生活力测定方法的研究[J].上海交通大学学报(农业科学版),2007,25(6):574-577.
[8] 胡适宜.植物胚胎学实验方法(一):花粉生活力的测定[J].植物学报,1993,10(2):60-62.
[9] 王钦丽,卢龙斗.花粉的保存及其生活力测定[J].植物学报,2002,19(3):365-373.
[10] 贾文庆,刘会超,尤扬,等.红花酢浆草花粉萌发及贮藏特性的研究[J].湖北农业科学,2010,49(5):185-189.
[11] 金爱红,储立民,徐冬青,等.钙对葱兰花粉萌发和花粉管生长的影响[J].湖北农业科学,2005(3):91-93.
[12] 红雨,刘强,韩岚.芍药花粉活力和柱头可授性的研究[J].广西植物,2003,23(1):90-92.
[13] 王湘南,陈永忠,王瑞,等.油茶花粉活力及柱头可授性研究[J].中南林业科技大学学报,2012,32(3):17-22.
[14] 杨鑫,张秀省,穆红梅,等.4种槐树花粉生活力测定方法的比较[J].广东农业科学,2011,38(12):53-54.
[15] GIANFREDA L,SANNINO F,VIOLANTE A.Pesticide effects on the activity of free,immobilized and soil invertase[J].Soil biology & biochemistry,1995,27(9):1201-1208.
[16] 陶清波.牡丹花粉超低温保存研究[D].北京:北京林业大学,2003.
[17] 牛燕娥,庞彩红,李双云,等.国槐花粉保存方法的初步研究[J].中国农学通报,2015(19):96-100.
Viability Determination and Storage Property ofRobiniahisqidaPollen
LI Juan1, YAO Yan-wu2*
(1. Yanshan Bureau of Agriculture and Forestry of Cangzhou in Hebei Province, Cangzhou, Hebei 061300; 2. Forestry and Pomology Institute, Beijing Academy of Agriculture and Forestry Science, Beijing 100093)
[Objective] The assay method of pollen viability and its storage characteristics were explored to provide
for the production and breeding ofRobiniahisqida. [Method] The pollen viability ofRobiniahisqidawas detected by medium germination, I2-KI staining and TTC staining test. Meanwhile the effects of different storage conditions and time on theRobiniahisqidapollen germination were studied. [Result] The germination rate ofRobiniahisqidapollen was 29.56% under 20.0 mg/L sucrose + 2.0 mg/L boric acid. The temperature of 0 ℃ was more suitable and storable than normal temperature, the method of I2-KI did not apply to the determination ofRobiniahisqidapollen vitality test, determination of the TTC method effect remained to be further tested. At 0 ℃, the germination rate of pollen was 17.67% when it was preserved for 15 days. [Conclusion] The most suitable medium of theRobiniahisqidapollen germination was 20.0 mg/L sucrose +2.0 mg/L boric acid. AndRobiniahisqidapollen stored in the low temperature conditions remained longer vigor.
Robiniahisqida; Pollen viability; Storage conditions
北京市农林科学院基金项目(KJCX20150205)。
李娟(1985-),女,河北沧州人,助理工程师,从事林果技术工作。*通讯作者,副研究员,从事林木育种研究。
2016-07-13
S 792.27
A
0517-6611(2016)23-141-03
