化学杂交剂SX-1诱导油菜花粉败育的细胞学观察
2016-10-10罗海燕官春云
罗海燕,官春云
(湖南农业大学油料作物研究所,长沙 410128)
化学杂交剂SX-1诱导油菜花粉败育的细胞学观察
罗海燕,官春云
(湖南农业大学油料作物研究所,长沙 410128)
通过石蜡切片和用Sudan Black B进行花药脂染色,对化学杂交剂SX-1诱导的油菜雄性不育花药发育进行了细胞学观察。结果表明,SX-1对油菜花药发育各个时期都有一定影响,一类是花粉败育发生在造孢细胞时期到四分体时期,绒毡层细胞异常加厚、提前解体或是液泡化;另一类是绒毡层细胞延迟解体,单核小孢子不能发育为成熟的花粉粒。花药脂染色结果表明,SX-1影响了绒毡层细胞的油脂积累,油脂代谢受到抑制,不能为花粉外壁形成提供充足的脂类物质,是单核小孢子不能发育为成熟花粉粒的原因之一。
油菜;雄性不育;细胞学;绒毡层;化学杂交剂
由于作物在长期进化繁衍过程中形成了雌配子与雄配子之间对环境条件反应的差异,雄配子比雌配子对诸如温度、水分、化学物质等的敏感性强,因而在不良环境中存在雄配子败育现象。一类能够诱导植物雄配子败育的化学物质,被称为化学杂交剂(Chemical hybridization Agent,简称CHA),也称化学杀雄剂。利用化学杂交剂选育和生产油菜杂种是当前油菜杂种选育和制种的重要途径之一,探究化学杂交剂诱导雄性不育的机理,对化学杂交剂的应用以及开发具有指导意义。已有的研究表明,化学杂交剂SX-1杀雄效果好、对雌蕊授粉后结实正常、植株没有明显药害,在生产上被大量使用[1~3]。但是对SX-1诱导油菜雄性不育的机理基础研究较少。本试验对化学杂交剂SX-1诱导的雄性不育花药小孢子发育过程进行石蜡切片细胞学观察,并用Sudan Black B进行花药脂染色,探讨花药细胞发育变化和小孢子败育时期、方式、特点以及绒毡层细胞油脂代谢变化,以期对化学杂交剂诱导油菜雄性不育的机理有进一步的认识。
1 材料和方法
1.1试验材料
试验材料为甘蓝型油菜品种沪油15号,种子由湖南农业大学油料作物研究所提供。SX-1购买自陕西省杂交油菜研究中心,该杂交剂由两种制剂组成,名为1号制剂和2号制剂。
1.2实验设计
实验材料播种于湖南农业大学耘园基地,小区种植,行距50 cm,株距10 cm,实验地采取常规田间管理。依据SX-1配制使用说明及预实验结果,SX-1对沪油15的使用最适浓度为:1号制剂施用浓度为6.8 mg/L,2号制剂施用浓度为8.0 mg/L。具体使用时期如下:在油菜主花序最大花蕾长2~3 mm时,此时油菜株高20~30 cm,用手持喷雾器对油菜植株喷施1号制剂。喷施1号制剂后10 d左右用2号制剂进行第二次喷施。两次的喷施剂量相同,平均每株油菜用量约10 mL。对照组喷以等量的清水。油菜开花后,取不同大小可育株和不育株花蕾,用1%醋酸洋红染色确定花药中小孢子发育时期,分组取样,浸泡于FAA固定液(38%甲醛5 mL∶冰醋酸5 mL∶70%酒精90 mL),用于制作切片。
1.3花药细胞学观察
石蜡切片参照陈平平[4]和李栒[5]的方法:材料经不同浓度的乙醇脱水、二甲苯-乙醇透明、石蜡包埋、切片5.0~7.0 μm,铁明矾苏木精染色,树脂封片,Olympus BX-51RT光学显微镜观察并照相。
1.4苏丹黑B染色
参照文献[6]。石蜡切片方法同上,脱蜡复水后,于50~60℃的70%酒精溶解的苏丹黑B试剂中染色30~60 min,用70%的乙醇洗去浮色,超纯水漂洗。Olympus BX-51RT光学显微镜观察并照相。
2 结果与分析
2.1花药发育的细胞学特点
油菜花粉发育大致经过孢原细胞分化、造孢细胞增殖为花粉母细胞、花粉母细胞减数分裂、小孢子有丝分裂、花粉粒成熟等阶段。在孢原细胞分化阶段,造孢细胞性状不规则,细胞核大而圆,造孢细胞外围依次为绒毡层、中间层、药室内壁、表皮(图1,A)。造孢细胞增殖为花粉母细胞,此时绒毡层细胞绒毡层体积增大,大部分绒毡层细胞出现双核转变为分泌型绒毡层细胞,中间层变为带状结构(图1,B)。进入减数分裂阶段后花粉母细胞变为椭圆形,绒毡层细胞壁开始降解,细胞之间开始出现间隙,中间层消失(图1,C、D)。减数分裂后形成四分体,呈四面体形,相邻绒毡层细胞之间间隙继续增大(图1,E)。单核小孢子逐渐从四分体中释放出来,单核早期小孢子细胞壁很薄,细胞质浓厚且染色较深(图1,F)。小孢子形成大液泡,细胞核被挤到细胞边缘,进入单核靠边期,中间层细胞消失,此时小部分绒毡层细胞仍能看见双核,绒毡层细胞壁持续降解,药室内壁逐渐变薄(图1,G)。单核小孢子进行一次不对称有丝分裂,形成二核花粉粒,二核花粉粒进行第二次有丝分裂形成三核花粉粒,这期间绒毡层细胞大量解体,随着花粉粒的进一步发育成熟,药室内壁完全消失(图1,H、I)。
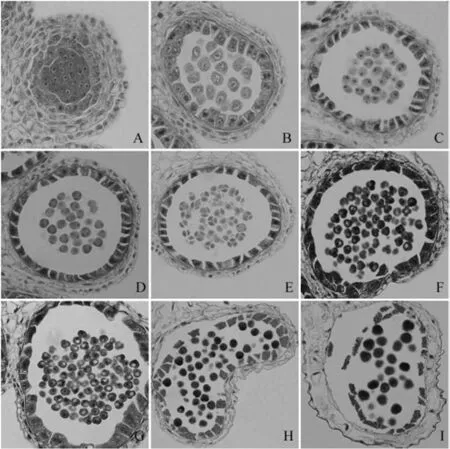
图1 对照油菜可育株花药发育的显微观察(×400)Fig.1 Microscopic observation of anther development of fertile plants注:A.造孢细胞时期;B.花粉母细胞时期;C、D.减数分裂期;E.四分体时期;F、G.单核期;H.双核期;I.三核期。
经过SX-1喷施后的沪油15花药能分化出花粉囊,数目4个,呈蝶状,和未喷旋SX-1的对照沪油15花药的分化一致。在造孢细胞时期,花粉囊由内到外依次为造孢细胞、绒毡层、药室内壁、表皮细胞,表明药室细胞层类型的分化是正常的,但是细胞的发育出现异常:造孢细胞出现液泡化,绒毡层细胞异常加厚或是明显解体(图2,A、B)。花粉母细胞时期,绒毡层细胞提前降解(图2,C)。花粉发育到四分体时期,四分体发育异常,形状怪异,其中小孢子个数2到4个不等且形状异常,绒毡层细胞降解严重或是伴有液泡化现象(图2,D、E)。单核小孢子时期,花药中的绒毡层凝结延迟降解,仍可见中间层(图2,F)。最后在大花蕾花药中,单核小孢子内含物降解、空泡化,仅有极少数的小孢子继续发育到二核小孢子,花粉内物质完全降解,最后花粉囊中只剩下花粉空壳(图2,F、G、I)。
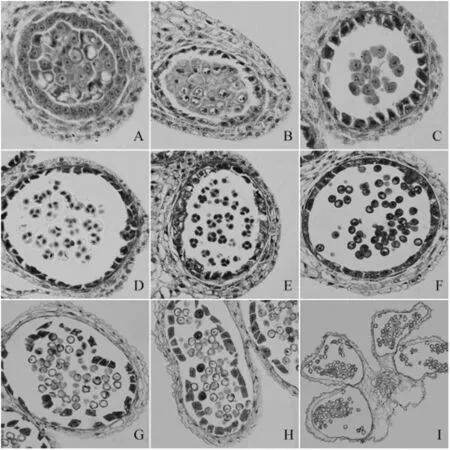
图2 SX-1诱导的油菜雄性不育株花药显微观察(×400)Fig.2 Microscopic observation of anther development of male sterile plants induced by SX-1注:A、B.造孢细胞时期;C.花粉母细胞时期;D、E.四分体期;F、G.单核期;H.二核期;I.败育花药(×200)。
绒毡层细胞的异常表现可以概括为两类:小孢子发生期(花粉母细胞时期、减数分裂期、四分体时期)绒毡细胞提前解体,雄配子形成期(单核小孢子发育为成熟花粉粒期间)绒毡细胞延迟降解。
2.2花药脂染色结果
用脂类物质特异染料苏丹黑B对可育花药进行染色处理,观察油脂代谢在花药细胞中的动态变化。造孢细胞增殖为花粉母细胞的过程中,整个花药没有染色信号(图3,B、C)。花粉母细胞进入减数分裂期,绒毡层细胞可见明显的着色信号,此时花粉母细胞有微弱的着色信号(图3,D)。从四分体中释放出来的早期单核小孢子着色信号微弱,绒毡层细胞着色信号增强(图3,E)。随着花粉外壁进一步形成,单核小孢子着色信号逐渐增强,绒毡层细胞的着色信号逐渐减弱(图3,F、G)。小孢子继续发育,绒毡层细胞大量解体着色信号逐渐消失,脂类物质不断聚集到小孢子外壁上,小孢子发育为成熟的花粉粒,最终花粉粒着色为深黑色(图3,H、I)。结果表明:花药造孢细胞时期,绒毡层细胞处于分化发育阶段,没有进行油脂合成代谢;花粉母细胞减数分裂期绒毡层细胞开始合成并积累脂类物质,并随着花药发育逐渐增强,同时绒毡层细胞将集聚的脂质分泌到腔室供给小孢子发育;到单核后期,绒毡层细胞基本完成脂质的分泌,解体的绒毡层细胞碎片为花粉发育成熟提供其他营养物质。
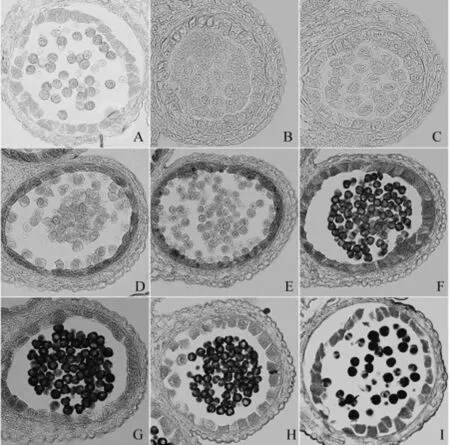
图3 对照油菜可育株花药脂染色观察(×400)Fig.3 Sudan Black B staining analysis of anthers from fertile plants注:A.阴性对照,未用苏丹黑B处理;B.造孢细胞时期;C.花粉母细胞时期;D.减数分裂期;E、F、G.单核期;H.二核期;I.三核期。
根据SX-1诱导沪油15败育花药细胞学特征,可知绒毡层的发育异常主要表现为在小孢子发生期提前降解,雄配子形成期延迟降解。因此SX-1诱导的不育花药脂染色结果,可以分为两类讨论。四分体期到小孢子从四分体中释放出来,提前解体的绒毡层细胞中着色信号微弱且不均匀(图4,B、C)。雄配子形成期延迟降解的绒毡层直到最终解体,绒毡层的着色信号一直处于微弱状态,小孢子的着色信号虽然不断增强,但是脂质未得到充足供应不能发育成成熟的花粉粒,败育花粉粒外壁物质溃散,着色信号变弱(图4,D~I)。提前解体的绒毡层中检测到脂染色信号,说明在四分体期间绒毡层有油脂积累。延迟降解的绒毡层中着色信号微弱,说明绒毡层的脂质合成受阻,而后绒毡层解体小孢子的着色信号并没有增强,说明绒毡层对花粉外壁脂质的提供大部分是取决于解体前的合成与积累。
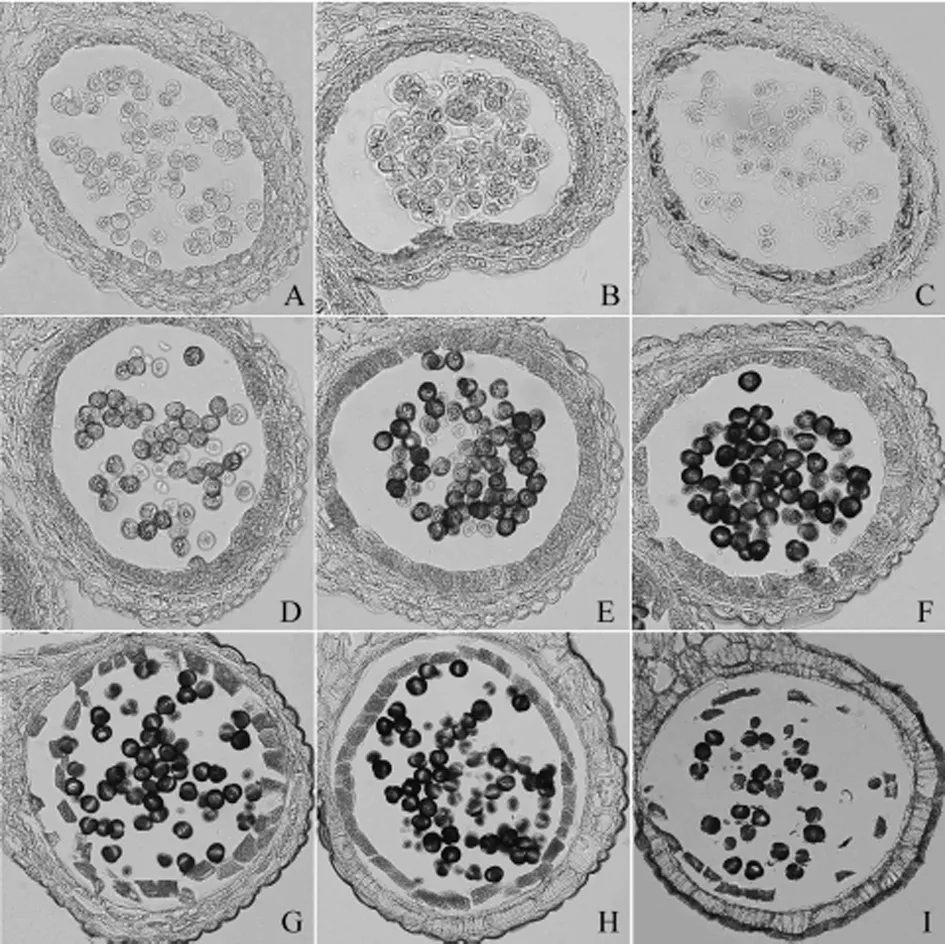
图4 SX-1诱导油菜雄性不育株花药脂染色观察(×400)Fig.4 Sudan Black B staining analysis of anthers from male sterile plants induced by SX-1注:A.阴性对照,未用苏丹黑B处理;B~I.与可育花药各个时期花蕾大小相对应的花药切片,其中B.四分体期;C~F.单核期。
3 小结与讨论
化学杂交剂诱导的败育花药细胞学特征复杂。官春云等[7]用杀雄剂1号处理不同时期油菜,观察到不育花药中绒毡层细胞发育异常,根据杀雄剂1号浸种或在造孢细胞形成及以前任何时期进行处理不能诱导雄性不育,认为杀雄剂1号诱导油菜雄性不育主要是作用于花药,花药中特异表达的基因表达受到影响使得绒毡层发育异常进而导致花粉败育。成宇峰[8]将单嘧磺酯钠诱导的油菜败育类型分成两类,一类是绒毡层细胞在单核早期已经全部解体,小孢子发育到成熟期时内含物收缩或全部降解,小孢子败育;另一类是小孢子从花粉母细胞时期就出现细胞质、细胞核收缩降解现象,随着小孢子的进一步发育,小孢子发育畸形内含物不断降解,二核、三核期时小孢子细胞降解,绒毡层细胞发育异常或是延迟解体。唐志康[9]、井苗[10]、于橙宇[11]、崔建民[12]等用不同化学杂交剂诱导不同品种油菜的研究结果表明,化学杂交剂对油菜花药发育不同时期的小孢子、绒毡层细胞造成影响,并认为杂交剂对性细胞有直接杀伤作用。由于绒毡层位于花药四层体细胞的最内层,与花粉母细胞直接相连,在小孢子发育过程中起着至关重要的作用,如分泌胼胝质酶使小孢子从四分体中释放出来、为花粉壁的形成提供脂质、为花粉成熟提供营养[13~15],因此,绒毡层发育异常被认为是化学杂交剂诱导油菜雄性不育的原因[7,9,10]。
对SX-1诱导沪油15花粉败育的细胞学观察表明,SX-1对油菜花药发育各个时期都有一定影响,绒毡层细胞的异常表现可以概括为两类:小孢子发生期(花粉母细胞时期、减数分裂期、四分体时期)绒毡细胞提前解体,雄配子形成期(单核小孢子发育为成熟花粉粒期间)绒毡细胞延迟降解。花药脂染色结果表明,SX-1影响了绒毡层细胞的油脂代谢,不能为单核小孢子的花粉外壁形成提供充足的脂类物质,是单核小孢子不能发育为成熟花粉粒的原因之一。与Li等[16]根据不同发育时期花药与叶片的基因表达的比较转录组学数据认为花药细胞中碳水化合物和脂质代谢受到影响可能是低浓度单嘧磺酯钠诱导油菜雄性不育的原因的结论具有一致性。
[1]李建厂,李永红,王灏,等.新型油菜化学杀雄剂SX-1对甘蓝型油菜制种亲本相关性状的影响研究[J].中国农学通报,2013,29(24):62-68.
[2]韦世豪,田建华,李永红,等.化学杀雄剂SX-1对不同生态区甘蓝型油菜的杀雄效果[J].西北农林科技大学学报(自然科学版),2011,39(11):119-123.
[3]张振乾,王国槐,官春云,等.油菜化学杀雄剂研究进展[J].湖南农业科学,2011(5):19-22.
[4]陈平平.两个新型油菜雄性不育系681A和trans I的细胞学机理的研究[D].长沙:湖南农业大学硕士学位论文,2004.
[5]李栒.染色体遗传导论[M].长沙:湖南科学技术出版社,1991.
[6]Dun X,Zhou Z,Xia S,et al.BnaC.Tic40,a plastid inner membrane translocon originating from Brassica oleracea,is essential for tapetal function and microspore development inBrassicanapus[J].The Plant Journal,2011,68(3):532-545.
[7]官春云,李栒,王国槐,等.化学杀雄剂诱导油菜雄性不育机理的研究1.杀雄剂1号对甘蓝型油菜花药毡绒层和花粉粒形成的影响[J].作物学报,1997,23(5):513-517.
[8]成宇峰.新型化学杂交剂筛选及其诱导油菜雄性不育的效果和机理研究[D].杨凌:西北农林科技大学博士学位论文,2014.
[9]唐志康.化学杀雄剂‘化杀灵’诱导甘蓝型油菜雄性败育研究[D].成都:四川农业大学硕士学位论文,2006.
[10]井苗.化学药物诱导油菜雄性不育的研究[D].杨凌:西北农林科技大学硕士学位论文,2008.
[11]于橙宇.植物化学杀雄剂的作用特征与机理[D].杨凌:西北农林科技大学硕士学位论文,2009.
[12]崔建民.新型化学药物诱导油菜雄性不育效果及其机理的初步研究[D].杨凌:西北农林科技大学硕士学位论文,2011.
[13]Pacini E,Franchi GG,Hesse M.The tapetum:Its form,function,and possible phylogeny in Embryophyta[J].Plant Systematics and Evolution,1985,149(3-4):155-185.
[14]Piffanelli P,Ross JHE,Murphy DJ.Biogenesis and function of the lipidic structures of pollen grains[J].Sexual Plant Reproduction,1998,11(2):65-80.
[15]Stieglitz H,Stern H.Regulation of β-1,3-glucanase activity in developing anthers of Lilium[J].Developmental Biology,1973,34(1):169-173.
[16]Li Z,Cheng Y,Cui J,et al.Comparative transcriptome analysis reveals carbohydrate and lipid metabolism blocks inBrassicanapusL.male sterility induced by the chemical hybridization agent monosulfuron ester sodium[J].BMC Genomics,2015,16(1):206.
Cytological Observation of Anther Development on Male Sterility in Brassica napus L.Induced by Chemical Hybridization SX-1
LUO Haiyan,GUAN Chunyun
(Oil Crops Research Institute,HNAU,Changsha,Hunan 410128,China)
Cytological observation of anther development on male sterility inBrassicanapusL.induced by chemical hybridization SX-1 was conducted after parafin sections and Sudan Black B staining.The effects were divided into two categories,one is the pollen aborted in sporogenous stage to tetrad stage while tapetal cells thickened abnormally,or disintegrated earlier,or became vacuolization;one is the tapetum cell delayed disintegration and the uninucleate microspore could not develop into mature pollen.The result of Sudan Black B staining suggested that SX-1 have influenced lipid accumulation in the tapetal cell,lipid metabolism in tapetal cell was inhibited,causing tapetum could not provide sufficient material for the formation of pollen wall,that is part of reason uninucleate microspore could not further developed into mature pollen.
rape;male sterility;cytology;tapetum;chemical hybridization agents
2016-03-08
罗海燕(1990-),女,硕士研究生,Email:342269254@qq.com。*通信作者:官春云,教授,中国工程院院士,Email:guancy2011@aliyun.com。
国家科技部项目(2011AA10A104_6)。
S565.401;Q842.1
A
1001-5280(2016)04-0397-05
10.16848/j.cnki.issn.1001-5280.2016.04.11
