金属硝酸盐/TEMPO催化5-羟甲基糠醛区域选择性氧化制备2,5-呋喃二甲醛
2016-09-29吴廷华
郭 聪, 武 琦, 吴廷华, 吴 瑛
(浙江师范大学 物理化学研究所,浙江 金华 321004)
金属硝酸盐/TEMPO催化5-羟甲基糠醛区域选择性氧化制备2,5-呋喃二甲醛
郭聪,武琦,吴廷华,吴瑛
(浙江师范大学 物理化学研究所,浙江 金华321004)
5-羟甲基糠醛(HMF)区域选择性氧化为2,5-呋喃二甲醛(DFF)是一个重要的催化反应.考察了不同的金属硝酸盐对氧化5-羟甲基糠醛得到2,5-呋喃二甲醛反应的催化效果,研究了该反应的机理,考察了不同反应条件对反应性能的影响.研究表明,硝酸铁在所有金属硝酸盐中催化活性最高,2,5-呋喃二甲醛的选择性可以达到96.6%,5-羟甲基糠醛的转化率达到了99%.
有氧氧化;5-羟甲基糠醛;硝酸铁;2,2,6,6-四甲基哌啶-氮-氧化物;2,5-呋喃二甲醛
近年来,生物质作为一种包含碳源最广泛的可再生资源引起了广泛的关注.5-羟甲基糠醛(HMF)是由生物质中的多糖经过降解、异构化、脱水得到的一种物质,被美国科学院评为TOP 10的具有极高价值的平台分子化合物[1].2,5-呋喃二甲醛(DFF)是5-羟甲基糠醛转化得到的又一重要的化学中间体,广泛应用于杀菌剂、医药、功能高分子的合成[2-3],对缓解能源危机和环境污染等问题具有非常重要的意义.目前,研究表明合成2,5-呋喃二甲醛最典型的方法是选择性氧化5-羟甲基糠醛.尽管很久以前2,5-呋喃二甲醛就被作为一种非常有用的精细化学产品,但是有关它的合成的研究还是有限的.由于5-羟甲基糠醛的分子结构(见图1)中存在一个比羟基更容易氧化的醛基,在对5-羟甲基糠醛的羟基进

图15-羟甲基糠醛的结构式
行氧化时,若没有保护好其原有的醛基,将会使2,5-呋喃二甲醛的选择性和产率都很低.Cottier等
[4]
在室温条件下以K
2
Cr
2
O
7
为氧化剂,二甲基亚砜(DMSO)作溶剂,经超声处理,得到2,5-呋喃二甲醛的收率为75%.Amarasekara等
[5]
用次氯酸钠为氧化剂,Mn(Ⅲ)-salen为催化剂,产物2,5-呋喃二甲醛的收率为63%~89%.虽然这类氧化体系可以得到较高的2,5-呋喃二甲醛的收率,但所用的氧化剂有毒,违背了绿色化学、可持续发展的主旨.Sheldon等
[2]
用绿色氧化剂双氧水,在钛硅分子筛(TS-1)催化下,得到2,5-呋喃二甲醛的收率为25%.H
2
O
2
是一种绿色的氧化剂,但H
2
O
2
的氧原子利用率只有44%.采用绿色且廉价的分子O
2
氧化5-羟甲基糠醛制备2,5-呋喃二甲醛成了研究者关注的焦点
[6-10]
.
Carlini等[11]以VOPO4·2H2O为催化剂,O2为氧化剂,在二甲基亚砜中150 ℃反应,2,5-呋喃二甲醛选择性可达97%,5-羟甲基糠醛的转化率达到84%.Navarro等[12]用乙酰丙酮钒固定在二乙烯基苯交联的聚4-乙烯基吡啶上,在三氟甲苯溶剂中,2,5-呋喃二甲醛的选择性达到99%,5-羟甲基糠醛的转化率达到77%.文献[8]用VOSO4/Cu(NO3)2催化体系氧化5-羟甲基糠醛时,在80 ℃下2,5-呋喃二甲醛的收率接近100%,但反应时间长达48 h.最近,Cottier等[13]在2,2,6,6-四甲基哌啶-氮-氧化物(TEMPO)自由基的存在下,使用CuCl和分子氧在乙腈中催化氧化羟甲基糠醛,取得了65%的2,5-呋喃二甲醛收率.Thomas等[14]用CuCl和TEMPO自由基作为催化剂,同时用含氮的促进剂优化催化剂的性能,用氧气作为氧化剂,催化氧化5-羟甲基糠醛,2,5-呋喃二甲醛的收率达到了95%.文献[15]在TEMPO和氧气的反应体系中,发现硝酸根离子在苄基醇氧化成醛时有非常重要的作用.基于之前的研究工作,本文拟将TEMPO和硝酸根离子在氧化5-羟甲基糠醛到2,5-呋喃二甲醛这一反应中的优势结合起来,达到减少反应时间、降低反应温度并且进一步提高反应转化率和选择性的目的.为此,本研究考察了不同的金属硝酸盐对氧化5-羟甲基糠醛得到2,5-呋喃二甲醛反应的催化效果,还考察了不同的反应条件对反应性能的影响,并探讨了该反应的机理.研究结果表明,硝酸铁在所有实验用到的金属硝酸盐中催化活性最高,2,5-呋喃二甲醛的选择性可以达到96.6%,5-羟甲基糠醛的转化率达到99%.
1 实验过程
1.1试剂
2,5-呋喃二甲醛(分析纯,北京乐博生物科技公司);TEMPO(阿拉丁试剂);NaCl(天津市北方天医化学试剂厂);超纯水;5-羟甲基糠醛(分析纯)、Fe(NO3)3·9H2O(分析纯)、乙腈(分析纯)、甲苯(分析纯)、乙酸乙酯(分析纯)均购于国药集团化学试剂有限公司.

图25-羟甲基糠醛选择性氧化制备2,5-呋喃二甲醛
1.2氧化反应
在室温下,以两颈瓶为容器,用其中一瓶颈通氧气(10 mL/min),在容器中加入0.1 mmol 5-羟甲基糠醛作为原料,同时加入TEMPO,Fe(NO3)3·9H2O和NaCl各0.05 mmol作为催化剂进行反应,反应过程如图2所示.反应结束后,取0.1 mL待测液,用乙腈稀释至10 mL,经微孔(0.22 μm)过滤膜过滤,用高效液相色谱和紫外检测器分析,色谱柱为C18反相色谱柱,流动相用乙腈和超纯水(V(乙腈)∶V(超纯水)=4∶6),通过外标法计算出5-羟甲基糠醛的转化率和2,5-呋喃二甲醛的产率.
1.3产物分析及表征
为证明产物为2,5-呋喃二甲醛,反应结束后用柱色谱法(20 g SiO2,直径2 cm,洗脱剂V(乙酸乙酯)∶V(二氯甲烷)=1∶1)对反应体系进行分离,再经旋转蒸发仪蒸馏得到白色固体,随后对产物进行了红外光谱表征,在3 110,2 980,2 840,1 676,1 413,1 270和1 240 cm-1处皆出现2,5-呋喃二甲醛的特征峰.
对产物进行核磁共振表征,结果如下:1H NMR(400 MHz,CDCl3)δ/ppm:9.86(S,2H,醛基氢),7.36(S,2H,呋喃氢);13C NMR(400 MHz,CDCl3)δ/ppm:179.24(2C),154.19(2C),119.36(2C).核磁共振表征数据与文献[14]报道的一致.
此外,本研究还用高效液相色谱-紫外可见检测器进行分析,发现分离出的产物与2,5-呋喃二甲醛标准品的保留时间一致,皆在5.5 min左右.
通过这3项表征,有效地证明了反应得到的产物为目标产物2,5-呋喃二甲醛.
2 结果和讨论
运用密度泛函理论(DFT)对5-羟甲基糠醛的分子轨道进行了理论计算,得出5-羟甲基糠醛分子的最高已占轨道(HOMO)和最低未占轨道(LUMO)的轨道分布图(如图3).从图3可以看出,5-羟甲基糠醛分子中的醛基同时存在HOMO和LUMO轨道,而羟甲基部分只存在LUMO轨道,说明醛基发生反应的可能性远远高于羟甲基,只有选择一个与羟甲基部分LUMO轨道对称性相同、能级匹配的HOMO轨道的物质才能够实现高效的区域选择性反应.
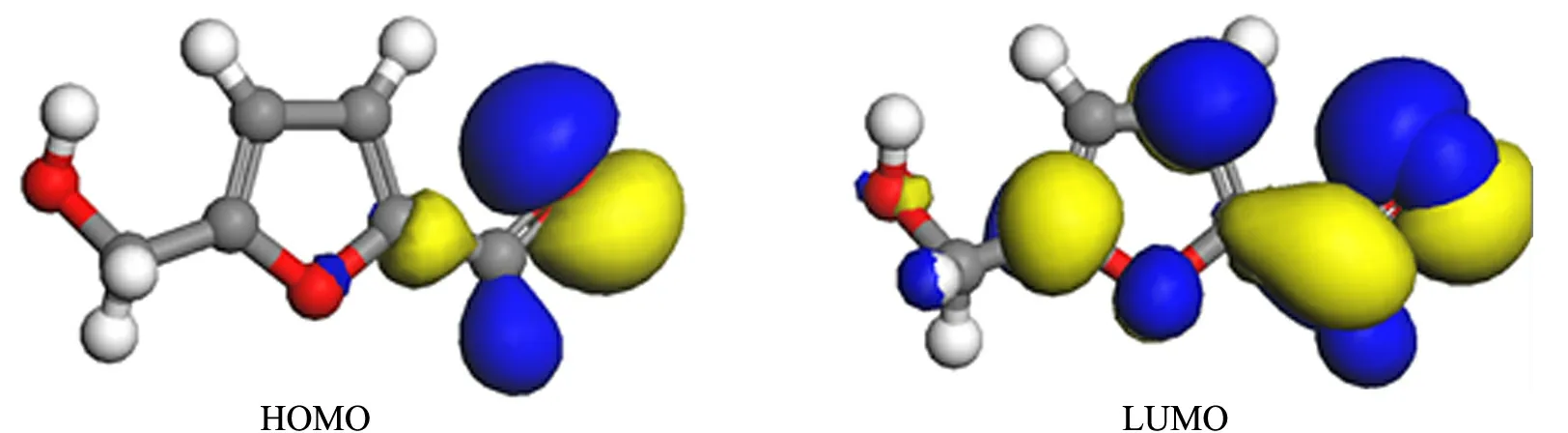
图35-羟甲基糠醛分子的HOMO和LUMO
2.1不同反应气氛对2,5-呋喃二甲醛产率的影响
考察了不同的反应气氛对反应的影响.分别向两颈烧瓶中依次通入空气、纯氧气和氮气,结果如图4所示:只通入氮气的情况下,随着时间的变化2,5-呋喃二甲醛的产率几乎不变;通入空气时,2,5-呋喃二甲醛的产率呈上升趋势;通入氧气时,在经过4 h的反应后,2,5-呋喃二甲醛的产率已接近95%,随着时间的继续增加,2,5-呋喃二甲醛产率几乎不变,这是因为反应在该条件下已达到化学平衡.

反应条件:HMF 0.1 mmol;TEMPO 0.05 mmol;Fe(NO3)3·9H2O 0.05 mmol;NaCl 0.05 mmol;乙腈5 mL图4 不同反应气氛对2,5-呋喃二甲醛产率的影响
2.2催化剂各组分对反应结果的影响
考察了催化剂中各组分对反应性能的影响.当分别加入NaCl和TEMPO,NaCl和Fe(NO3)3·9H2O时,反应结果显示两者都只有痕量的产物生成;但是当TEMPO和Fe(NO3)3·9H2O都加入到反应体系中而不加NaCl时,可以得到68%的5-羟甲基糠醛转化率和28.1%的2,5-呋喃二甲醛产率(见表1).表明TEMPO,Fe(NO3)3·9H2O和NaCl对该反应的顺利进行都是不可或缺的,但该反应体系中只缺少NaCl时反应还是有一定效果的,显示TEMPO和Fe(NO3)3·9H2O是该反应体系中的活性物质.尝试用KCl替代NaCl进行反应,得到了相似的结果.说明Cl-对该反应具有一定的促进作用.最后,本研究用各种不同的过渡金属盐对该反应的性能进行了研究,结果显示,Cu(NO3)2·3H2O,Zn(NO3)2·6H2O,Co(NO3)2·6H2O,Bi(NO3)3·5H2O,Cr(NO3)3·9H2O和AgNO3等都没有很好的反应效果.基于该基础,还研究了用FeCl3·6H2O进行反应,也只有1.8%的2,5-呋喃二甲醛产率(见表2),说明硝酸根在该反应体系中扮演重要的角色,这与之前文献[16]的报道一致.

表1 催化剂中各组分对5-羟甲基糠醛转化率和2,5-呋喃二甲醛产率的影响
注:5-羟甲基糠醛(HMF) 0.1 mmol;乙腈5 mL.

表2 不同的过渡金属盐对5-羟甲基糠醛转化率和2,5-呋喃二甲醛选择性的影响
注:5-羟甲基糠醛(HMF) 0.1 mmol;TEMPO 0.05 mmol;NaCl 0.05 mmol;O2;乙腈5 mL.
2.3不同用量催化剂对反应的影响

反应条件:HMF 0.1 mmol;O2;乙腈5 mL图5 反应底物和催化剂的用量比对HMF转化率及DFF的产率和选择性的影响

反应条件:HMF 0.1 mmol;TEMPO 0.05 mmol;Fe(NO3)3·9H2O 0.05 mmol;NaCl 0.05 mmol;O2图6 溶剂对HMF转化率及DFF产率和选择性的影响
催化剂的用量决定了催化剂活性位的数目,因此,进一步考察了催化剂的用量对反应的影响.反应底物和催化剂用量的比例分别为4∶1,2.5∶1,2∶1和1∶1.当两者用量的比例为4∶1时,5-羟甲基糠醛转化率为37.5%,2,5-呋喃二甲醛产率为34.7%;随着比例增加到2.5∶1时,相应的转化率和产率均增加;当两者用量比为2∶1时,催化剂达到最佳的催化活性;但是,当催化剂的量进一步增加,两者比例为1∶1时,催化剂的催化活性没有明显的提高(见图5).表明反应结果与底物和催化剂用量的比率有关,当两者比率达到2∶1时,催化剂对于该催化反应体系的性能已经达到最高.
2.4溶剂的影响
对于有氧氧化反应,溶剂对反应的影响至关重要.不同的溶剂会使催化剂和催化体系表现出不同的催化活性,有时对反应是否可以顺利进行起着至关重要的作用.在金属参与的催化反应体系中,溶剂可能影响氧气与金属之间的电子传递,某些溶剂还会与金属配位从而使金属催化剂在溶剂中的溶解性增加.在其他条件都不改变的前提下,本研究用CH2Cl2、乙酸乙酯、甲苯和水取代乙腈作为溶剂,将反应时间仍然控制在8 h,2,5-呋喃二甲醛的产率都有不同程度的降低(见图6).该结果表明可能含氮溶剂对反应有促进作用.催化剂在其他溶剂中的低活性,可能是因为微弱的铁和溶剂的结合能力[17].因此,当使用含氮溶剂时,溶剂可能会作为配体对此反应起促进的作用.Thomas等[14]的研究结果显示,在反应过程中加入含氮的促进剂对2,5-呋喃二甲醛的收率有很大的影响.
2.5可能的反应机理
基于先前的研究[18-19],提出了以TEMPO,Fe(NO3)3·9H2O及NaCl为共催化剂催化氧化5-羟甲基糠醛到2,5-呋喃二甲醛反应的可能的机理如图7所示.TEMPO首先与Fe3+发生作用生成中间体(1),该中间体与5-羟甲基糠醛发生作用生成中间体(2);紧接着,中间体(2)同时发生β-H消除和还原消除.在生成相应的2,5-呋喃二甲醛和TEMPOH物种的同时生成Fe2+,Fe2+被NO2氧化生成Fe3+[20],TEMPOH则被Fe3+氧化生成TEMPO和Fe2+[21],实现TEMPO的催化循环;所生成的Fe2+则被NO2重新氧化成Fe3+,从而实现铁的催化循环;Fe2+和Fe3+的催化循环过程是与NO2和NO的循环同步实现的,而NO2和NO的循环则是通过外加氧气对NO的氧化实现的.因此,在这一催化反应过程中,存在TEMPO-TEMPOH,Fe2+-Fe3+及NO2-NO共3个循环过程.虽然氯化钠的作用机制并不确切,但我们认为Cl-在反应中可能起到配体的作用[15],加快了此反应的速率.
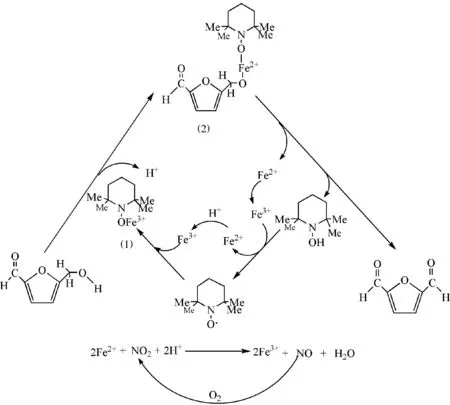
图7 以TEMPO,Fe(NO3)3·9H2O及NaCl为共催化剂催化氧化5-羟甲基糠醛到2,5-呋喃二甲醛的反应机理
3 结 论
本文中,笔者考察了不同的过渡金属硝酸盐及不同的反应条件对5-羟甲基糠醛区域选择性氧化制备2,5-呋喃二甲醛反应性能的影响.结果表明,在分子氧存在的条件下,以Fe(NO3)3·9H2O/NaCl/TEMPO为催化剂时,在乙腈溶剂中,反应8 h,2,5-呋喃二甲醛的选择性可以达到96.6%,5-羟甲基糠醛的转化率达到99%.此外,还探讨了该反应可能的机理.
[1]Hopkins K T,Wilson W D,Bender B C,et al.Extended aromaticfuran amidino derivatives as anti-Pneumocystis carinii agents[J].Journal of Medicinal Chemistry,1998,41(20):3872-3878.
[2]Sheldon R A.Heterogeneous catalytic oxidation and fine chemicals[J].Studies in Surface Science and Catalysis,1991,59:33-54.
[3]Van Deurzen M,Van Rantwijk F,Sheldon R A.Chloroperoxidasecatalyzed oxidation of 5-hydroxymethylfurfural[J].Journal of Carbohydrate Chemistry,1997,16(3):299-309.
[4]Cottier L,Descotes G,Lewkowski J,et al.Ultrasonically accelerated syntheses of furan-2,4-dicarbaldehyde from 5-hydroxymethyl-2-furfural[J].Organic Preparations and Procedures International,1995,27(5):564-566.
[5]Amarasekara A S,Green D,Mcmillan E.Efficient oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran using Mn(Ⅲ)-salen catalysts[J].Catalysis Communications,2008,9(2):286-288.
[6]Partenheimer W,Grushin V V.Synthesis of 2,5-diformylfuran and furan-2,5-dicarboxylic acid by catalytic air-oxidation of 5-hydroxymethylfurfural.Unexpectedly selective aerobic oxidation of benzyl alcohol to benzaldehyde with metal=bromide catalysts[J].Advanced Synthesis & Catalysis,2001,343(1):102-111.
[7]Giroir-Fendler A,Denton P,Boreave A,et al.The role of support acidity in the selective catalytic reduction of NO by C3H6under lean-burn conditions[J].Topics in Catalysis,2001,16(1):237-241.
[8]Ma Jiping,Du Zhongtian,Xu Jie,et al.Efficient aerobic oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran,and synthesis of a fluorescent material[J].Chem Sus Chem,2011,4(1):51-54.
[9]Takagaki A,Takahashi M,Nishimura S,et al.One-pot synthesis of 2,5-diformylfuran from carbohydrate derivatives by sulfonated resin and hydrotalcite-supported ruthenium[J].Catalysis,2011,1(11):1562-1565.
[10]Yang Zhenzhen,Deng Jin,Pan Tao,et al.A one-pot approach for conversion of fructose to 2,5-diformylfuran by combination of Fe3O4-SBA-SO3H and K-OMS-2[J].Green Chemistry,2012,14:2986-2989.
[11]Carlini C,Patrono P,Galletti A,et al.Selective oxidation of 5-hydroxymethyl-2-furaldehyde to furan-2,5-dicarboxaldehyde by catalytic systems based on vanadyl phosphate[J].Applied Catalysis A:General,2005,289(2):197-204.
[12]Navarro O C,Canos A C,Chornet S I.Chemicals from biomass:aerobic oxidation of 5-hydroxymethyl-2-furaldehyde into diformylfurane catalyzed by immobilized vanadyl-pyridine complexes on polymeric and organofunctionalized mesoporous supports[J].Topics in Catalysis,2009,52(3):304-314.
[13]Cottier L,Descotes G,Lewkowski J,et al.Oxidation of 5-hydroxymethylfurfural and derivatives to furanaldehydes with 2,2,6,6-tetramethylpiperidine oxide radical-cooxidant pairs[J].Journal of Heterocyclic Chemistry,1995,32(3):927-930.
[14]Thomas S H,Irantzu S,Eduardo J G,et al.Cu catalyzed oxidation of 5-hydroxymethylfurfural to 2,5-diformylfuran and 2,5-furandicarboxylic acid under benign reaction conditions[J].Applied Catalysis A:General,2013,456:44-50.
[15]Ma Shengming,Liu Jinxian,Li Suhua,et al.Development of a general and practical iron nitrate/TEMPO catalyzed aerobic oxidation of alcohols to aldehydes/ketones:catalysis with table salt[J].Advanced Synthesis & Catalysis,2011,353(6):1005-1017.
[16]Wang Xinliang,Liang Xinmiao.Aerobic oxidation of alcohols to carbonyl compounds catalyzed by Fe(NO3)3/4-OH-TEMPO under mild conditions[J].Chinese Journal of Catalysis,2008,29(9):935-939.
[17]Gamez P,Arends I W C E,Sheldon R A,et al.Room temperature aerobic copper-catalysed selective oxidation of primary alcohols to aldehydes[J].Advanced Synthesis & Catalysis,2004,346(17):805-811.
[18]Rossi L I,Martín S E.Possible role of nitrate/nitrite redox cycles in catalytic and selective sulfoxidation reaction:Metallic nitrates and bromides as redox mediators:a comparative study[J].Applied Catalysis A:General,2003,250(2):271-278.
[19]Wang Naiwei,Liu Renhua,Chen Jiping,et al.NaNO2-activated,iron-TEMPO catalyst system for aerobic alcohol oxidation under mild conditions[J].Chemical Communications,2005,42(42):5322-5324.
[20]Epstein I R,Kustin K,Warshaw L J.A kinetics study of the oxidation of iron(Ⅱ) by nitric acid[J].Journal of the American Chemical Society,1980,102(11):3751-3758.
[21]Bar-On P,Mohsen M,Zhang Renliang,et al.Kinetics of nitroxide reaction with iron(Ⅱ)[J].Journal of the American Chemical Society,1999,121(35):8070-8073.
(责任编辑薛荣)
Regional selective catalytic oxidation of 5-hydroxymethylfurfural to prepare 2,5-diformylfuran on metal nitrate/TEMPO
GUO Cong,WU Qi,WU Tinghua,WU Ying
(InstituteofPhysicalChemistry,ZhejiangNormalUniversity,Jinhua321004,China)
The regional selective oxidation of 5-hydroxymethylfurfural converted to 2,5-diformylfuran was an important catalytic reaction. Different metal nitrate was used to examine the effect of catalytic oxidation of HMF to DFF, and the mechnism was studied. Meanwhile, the influence of different reaction conditions on the reaction properties was discussed. The results indicated that the activity of ferric nitrate was the highest, the selectivity of DFF was 96.6%, and the conversion rate of HMF reached 99%.
aerobic oxidation; 5-hydroxymethylfurfural; iron nitrate; TEMPO; 2,5-diformylfuran
10.16218/j.issn.1001-5051.2016.03.014
收文日期:2015-09-29;2015-10-21
国家自然科学基金资助项目(21373188)
郭聪(1988-),男,山西霍州人,硕士研究生.研究方向:催化化学.
吴廷华.E-mail: thwu@zjnu.cn
O064.3
A
1001-5051(2016)03-0314-06
