曲妥珠单抗联合化疗对HER2阳性晚期胃癌患者疗效及血清肿瘤标志物的影响
2016-09-29宋子正李靖华臧爱民商琰红河北大学附属医院河北保定071000
宋子正,李靖华,臧爱民,杨 华,商琰红(河北大学附属医院,河北保定 071000)
曲妥珠单抗联合化疗对HER2阳性晚期胃癌患者疗效及血清肿瘤标志物的影响
宋子正*,李靖华#,臧爱民,杨华,商琰红(河北大学附属医院,河北保定071000)
目的:探讨曲妥珠单抗联合化疗对人表皮生长因子受体2(HER2)阳性晚期胃癌患者疗效及血清肿瘤标志物的影响。方法:将74例确诊为晚期胃癌且HER2呈阳性表达的患者根据入院先后顺序分为观察组和对照组,各37例。对照组患者接受顺铂+卡培他滨化疗;观察组患者在对照组治疗基础上,于化疗第1天加用曲妥珠单抗静脉滴注,8 mg/kg。21 d为1个周期,两组均治疗6个周期。比较两组患者的近期疗效、远期疗效、血清肿瘤标志物含量和毒副反应发生情况。结果:观察组患者的有效率(56.76%vs.32.44%)和控制率(89.19%vs.65.86%)均明显高于对照组,差异均有统计学意义(P<0.05);观察组患者的无进展生存时间、中位生存时间均明显长于对照组,差异均有统计学意义(P<0.05);观察组患者的血清癌胚抗原、糖类抗原(CA)199、CA724含量均明显低于对照组,差异均有统计学意义(P<0.05)。两组患者的恶心呕吐、肝功能损害、骨髓抑制、手足综合征等毒副反应发生率比较,差异均无统计学意义(P>0.05)。结论:曲妥珠单抗联合化疗有助于降低血清肿瘤标志物含量,改善HER2阳性晚期胃癌患者的近期疗效和远期疗效。
曲妥珠单抗;人表皮生长因子受体2;晚期胃癌;血清肿瘤标志物
胃癌是我国消化道最常见的恶性肿瘤之一,早期诊断的难度较大,多数患者在确诊时已经发展至中晚期,错过了手术切除的机会。临床上治疗晚期胃癌的主要方式是全身静脉化疗,通过化疗药物的使用来杀灭癌细胞、抑制肿瘤发展、延长患者生存时间[1]。但是,化疗因受到肿瘤分期、药品不良反应、药物耐受等因素的影响,效果并不十分理想,晚期胃癌会进一步发生远处转移,使患者生存率降低。近年来的研究认为,人表皮生长因子受体2(HER2)过度表达与胃癌的发生和发展有关,靶向HER2的药物曲妥珠单抗能够拮抗该受体的功能,进而限制肿瘤的发展[2-3]。因此,曲妥珠单抗已被美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)列入治疗胃癌的一线药物,但较少有从肿瘤标志物的角度分析其有效性的文献报道。鉴于此,本研究采取随机对照的方法,探讨了曲妥珠单抗联合化疗对HER2阳性晚期胃癌患者疗效及血清肿瘤标志物的影响。
1 资料与方法
1.1纳入与排除标准
纳入标准:(1)经胃镜检查及病理学活检确诊为胃癌且HER2阳性表达者;(2)经CT或磁共振(MRI)检查确认发生远处转移;(3)不具备手术指征。
排除标准:(1)血清癌胚抗原(CEA)<3.4 ng/ml者;(2)HER2阴性表达者;(3)儿童、妊娠期或哺乳期妇女;(4)合并有其他严重疾病者。
1.2研究对象
选择2008年3月-2012年6月在我院确诊为晚期胃癌且HER2阳性表达的74例患者,根据入院先后顺序分为观察组和对照组,各37例。观察组中男性24例,女性13例;年龄50~68岁,平均年龄(61.23±7.69)岁;卡氏(KPS)评分60~100分,平均得分(77.32±8.14)分;病灶部位:胃癌20例,胃食管连接部癌17例;分化程度:中高分化癌19例,低分化癌18例。对照组中男性26例,女性11例;年龄50~65岁,平均年龄(61.52±7.22)岁;KPS评分60~98分,平均得分(77.28±7.85)分;病灶部位:胃癌19例,胃食管连接部癌18例;分化程度:中高分化癌20例,低分化癌17例。两组患者的性别、年龄、KPS评分、病灶部位、分化程度、血清肿瘤标志物等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经我院医学伦理委员会审核通过,患者均知情同意并签署知情同意书。
1.3治疗方法
对照组患者采用顺铂+卡培他滨化疗方案:注射用顺铂(齐鲁制药有限公司,批准文号:国药准字H37021358,规格:10 mg)115 mg/m2静脉滴注,d1;卡培他滨片(齐鲁制药有限公司,批准文号:国药准字H20133361,规格:0.5 g)1 000 mg/m2口服,bid,d1~14。观察组患者在对照组治疗基础上加用曲妥珠单抗[Roche Pharma(Schweiz)Ltd.,注册证号:国药准字J20110020,规格:440 mg]8 mg/kg静脉滴注,d1。两组均以21 d为1个周期,连续治疗6个周期。
1.4观察指标及疗效判定
1.4.1近期疗效参照世界卫生组织(WHO)实体肿瘤近期疗效标准[4]判定两组患者的近期疗效。完全缓解(CR):肿瘤消失且时间超过1个月;部分缓解(PR):肿瘤体积缩小50%以上且时间超过1个月;稳定(SD):肿瘤体积缩小≤50%或增大≤25%且时间超过1个月;进展(PD):肿瘤体积增大>25%或出现新病灶。有效率=(CR例数+PR例数)/总例数×100%;控制率=(CR例数+PR例数+SD例数)/总例数×100%。
1.4.2远期疗效随访3年内两组患者的生存情况和疾病发展情况,判断无进展生存时间和中位生存时间。无进展生存时间是指从接受治疗开始至疾病进展的时间;中位生存时间是指从接受治疗开始至死亡的时间。
1.4.3血清肿瘤标志物分别于治疗前和治疗4个周期时,采集两组患者空腹静脉血4 ml,以离心半径16 cm、转速3 000 r/min离心10 min,取上层血清,采用电化学发光法以TBA-120型全自动生化分析仪(日本东芝公司)检测CEA、糖类抗原(CA)199和CA724的含量。所有试剂盒均购自北京晶美生物工程有限公司。
1.4.4毒副反应根据WHO抗癌药物急性与亚急性毒性分级标准[5]将毒副反应分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级,主要观察两组患者在研究期间发生的恶性呕吐、肝功能损害、骨髓抑制、手足综合征等毒副反应。
1.5统计学方法
采用SPSS 20.0软件录入数据并进行统计分析。计量资料以±s表示,采用t检验;计数资料以率表示,采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1近期疗效
观察组患者的有效率为56.76%、控制率为89.19%,均明显高于对照组(分别为32.44%、65.86%),差异均有统计学意义(P<0.05)。两组患者近期疗效比较见表1。

表1 两组患者近期疗效比较[例(%)]Tab 1 Comparison of short-term efficacy between 2 groups [case(%)]
2.2远期疗效
观察组患者的无进展生存时间为(7.62±0.88)月、中位生存时间为(12.63±1.52)月,对照组患者分别为(4.64±0.55)、(9.49±0.91)月,观察组均明显长于对照组,差异均有统计学意义(t=10.781~17.467,P<0.05)。
2.3血清肿瘤标志物
治疗前,两组患者的血清CEA、CA199、CA724含量比较,差异均无统计学意义(P>0.05)。治疗后,两组患者的血清CEA、CA199、CA724含量均较治疗前明显降低,且观察组均明显低于对照组,差异均有统计学意义(P<0.05)。两组患者治疗前后血清肿瘤标志物含量比较见表2。
表2 两组患者治疗前后血清肿瘤标志物含量比较(±s)Tab 2 Comparison of serum tumor marker content between 2groups before and after treatmen(t±s)
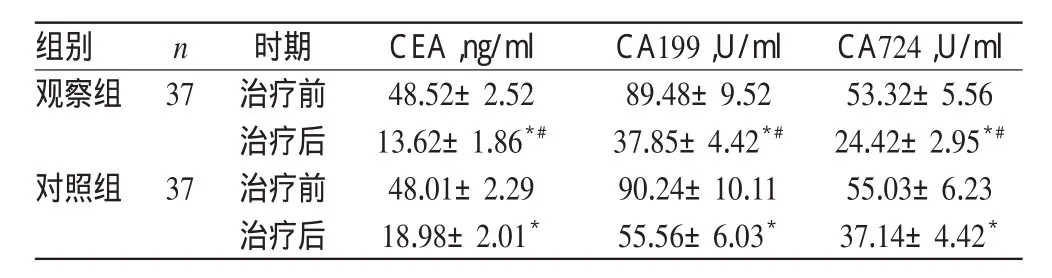
表2 两组患者治疗前后血清肿瘤标志物含量比较(±s)Tab 2 Comparison of serum tumor marker content between 2groups before and after treatmen(t±s)
注:与治疗前比较,t=14.246~36.445,*P<0.05;与对照组治疗后比较,t=11.906~27.001,#P<0.05Note:vs.before treatment,t=14.246-36.445,*P<0.05;vs.control group after treatment,t=11.906-27.001,#P<0.05
CA724,U/ml 53.32±5.56 24.42±2.95*#55.03±6.23 37.14±4.42*组别观察组n 37对照组37时期治疗前治疗后治疗前治疗后CEA,ng/ml 48.52±2.52 13.62±1.86*#48.01±2.29 18.98±2.01*CA199,U/ml 89.48±9.52 37.85±4.42*#90.24±10.11 55.56±6.03*
2.4毒副反应
两组患者的毒副反应主要有恶心呕吐、肝功能损害、骨髓抑制、手足综合征等,且多为Ⅰ、Ⅱ级,组间比较差异无统计学意义(P>0.05)。两组患者毒副反应比较见表3。

表3 两组患者毒副反应比较[例(%)]Tab 3 Comparison of toxic and side effects between 2 groups[case(%)]
3 讨论
曲妥珠单抗是针对HER2的人源化单克隆抗体,能够拮抗HER2所介导的生物学功能,进而抑制细胞周期的发展、阻断细胞增殖、诱导细胞凋亡、减少肿瘤局部新生血管形成等[6]。该药物最先被用于HER2阳性表达的乳腺癌的治疗,能够与常规化疗方案联合应用来改善化疗效果、抑制乳腺癌发展。近年来,关于曲妥珠单抗下游分子机制的研究认为,该药物能够抑制细胞周期蛋白A、D1以及E的表达,使细胞周期停滞[7];此外,还能够抑制HER2/磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B (AKT)信号通路的激活,限制核因子(NF)-κB的核转位,从而抑制下游多种恶性分子的表达[8]。
随着分子生物学研究的不断深入,胃癌分子靶向治疗已成为研究的热点。但是,有关曲妥珠单抗联合化疗在HER2阳性胃癌中的研究,各文献报道仍不一致。有学者认为,单一靶向药物的治疗效果有限,联合化疗药物后会受到给药时间和顺序的影响[9]。但绝大多数学者均以曲妥珠单抗联合化疗的方案来治疗HER2阳性晚期胃癌,发挥曲妥珠单抗对HER2所介导的生物学效应的抑制作用,从而更为有效地杀灭胃癌细胞[10-11]。本研究结果表明,观察组患者的有效率、控制率均明显高于对照组,无进展生存时间、中位生存时间均明显长于对照组,与孙薇薇等[12]报道基本相似,说明曲妥珠单抗联合化疗能够取得更为理想的近期疗效,延长患者的无瘤生存时间和总生存时间。
胃癌的发生、发展过程伴随着血清多种肿瘤标志物含量的变化。近年来的研究认为,与胃癌病情相关的肿瘤标志物包括CEA、CA199、CA724等,其含量能够反映胃癌的恶性程度以及胃癌细胞的活力[13-14]。CEA是最早被用于恶性肿瘤诊断的标志性抗原分子;CA199是用于胃肠道癌症筛查的糖蛋白;CA724是新发现的一类高分子质量的糖蛋白,对于诊断胃癌具有较高的灵敏性和特异性[15]。本研究结果表明,观察组患者血清CEA、CA199、CA724的含量均显著低于对照组,与国外文献[16]报道相似,提示曲妥珠单抗联合化疗能够更为有效地杀灭胃癌细胞、抑制胃癌发展。
毒副反应是晚期肿瘤患者在治疗过程中无法回避的一个问题。本研究中,两组患者均有恶心呕吐、肝功能损害、骨髓抑制、手足综合征现象,尽管多为Ⅰ、Ⅱ级,且组间比较差异无统计学意义(P>0.05),但两组的恶心呕吐发生率均超过了90%,一则说明曲妥珠单抗联合化疗并未增加毒副反应,二则提示如何降低毒副反应仍是一个需要重点关注的问题。
综上所述,曲妥珠单抗联合化疗有助于降低HER2阳性晚期胃癌患者的血清肿瘤标志物含量、改善患者的近期和远期疗效,且不会增加毒副反应。但本研究因受到样本对象来源与数量的限制,观察指标相对较少,治疗的有效性与安全性仍缺乏足够的数据支撑,需要扩大样本展开前瞻性的随机对照试验加以证实。
[1]Palacio S,Loaiza-Bonilla A,Kittaneh M,et al.Successful use of Trastuzumab with anthracycline-based chemotherapy followed by trastuzumab maintenance in patients with advanced HER2-positive gastric cancer[J].Anticancer Res,2014,34(1):301.
[2] 绒佩佩,宋金春,吴玥.曲妥珠单抗联合化疗用于HER2晚期胃癌的成本-效果分析[J].中国药房,2015,26(5):577.
[3]Endo S,Kyamada T,Okuyama M,et al.A case of HER2-positive advanced gastric cancer successfully treated via capecitabine,cisplatin,and trastuzumab combination chemotherapy[J].Gan To Kagaku Ryoho,2015,42(3):359.
[4]Eisenhauer EA,Therasse P,Boqaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline:version 1.1[J].Eur J Cancer,2009,45(2):228.
[5]Kinoshita T,Azuma K,Sasada T,et al.Chemotherapy for non-small cell lung cancer complicated by idiopathic interstitial pneumonia[J].Oncol Lett,2012,4(3):477.
[6]赵鹏,陈炳光,莫如康,等.曲妥珠单抗联合卡培他滨和顺铂治疗HER-2阳性晚期胃癌的应用[J].国际医药卫生导报,2012,18(2):312.
[7] 张小田,伍远航,龚继芳,等.曲妥珠单抗在HER2阳性胃癌或胃食管结合部腺癌中的临床应用实践:75例回顾性研究[J].解放军医学杂志,2014,39(3):206.
[8]Cosson VF,Ng VW,Lehle M,et al.Population pharmacokinetics and exposure-response analyses of trastuzumab in patients with advanced gastric or gastroesophageal junction cancer[J].Cancer Chemother Pharmacol,2014,73(4):737.
[9]Lee JY,Hong M,Kim ST,et al.The impact of concomitant genomic alterations on treatment outcome for trastuzumab therapy in HER2-positive gastric cancer[J].Sci Rep,2015,5:9 289.
[10]沈琳,徐建明,冯奉仪,等.曲妥珠单抗联合化疗一线治疗人表面生长因子受体2阳性无法手术的局部进展或转移性胃或胃食管结合部腺癌的多中心随机对照Ⅲ期临床试验中国亚组报告[J].中华肿瘤杂志,2013,35(4):295.
[11]Koo DH,Ryo BY,Kim HJ,et al.A prognostic model in patients who receive chemotherapy for metastatic or recurent gastric cancer:validation and comparison with previous models[J].Cancer Chemother Pharmacol,2011,68 (4):913.
[12]孙薇薇,陈文.曲妥珠单抗治疗转移性胃癌的临床效果和经济学结果分析[J].中国药房,2015,26(23):3 309.
[13]朱昱冰,葛少华,张连海,等.肿瘤标志物在胃癌患者中的诊断及预后价值[J].中华胃肠外科杂志,2012,15(2):161.
[14] 孙杰,潘赛英,陈倩琪,等.曲妥珠单抗联合FOLFIRI治疗HER2阳性晚期胃癌的疗效观察[J].南方医科大学学报,2011,31(8):1 458.
[15]Duffy MJ,Lamerz R,Haglund C,et al.Tumor markers in colorectal cancer,gastric cancer and gastrointestinal stromal cancers:European group on tumor markers 2014 guidelines update[J].Int J Cancer,2014,134(11):2 513.
[16]Michirra T,Miyazaki S,Fujita S,et al.A case of advanced HER2-positive gastric cancer with a partial response to molecular targeted chemotherapy(S-1+CDDP+Trastuzumab)[J].Gan To Kagaku Ryoho,2014,41(12):2 346.
(编辑:胡晓霖)
Effect of Trastuzumab Combined with Chemotherapy on Efficacy and Serum Tumor Markers in Patients with HER2PositiveAdvanced Gastric Cancer
SONG Zizeng,LI Jinghua,ZANG Aimin,YANG Hua,SHANG Yanhong(Affiliated Hospital of Hebei University,Hebei Baoding 071000,China)
OBJECTIVE:To discuss the effect of trastuzumab combined with chemotherapy on efficacy and serum tumor markers in patients with human epidermal growth factor receptor 2(HER2)positive advanced gastric cancer.METHODS:74 advanced gastric cancer patients in HER2 positive were randomly divided into observation group and control group,37 cases in each group. Control group received cisplatin+capecitabine chemotherapy;based on it,observation group additionally received trastuzumab by intravenous infusion in the first day,8 mg/kg.21 d was a course,and it lasted for 6 months.The short-term efficacy,long-term efficacy,serum tumor marker contents and toxic and side effects were compared between 2 groups.RESULTS:The effective rate (56.76%vs.32.44%)and control rate(89.19%vs.65.86%)in observation group were significantly higher than control group,the differences were statistically significant(P<0.05);progression-free survival time and median survival time in observation group significantly longer than control group,the differences were statistically significant(P<0.05);contents of serum carcinoembryonic antigen,carbohydrate antigen(CA)199,CA724 in observation group significantly lower than control group,the differences were statistically significant(P<0.05).And there were no significant differences in the incidences of nausea and vomiting,liver damage,bone marrow suppression and hand-foot syndrome in 2 groups(P>0.05).CONCLUSIONS:Trastuzumab combined with chemotherapy helps to reduce serum tumor markers content,and improve short-term efficacy,long-term efficacy of advanced gastric cancer patients with positive HER2.
Trastuzumab;Epidermal growth factor receptor 2;Gastric cancer;Tumor markers
R735.2文献标志码A
1001-0408(2016)23-3249-03
10.6039/j.issn.1001-0408.2016.23.28
*副主任医师,硕士。研究方向:恶性肿瘤的内科治疗。电话:0312-5983032。E-mail:13932268911@163.com
副主任医师,硕士。研究方向:恶性肿瘤的综合治疗。电话:0312-5981610。E-mail:lijinghua56789@sina.com
2015-11-18
2016-04-13)
