橘皮多糖超声辅助提取工艺优化及其抗氧化活性研究
2016-09-28刘存芳
刘存芳 史 娟 张 强
(陕西理工大学化学与环境科学学院,陕西 汉中 723000)
橘皮多糖超声辅助提取工艺优化及其抗氧化活性研究
刘存芳 史娟 张强
(陕西理工大学化学与环境科学学院,陕西 汉中723000)
以橘皮为原料,脱除脂溶性物质后采用超声波辅助法提取其中的水溶性多糖,以提取温度、提取时间、提取功率、料液比为自变量,多糖提取率为响应值,设计正交试验进行优化,确定最佳提取工艺条件。并利用Fenton反应测试橘皮多糖的抗氧化活性。结果表明:在提取温度70 ℃、提取时间50 min、超声波功率280 W、料液比1∶25(g/mL)的条件下橘皮多糖的提取率可高达28.86%,提取效果显著。体外抗氧化试验表明,橘皮多糖对羟基自由基具有清除作用且存在量效关系。
橘皮;多糖;超声波;提取;抗氧化
橘皮是芸香科(Rutaceae)植物橘子的果皮,中药上称为陈皮[1],可食药两用,具有健脾开胃、理气宽中、降逆止呕、燥湿行气、止咳化痰等功效[2-4]。橘皮中含有果胶[2]、黄酮[3]、挥发油[4-5]、色素、矿物元素、多糖等多种活性物质[6],其中多糖含量较为可观。活性多糖是醛糖或酮糖以糖甙键由20多个以上单糖键合起来的大分子聚合物,存在于植物、动物以及微生物细胞壁中,其中植物性多糖一般有抑制纤维细胞生长因子的信号转导和脂多糖诱导的炎症反应的作用[6],能预防肿瘤生长和转移,可调节机体免疫力,有抗凝血、抗病毒、抗氧化、抗肿瘤等生物活性[7]。目前关于植物性多糖提取方法及抗氧化活性的研究报道[7-8]较多,橘皮多糖提取方法有水浴加热法[9]、微波辅助法[10]、星点设计—效应面法[11]等,水浴加热法一般需2 h或更长提取时间,微波辅助法只需10~20 min,但微波辅助法不易形成规模化生产,超声辅助提取法有耗时较少、设备简单、操作方便等特点,且超声辅助提取橘皮多糖的研究报道还尚少。超声辅助提取橘皮多糖可节能降耗,克服提取过程中时间长、加热温度高的不足,对超声辅助提取橘皮多糖的工艺进行优化,探索规模化生产的提取技术。
本研究拟采用超声波辅助提取橘皮中的多糖,用正交试验优化橘皮多糖的提取工艺,并测试橘皮多糖体外羟基自由基清除效果,旨在为橘皮的综合利用以及橘皮多糖的开发提供依据。
1 材料与方法
1.1材料与试剂
橘皮:在2013年10月下旬收集于陕西南部秦巴山区,由陕西理工学院植物学分类专家赵桦教授鉴定,确认为成熟橘子(CitrusreticulateBlanco)的外皮,经低温下烘干,粉碎、过筛,密封保存备用;
浓硫酸、葡萄糖、苯酚、乙醚、无水乙醇、正丁醇、邻二氮菲、丙酮、磷酸二氢钠、磷酸氢二钠、硫酸亚铁、过氧化氢(30%)等:分析纯,西安化学试剂厂;
超纯水:二次蒸馏水,自制;
0.15 mol/L pH 7.4的PBS缓冲液配制:准确称取磷酸氢二钠(含结晶水)7.164 g和磷酸二氢钠(含结晶水)3.121 g,分别定容于100 mL容量瓶中,吸取磷酸氢二钠81.0 mL和磷酸二氢钠19.0 mL,定容于150 mL的容量瓶中,备用。
1.2主要仪器设备
紫外可见分光光度计:UV-6300PC型,上海美谱达有限公司;
超声波清洗机:SB-4200DTD型,宁波新芝生物科技有限公司;
恒温水浴锅:HH型,河北省黄骅市渤海电器厂;
循环水式多用真空泵:SHB-III型,郑州长城科工贸有限公司;
电热恒温鼓风干燥箱:DHG-9070A型,上海祁欣科学仪器有限公司;
旋转蒸发仪:RE2000E型,上海科升仪器有限公司;
中草药粉碎机:FW177型,天津市泰斯特仪器有限公司;
电子天平:BSA224S-CW型,赛多利斯科学仪器有限公司;
索氏提取器:200~500 mL,天津化玻仪器厂。
1.3方法
1.3.1橘皮脱除脂溶性物质准确称取橘皮粉末,以乙醚为溶剂在索氏提取器中回流提取至无色,蒸馏回收乙醚,再换用体积比为95.5%的乙醇回流提取8 h,蒸馏回收乙醇,以脱除橘皮中的脂溶性物质。
1.3.2葡萄糖标准曲线的制作精确称取250.00 mg葡萄糖标准品定容于50 mL容量瓶中,移取1 mL 5 mg/mL 的葡萄糖溶液到另一个50 mL 容量瓶中,加水稀释至刻度配成0.1 mg/mL 的葡萄糖标准溶液。准确量取0.0,0.2,0.4,0.6,0.8,1.0,1.2,1.4 mL葡萄糖标准溶液于各比色管中,分别加蒸馏水补足2.0 mL,各加入5.0%苯酚溶液1 mL和浓硫酸5 mL摇匀,沸水浴15 min,取出后迅速冷却至室温,在波长490 nm处测定各吸光度,用空白试剂作参比。
1.3.3橘皮多糖的提取和测定将索氏提取后的橘皮粉末,以水为提取溶剂,在不同提取温度、提取时间、提取功率、料液比条件下从橘皮粉末提取多糖,重复提取两次,合并提取液,经过滤,脱色,定容,用苯酚硫酸比色法测定橘皮多糖的含量[7]。
1.3.4橘皮多糖提取的单因素试验及正交试验
(1) 提取时间:在超声波功率280 W,料液比1∶20(g/mL),提取温度70 ℃时,提取时间分别为30,40,50,60,70 min条件下,测定橘皮多糖提取率。
(2) 提取温度:在料液比1∶20(g/mL),提取时间50 min,超声波功率280 W时,提取温度为40,50,60,70,80 ℃条件下,测定橘皮多糖提取率。
(3) 超声波功率:在料液比1∶20(g/mL),提取时间50 min,提取温度70 ℃时,超声波功率为160,220,280,340,400 W条件下,测定橘皮多糖提取率。
(4) 料液比:在提取时间50 min,提取温度70 ℃,超声波功率280 W时,料液比为1∶10,1∶20,1∶30,1∶40,1∶50(g/mL)条件下,测定橘皮多糖提取率。
(5) 正交试验:在单因素试验基础上以提取温度、料液比、提取时间、超声波功率为试验因素,以橘皮多糖提取率为评价指标,设计L9(34)正交试验优化橘皮多糖的提取工艺条件。
1.3.5橘皮多糖的精制及抗氧化活性测试在优化的橘皮多糖提取工艺条件下,提取橘皮粗多糖,用Sevage 法除蛋白质后再加入体积5~6倍的无水乙醇,多糖呈絮状沉淀析出,静置12 h后,高速离心(3 500 r / min,40 s)倾倒出乙醇,用无水乙醇、丙酮依次洗涤沉淀3次,得到橘皮精制多糖,低温下干燥。用Fenton反应检测橘皮多糖的抗氧化活性,过氧化氢在亚铁离子作用下有氧化多种有机物的能力,过氧化氢与亚铁离子的溶液即为Fenton试剂,其中亚铁离子为同质催化剂,过氧化氢起氧化作用。准确称取50.00 mg橘皮精制多糖在25 mL容量瓶中定容,配成2 mg/mL多糖待测液,取8支15 mL比色管,编号,分别加入1 .0 mL 0.75 mmol/L邻二氮菲,1.5 mL pH为7.4的PBS缓冲液和1.0 mL 0.75 mmol/L的硫酸亚铁溶液,混合均匀,向6支比色管中分别加入0.1,0.2,0.3,0.4,0.5,0.6 mL多糖待测液,充分摇匀后,加入1 mL新配置的0.01%的过氧化氢溶液;另2支比色管中一个为损伤管,一个为未损伤管,不加多糖待测液,在损伤管中加入1 mL新配置的0.01%的过氧化氢溶液,未损伤管不加过氧化氢溶液,用超纯水将8支比色管的溶液体积补至15 mL,摇匀,置于37 ℃恒温水浴中保温60 min,用紫外可见分光光度计在波长λ=510 nm处,测量各溶液的吸光度A。羟基自由基的清除率按式(1)计算:
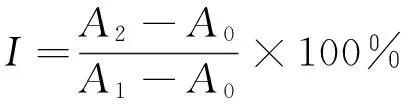
(1)
式中:
I——清除率,%;
A2——橘皮多糖溶液的吸光度;
A1——未损伤溶液的吸光度;
A0——损伤溶液的吸光度。
2 结果与分析
2.1葡萄糖标准曲线
以葡萄糖为对照品,苯酚硫酸法测定含量,绘制出标准曲线,见图1,曲线方程为Y=7.442 9X+0.009 3(R2=0.999),线性关系良好。
2.2橘皮多糖提取的单因素试验
2.2.1提取时间对橘皮多糖提取率的影响由图2可知,在30~50 min时多糖提取率随着时间增加而增加,这是因为随着超声波时间的增加,橘皮粉末内的多糖充分溶出。在50~70 min时多糖提取率随时间增加而减少,可能是长时间的超声波和加热会使部分多糖链断裂造成损失从而影响橘皮多糖提取率。因此最佳提取时间应选择50 min。
2.2.2提取温度对橘皮多糖提取率的影响由图3可知,在40~60 ℃时橘皮多糖提取率随着温度的升高而升高,到达70 ℃后,橘皮多糖提取率开始下降。可能是温度升高加速溶剂分子的运动速度,橘皮粉末变形和软化,使橘皮多糖从橘皮细胞壁中脱离出来,当温度超过70 ℃后在温度和超声波双重作用下,出现多糖的热不稳定性和降解现象,使橘皮多糖的提取率下降。因此最佳提取温度选择70 ℃。
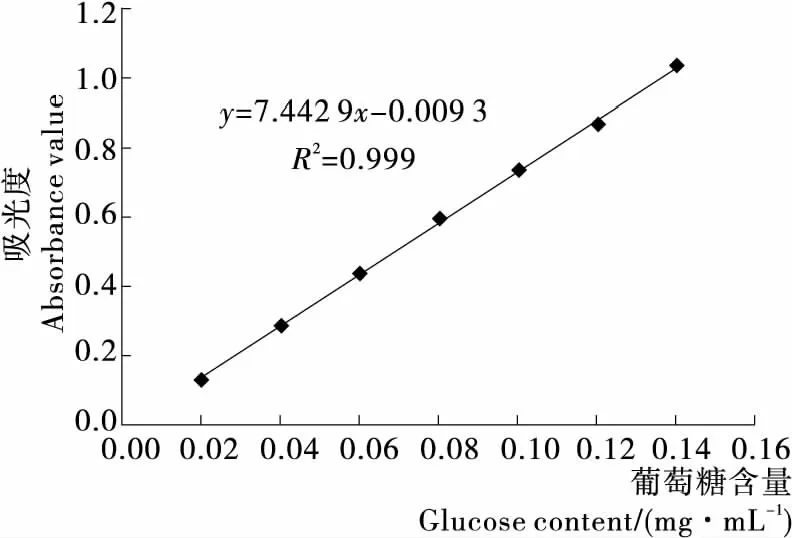
图1 葡萄糖标准曲线

图2 提取时间对多糖提取率的影响
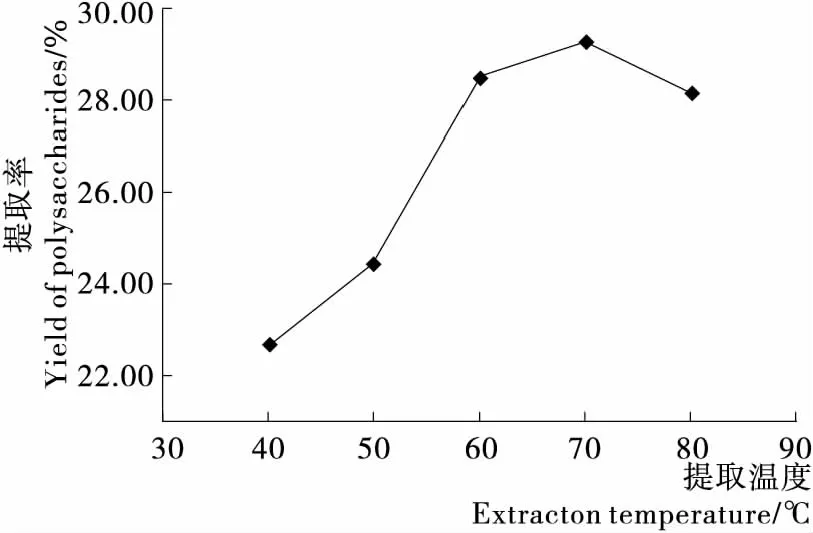
图3 提取温度对多糖提取率的影响
2.2.3超声波功率对橘皮多糖提取率的影响由图4可知,超声波功率为160~280 W时橘皮多糖的提取率逐渐升高,当超声波功率超过280 W时多糖提取率开始下降,可能是当超声波功率较小时,空化作用小,对多糖溶入溶剂中的速率影响小,提取率低,随着超声波功率的增大,超声波空化作用也随之加强,加速了多糖溶入溶剂;当超声波功率过大时,超声作用可能使局部升温过热而破坏多糖分子结构,从而降低多糖提取率。因此选择超声功率为280 W。

图4 超声波功率对多糖提取率的影响
2.2.4料液比对橘皮多糖提取率的影响由图5可知,当料液比为1∶20 (g/mL)时,多糖提取率最大,而料液比超过1∶30 (g/mL)后,多糖的提取率降低。溶剂较少时,多糖扩散阻力较大,多糖的溶出率小,随着溶剂用量的增加,橘皮中多糖更容易溶入溶剂中,多糖提取率随之增加;当溶剂用量过大时,溶剂会损耗过多的超声波能量,不利于多糖溶出,而且不利于后续的减压浓缩,增加提取成本。因此选择料液比为1∶20 (g/mL)。

图5 料液比对多糖提取率的影响
2.3正交试验优化橘皮多糖提取工艺
结合单因素最佳条件设计正交试验因素水平表L9(34) (见表1)。以橘皮多糖提取率为考察指标进行极差和均值分析确定超声波辅助热浸提橘皮多糖的最佳提取工艺见表2。由表2可知,影响橘皮多糖提取工艺的因素为:提取温度>料液比>超声波功率>提取时间,最佳提取工艺为提取温度70 ℃、料液比1∶25(g/mL)、超声波功率280 W、提取时间50 min。
经3次平行验证实验,在提取温度70 ℃、提取时间50 min、超声波功率280 W、料液比1∶25(g/mL)的条件下提取橘皮多糖,橘皮多糖提取率可高达28.86%。该工艺条件符合实际生产,提取中料液比取值偏小,可减少长时间加热溶剂蒸发的影响。

表1 正交试验因素水平表L9 (34)
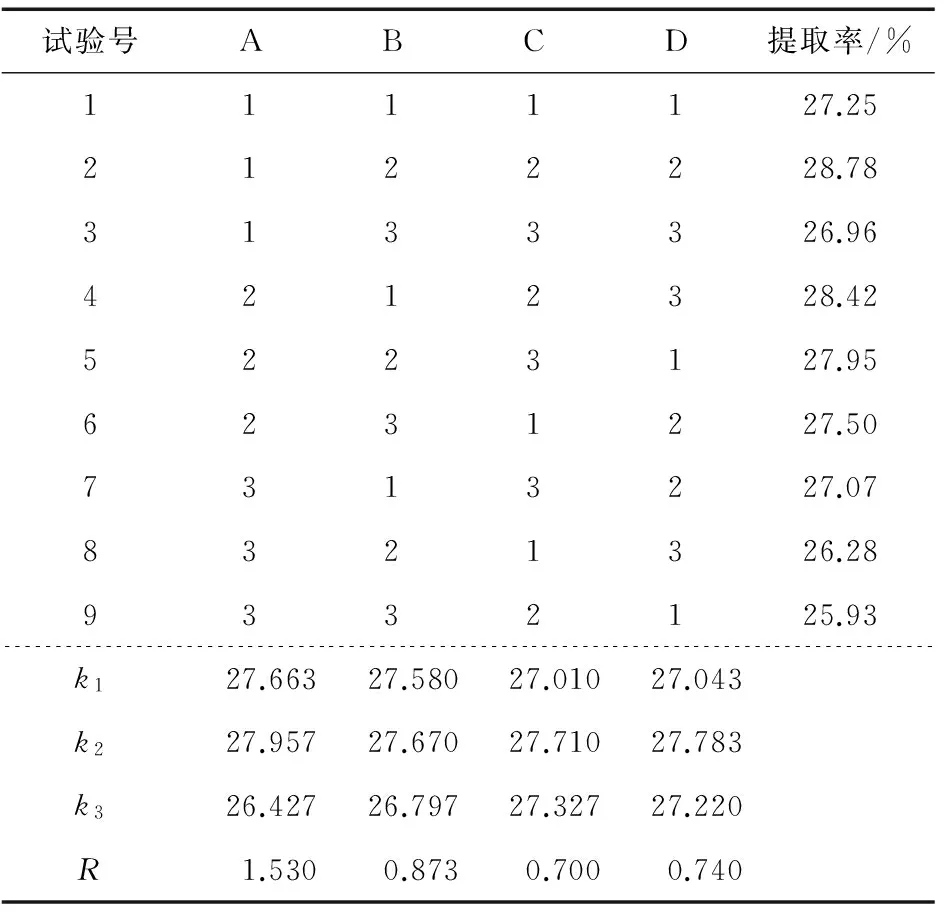
表2 正交试验结果
2.4橘皮多糖的抗氧化活性
用Fenton反应体系来测试橘皮多糖清除羟基自由基的作用,考察其抗氧化活性效果。由图6可知,橘皮多糖对亚铁—过氧化氢体系经Fenton反应产生的羟基自由基有明显的清除作用,且随着多糖浓度的增加清除作用增强。说明橘皮多糖具有抗氧化活性。
3 结论
用超声波辅助法提取橘子皮多糖,考察了提取温度、提取时间、超声波功率、料液比等单因素试验,并设计正交试验得到了最佳工艺条件:提取温度70 ℃、提取时间50 min、超声波功率280 W、料液比1∶25(g/mL),在该条件下橘皮多糖的提取率可高达28.86%,与水浴加热法[9]相比提取率显著提高,能省工省时,提取时料液比稍偏小可避免溶剂蒸发的影响,在多糖提取生产中有参考价值。橘皮多糖对Fenton反应产生羟基自由基有明显的清除作用,说明橘皮多糖有抗氧化活性,但橘皮多糖的结构、构效关系以及其他生理活性有待进一步研究。

图6 橘皮多糖清除羟自由基的作用
Figure 6Clearing hydroxy free base with the polysaccharide ofCitrusreticulatepeel
[1] 国家药典委员会. 中华人民共和国药典: 第一部[S]. 2015版. 北京: 化学工业出版社, 2015: 191.
[2] 曾祥燕, 赵良忠. 桔子皮渣水溶性膳食纤维提取工艺的优化[J]. 食品与机械, 2012, 28(1): 193-196.
[3] 黄寿恩, 李忠海, 何新益. 干燥方式对柑橘皮中主要抗氧化成分及其活性的影响[J]. 食品与机械, 2014, 30(5): 191-196.
[4] 付复华, 李忠海, 单杨, 等. GC—MS法分析三种柑橘皮精油成分[J]. 食品与机械, 2010, 26(3): 30-34.
[5] BHUYAN N, BARUA P C, KALITA P, et al. Physico-chemical variation in peel oils of Khasi mandarin (CitrusreticulataBlanco) during ripening[J]. Indian Journal of Plant Physiology, 2015, 20(3): 227-231.
[6] SINGANUSONG R, NIPORNRAM S, TOCHAMPA W, et al. Low power ultrasound-assisted extraction of phenolic compounds from mandarin (CitrusreticulataBlanco cv. Sainampueng) and lime (Citrus aurantifolia) peels and the antioxidant[J]. Food Analytical Methods, 2015, 8(5): 1 112-1 123.
[7] 田光辉. 香菇多糖提取工艺的优化[J]. 延安大学学报: 自然科学版, 2002, 21(1): 46-47.
[8] 田光辉, 刘存芳, 辜天琪, 等. 野生藿香中多糖的提取与测定及抗氧化活性研究[J]. 食品工业科技, 2010, 31(2): 249-251.
[9] 李粉玲, 蔡汉权, 李红, 等. 陈皮多糖的提取工艺[J]. 食品研究与开发, 2009, 30(10): 38-41.
[10] 陈韵, 石展望, 黄晓敏. 编程全自动微波密封辅助提取陈皮多糖研究[J]. 时珍国医国药, 2011, 22(1): 140-141.
[11] 刘荣, 韦正, 银玲, 等. 星点设计—效应面法优化陈皮多糖提取工艺[J]. 中国实验方剂学杂志, 2013, 19(18): 23-26.
Study on ultrasonic extraction and anti-oxidation activity of polysaccharide obtained from Citrus reticulate peel
LIU Cun-fangSHIJuanZHANGQiang
(SchoolofChemical&EnvironmentalSciences,ShaanxiUniversityofTechnology,Hanzhong,Shaanxi723000,China)
The extraction process ofCitrusreticulatepeel polysaccharide was studied by single factor experiment which controlled extraction temperature, extraction time, ultrasonic power and liquid ratio. The orthogonal experiment was texted and based on single factor experiments, then determined the best extraction process by experimental data. The oxidation resistance ofCitrusreticulatepeel polysaccharide was determined by Fenton reaction. The results showed that the extraction rate ofCitrusreticulatepeel polysaccharide could reach 28.86% when the extraction temperature was 70 ℃, extraction time 50 min, ultrasonic power 280 W, solid-liquid ratio 1∶25(g/mL). The hydroxyl radicals were cleared byCitrusreticulatepeel polysaccharide which showedCitrusreticulatepeel polysaccharide had oxidation resistance, then Polysaccharides and hydroxyl free radical clearance existed concentration-response relationship.
Citrusreticulatepeel; polysaccharide; ultrasonic; extraction; anti-oxidant activity
陕西省科技厅社会发展科技攻关项目(编号:2015SF270);陕西省教育厅服务地方专项项目(编号:15JF013)
刘存芳(1971—),女,陕西理工学院副教授,硕士生导师。E-mail:liucf@snut.edu.cn
2015—12—26
10.13652/j.issn.1003-5788.2016.08.036
