海藻来源海洋真菌的活性天然产物研究进展
2016-09-27金黎明包艳春张丽影权春善
金黎明,包艳春,张丽影,赵 晶,权春善
(大连民族大学 生命科学学院,辽宁 大连 116605)
海藻来源海洋真菌的活性天然产物研究进展
金黎明,包艳春,张丽影,赵晶,权春善
(大连民族大学 生命科学学院,辽宁 大连 116605)
近年来,海洋真菌因其能够产生大量结构新颖、活性显著的代谢产物而受到广泛关注,海藻来源真菌是其中重要的一类。对2014年以来发表的从海藻来源的海洋真菌中新发现的一些活性天然产物,按照来源海藻的类型(红藻、绿藻、褐藻)进行了分类,并就其化合物结构式和生物活性进行了概述和分析,为海藻来源海洋真菌活性天然产物的进一步研究开发提供参考。
海洋真菌;海藻;天然产物;活性
海洋真菌是海洋微生物的重要类群,近年来,海洋真菌的次生代谢产物由于具有结构多样、生物活性丰富、“创新指数”高、产量大等特点,已经成为化学、生物学、药学等领域关注的焦点[1-3]。近20年来,已报道的海洋真菌次级代谢产物的种类和数量呈快速上升的趋势,目前,已发现了几千种新的次级代谢产物,包括生物碱、聚酮、多肽、萜、甾、大环内酯等多种结构类型。其中许多代谢产物具有较强的抗菌、抗炎、抗病毒、抗肿瘤、抗污损和酶抑制等活性。据不完全统计,2010年1月-2013年2月已报道的895个海洋微生物新天然产物,其中576个来源于海洋真菌,占64 %[4]。
大多数海洋真菌与宿主共生,如海藻、红树林、海绵、珊瑚、海星、海葵、海草等,并可以从宿主中分离出来。其中,“海藻真菌”(AlgicolousFungi)是重要的一类,约占全部海洋真菌的三分之一[5]。一般的海藻真菌是指宿主为海洋藻类(主要是红藻、绿藻、褐藻)的真菌[6],目前国内外对于海藻真菌的研究也多集中于这几类。
本文按照海藻的类型进行分类,综述了2014年以来发表的海藻来源海洋真菌的新的活性天然产物,主要介绍天然产物的结构和生物活性。对于化合物结构式曾有文献报道的,以及虽是初次发现的新化合物但是没有生物活性的,本研究尚未包括在内。
1 红藻来源的海洋真菌活性天然产物
Alarif等[7]从沙特阿拉伯吉达红海岸的钝形凹顶藻中分离得到一种新的倍半萜 (化合物1),具有很强的抗真菌活性,其对白色念珠菌、热带假丝酵母菌、黄曲霉、黑曲霉的MIC值分别为2.92, 2.10, 2.92, 6.5 μg·mL-1。
Li X等[8]从福建平潭岛角叉菜中获得的一株真菌Penicilliumechinulatumpt-4中分离出一个新的混源萜arisugacin K (化合物2),它对大肠杆菌具有抑制作用,在每盘30 μg的浓度下,抑菌圈为8 mm。
Fang W等[9]从西沙群岛腔节藻属中获得的真菌AspergillusochraceusJcma1F17中分离出一个新的苯酰基倍半萜(化合物3),其对10 种癌细胞株(K562, H1975, U937, Molt-4, BGC-823, HL60, MCF-7, A549, Hela和Huh-7)显示出显著的细胞毒活性,IC50值为1.95~6.35 μM。此外,还对EV71和 H3N2具有抗病毒活性。
Liu H等[10]从山东荣成的海洋红藻Pterocladiellatenuis中分离出一株真菌PenicilliumchermesinumEN-480,从其代谢产物中发现了2个新的螺环混源萜Chermesins A和B (化合物4-5),对白色念珠菌、大肠杆菌、藤黄微球菌和溶藻弧菌都具有一定的抑菌活性,MIC值为8~64 μg·mL-1。
Zhang P小组从青岛海岸采集的红藻——带形蜈蚣藻中分离出一株真菌PaecilomycesvariotiiEN-291,在其代谢产物中发现了一系列新的化合物。包括:两种丁烯羟酸内酯butyrolactone IX (化合物6)和aspulvinone O (化合物7),具有清除DPPH自由基的活性,其IC50分别为186.3,11.6 μM[11];一种结构独特的3H-二氢二苯恶庚英生物碱varioxepine A (化合物8),具有广泛的抗菌活性,对嗜水气单胞菌、金黄色葡萄球菌、鳗弧菌、大肠杆菌、藤黄微球菌、哈氏弧菌、副溶血性弧菌的MIC值为16~64 μg·mL-1,对植物病原菌禾谷镰孢菌的MIC值为4 μg·mL-1[12];两种二酮哌嗪类生物碱varioloids A 和varioloids B (化合物9-10),对禾谷镰孢菌的MIC值分别为8,4 μg·mL-1[13];2种异戊烯吲哚生物碱,dihydrocarneamide A (化合物11) 和 iso-notoamide B (化合物12),对NCI-H460细胞系具有细胞毒活性,IC50分别为69.3,55.9 μM[14]。此外,还从烟台采集的红藻Polysiphoniascopulorum中分离出海洋真菌AspergillusnidulansEN-330,发现了两种新的化合物,含氯的吲哚二萜19-羟基震颤霉素A (化合物13)和无氯衍生物19-羟基震颤霉素E (化合物14),对鳃足虫具有细胞毒活性,LD50分别为3.2,4.6 μM,对水生病原菌(迟钝爱德华菌、鳗弧菌)及人类病原菌(大肠杆菌、金黄色葡萄球菌)的MIC值为16~64 μg·mL-1。其中含氯的化合物13比不含氯的化合物14显示出较高的活性,提示氯原子具有重要的作用[15]。
化合物1-14的结构式如图1。
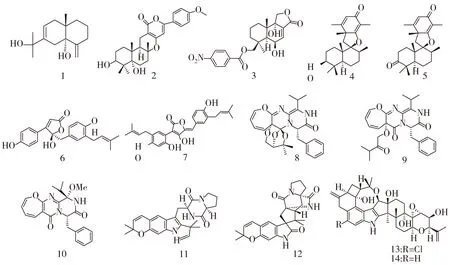
图1 化合物1-14的结构式
2 绿藻来源的海洋真菌活性天然产物
Chen C等[16]从一种格孢菌中分离出四种新的混源倍半萜,pleosporallin A-D (化合物15-18)和一种新的醌类化合物pleosporallin E (化合物19),菌株来源于中国南海猴岛采集的条浒苔样品。化合物18和19对细菌性溃疡病菌和假丝酵母的MIC值分别为9.48 ,7.44 μg·mL-1。化合物15-17对脂多糖诱导的鼠巨噬细胞系RAW264.7的细胞内IL-6的产生具有抑制作用,提示其具有抗炎作用。
Liu X等[17]从舟山群岛的刺松藻中从分离出一株真菌Aspergillusustuscf-42,能够生成一种新的麦角固醇衍生物,isocyathisterol (化合物20)。其对金黄色葡萄球菌和大肠杆菌具有一定的抑制作用,在每盘30 mg的浓度下,抑菌圈分别为5.7,6.7 mm。
Li X等[18]从青岛刺松藻中分离出一株海洋真菌——草酸青霉菌PenicilliumoxalicumEN-290,从其乙酸乙酯提取物中发现了一种新的次级代谢产物(化合物21),它对金黄色葡萄球菌的抑制作用(MIC=2.0 μg·mL-1)要高于对照氯霉素(MIC=4.0 μg·mL-1)。此外,它还对能够引起有害藻花的新月菱形藻具有抑制作用,在20,10,5 μg·mL-1质量浓度下的抑菌圈直径分别为20,16,10 mm。到目前为止,这种类型的抗藻花代谢产物只在海藻来源的草酸青霉菌中被发现,有可能是这种真菌对抗环境压力和生存威胁的防御机制。
化合物15-21的结构式如图2。
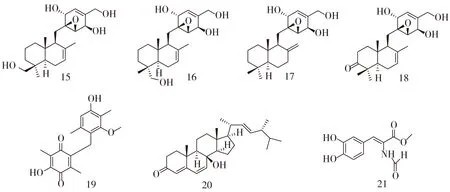
图2 化合物15-21的结构式
3 褐藻来源的海洋真菌活性天然产物
Li X等[19]从海洋褐藻来源真菌AspergilluswentiiEN-48中分离出一种新的苯甲酰胺衍生物(化合物22),具有显著的清除DPPH自由基的活力,IC50值为5.2 μM,远高于对照BHT (IC50= 36.9 μM)。
有报道,从德国黑尔戈兰岛的马尾藻中分离出两种曲霉(AspergillusBM-05和AspergillusBM-05ML),其联合培养后的提取物中含有一种新的环三肽,psychrophilin E (化合物23)。MTT法测定结果显示,其对肿瘤细胞K562、HCT116、A2780和A2780CisR具有体外抗增殖的作用,IC50分别为67.8,28.5,27.3,49.4 μM[20]。将两种真菌联合培养以获得新的化合物是目前研究的一种新方法。
Zhuravleva等[21-22]从日本海的褐藻Sargassummiyabei表面分离出两种青霉(PenicilliumthomiiKMM 4645和PenicilliumlividumKMM 4663),从它们的乙酸乙酯提取物中得到一系列新的活性产物。其中包括5种聚酮类化合物sargassopenillines A-G (化合物24-28)。化合物24,27来源自PenicilliumthomiiKMM 4645,化合物25-28来源自PenicilliumlividumKMM 4663。化合物25能够抑制JB6 Cl41细胞系中致癌细胞核因子AP-1的转录活性,作用12 h后IC50值达到15 μM。化合物27显示出对淋巴细胞的细胞毒活性,IC50值为38 μM。化合物26和28在10 μM浓度条件下能够抑制CD-1鼠腹腔巨噬细胞的粘附(抑制率达到30 %~40 %)。化合物24和27显示出对DPPH自由基的清除能力,IC50分别为100,50 μM[21]。另外,还包括7种新的混源萜(化合物29-35),其中化合物29、34、35来源自PenicilliumthomiiKMM 4645,化合物30-35来源自PenicilliumlividumKMM 4663。化合物29,30,34和35能够抑制JB6 Cl41细胞系中AP-1的转录活性。化合物29-35对1,3-β-D-葡萄糖内切酶(提取自海洋软体动物北寄贝晶杆)显示出显著的抑制活性[22]。
化合物22-35的结构式如图3。
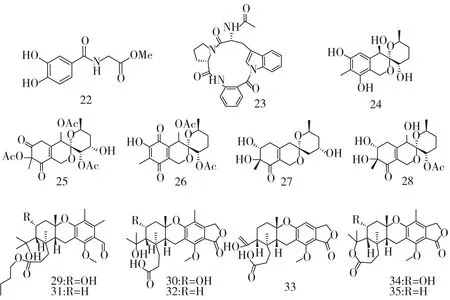
图3 化合物22-35的结构式
4 结论与展望
基于以上文献,海藻来源海洋真菌的活性天然产物按照来源的分类示意如图4。从图4可以看出,35种新报道活性产物中,海洋真菌的主要来源为红藻、绿藻、褐藻,分别占40 %、20 %和40 %。
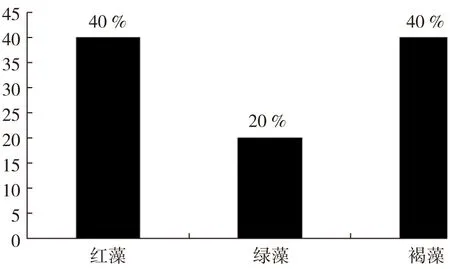
图4 海藻来源海洋真菌的活性天然产物
海藻来源海洋真菌的活性天然产物按照结构类型的分类示意如图5。从图5可以看出,萜类、聚酮类、生物碱类占的比例较大,分别为51 %、17 %和17 %;内酯、肽类、甾类化合物分别为6 %、6 %和3%,这与Rateb等人[23]的统计结果较为相似。可以看出,海藻真菌次级代谢产物的化学结构类型已经摆脱了陆生生物代谢产物的束缚,其结构骨架新颖、种类多样,并有杂原子(如氯,见化合物13)取代,这些结构特点与其特殊的生存环境有关,并在宿主生长发育、防御、攻击(如化合物21)等方面起着重要作用[6]。
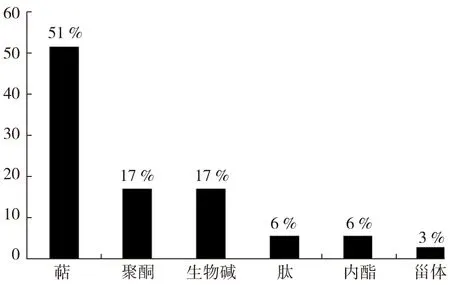
图5 海藻来源海洋真菌的活性天然产物
海藻来源海洋真菌的活性天然产物按照活性分类示意如图6。从图6可以看出,具有抗菌性的最多,占43 %;其次是细胞毒活性,占26 %;具有抗炎和抗氧化作用的分别占8 %、9 %,其他为14 %。
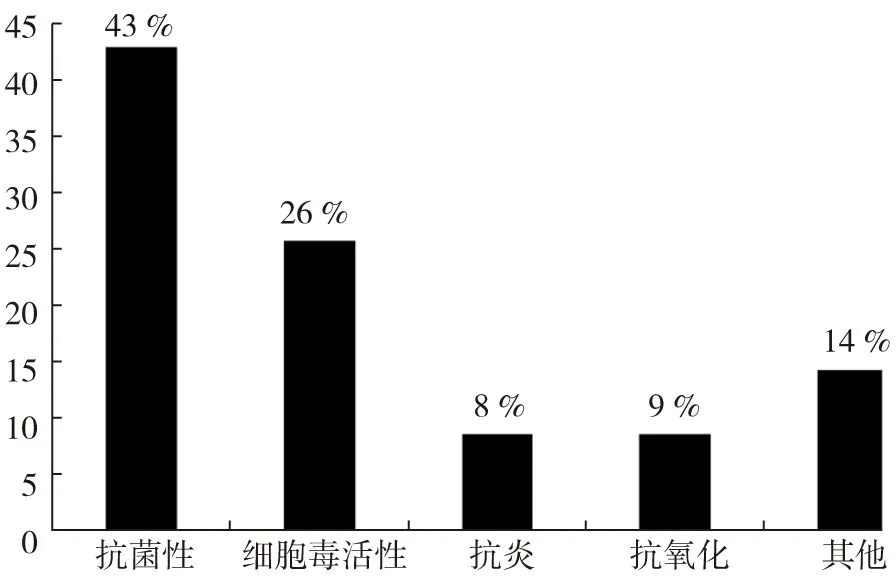
图6 海藻来源海洋真菌的活性天然产物
Blunt等[24]对海洋天然产物进行了分析,研究发现具有分子量(MW)<400和疏水性参数(clogP)<4特征的海洋真菌来源代谢产物所占的比例最高,表明其具有显著的口服生物利用度,成药的潜力大。近年来虽然从海洋真菌中得到的结构新颖的活性天然产物的数量很多,但并未有正式上市的药物[25]。此外,对海洋真菌来源的化合物活性多集中在抗菌和细胞毒活性研究方面,而活性功能的评价还相对单一。因此,对于海洋真菌活性物质的研究开发还有很长一段路要走。相信随着分子生物学、宏基因组学和组合生物合成等技术的进步,可以实现从海洋真菌中分离得到低毒、高效、作用靶点独特的新型药物并实现规模化生产[26]。
[1] SCHUEFFLER A, ANKE T. Fungal natural products in research and development[J].Nat Pro Rep, 2014, 31: 1425-1448.
[2] BLUNT J W, COPP B R, KEYZERS R A, et al. Marine natural products[J]. Nat Prod Rep ,2015, 32:116-211.
[3] CHEN G, WANG H, PEI Y. Secondary metabolites from marine-derived microorganisms[J]. J Asian Nat Prod Res, 2014, 16(1):105-122.
[4] 赵成英,朱统汉,朱伟明.2010~2013之海洋微生物新天然产物[J].有机化学,2013,33:1195-1234.
[5] KOHLMEYER J, KOHLMEYER E. Marine mycology: the higher fungi[M]. New York:Academic Press, 1979:704-705.
[6] 贾铁争,刘红兵,方玉春,等.海藻真菌次级代谢产物研究进展[J].中国抗生素杂志,2006,31(6):328-345.
[7] ALARIF W M, AL-FOOTY K O, ZUBAIR M S, et al.The role of new eudesmane-type sesquiterpenoid and known eudesmane derivatives from the red algaLaurenciaobtusaas potential antifungal-antitumour agents[J].Nat Prod Res,2015,20:1-6.
[8] LI X,MIAO F,LIANG X, et al. Meroterpenes from an algicolous strain ofPenicilliumechinulatum[J]. Magn Reson Chem,2014,52:247-250.
[9] FANG W,LIN X,ZHOU X, et al. Cytotoxic and antiviral nitrobenzoyl sesquiterpenoids from the marine-derived fungusAspergillusochraceusJcma1F17[J]. Med Chem Commun,2014,5:701-705.
[10] LIU H, LI X, LIU Y, et al. Chermesins A-D: meroterpenoids with a drimane-type spirosesquiterpene skeleton from the marine algal-derived endophytic fungus penicillium chermesinum EN-480[J]. J Nat Prod, 2016,79(4):806-811
[11] ZHANG P,LI X,WANG J, et al. New butenolide derivatives from the marine-derived fungusPaecilomycesvariotiiwith DPPH radical scavenging activity[J]. Phytochem Lett,2015,11:85-88.
[12] ZHANG P,MANDI A,LI X, et al. Varioxepine A, a 3H-oxepine-containing alkaloid with a new oxa-cage from the marine algal-derived endophytic fungusPaecilomycesvariotii[J]. Org Lett,2014,16:4834-4837.
[13] ZHANG P,LI X, WANG J, et al.Oxepine-containing diketopiperazine alkaloids from the algal-derived endophytic fungusPaecilomycesvariotiiEN-291[J]. Helvetica Chimica Acta,2015,98:800-804.
[14] ZHANG P, LI X, WANG J, et al. Prenylated indole alkaloids from the marine-derived fungusPaecilomycesvariotii[J]. Chinese Chemical Letters,2015,26(3):313-316.
[15] ZHANG P, LI XM,LI X, et al. New indole-diterpenoids from the algal-associated fungusAspergillusnidulans[J]. Phytochemistry Letters,2015,12:182-185.
[16] CHEN C, ZHOU Y, LIU X,et al. Antimicrobial and anti-inflammatory compounds from a marine fungus,Pleosporalessp[J]. Tetrahedron Letters,2015,56(45):6183-6189.
[17] LIU X,MIAO F,LIANG X, et al. Ergosteroid derivatives from an algicolous strain ofAspergillusustus[J]. Nat Prod Res,2014, 28:1182-1186.
[18] LI X, LI X, ZHANG P, et al. A new phenolic enamide and a new meroterpenoid from marine alga-derived endophytic fungusPenicilliumoxalicumEN-290[J]. J Asian Nat Prod Res,2015,17(12):1204-1212.
[19] LI X, LI X, Xu G, et al. Antioxidant metabolites from marine alga-derived fungusAspergilluswentiiEN-48[J]. Phytochem Lett,2014,7:120-123.
[20] EBADA S, FISCHER T, HAMACHER A, et al. Psychrophilin E, a new cyclotripeptide, from co-fermentation of two marine alga-derived fungi of the genusAspergillus[J]. Nat Pro Rep,2014,28(11):776-781.
[21] ZHURAVLEVA O I, SOBOLEVSKAYA M P, AFIYA-TULLOV S S, et al. Sargassopenillines A-G, 6,6-spiroketals from the alga-derived fungiPenicilliumthomiiandPenicilliumlividum[J]. Mar Drugs, 2014,12:5930-5943.
[22] ZHURAVLEVA O I, SOBOLEVSKAYA M P, LESHCHNKO E V, et al. Meroterpenoids from the alga-derived fungiPenicilliumthomiimaire andPenicilliumlividumwestling[J]. J Nat Prod, 2014,77:1390-1395.
[23] RATEB M E, EBEL R. Secondary metabolites of fungi from marine habitats[J]. Nat Prod Rep, 2011,28:290-344.
[24] BLUNT J W, COPP B R, MUNRO M H G, et al. Marine natural products[J]. Nat Prod Rep,2011,28:196-268.
[25] MHOFF J F. Natural products from marine fungi—still an underrepresented resource[J]. Mar Drugs,2016,14:1-19.
[26] DUARTE K, ROCHA-SANTOS T A P, FREITAS A C, et al. Analytical techniques for discovery of bioactive compounds from marine fungi[J]. Trends Anal Chem,2012,34:97-110.
(责任编辑邹永红)
Research Progress on Active Natural Products of Alga-derived Marine Fungi
JIN Li-ming, BAO Yan-chun, ZHANG Li-ying, ZHAO Jing, QUAN Chun-shan
(School of Life Science, Dalian Minzu University, Dalian Liaoning 116605, China)
In recent years, marine fungi have gained considerable recognition as they can produce many natural products with novel structures and interesting biological and pharmacological properties. Alga-derived marine fungi are one of the most important type of them. This review partially summarized the new bioactive compounds from alga-derived marine fungi with classification according to the types of alga (red alga, green alga, brown alga) reported from 2014 to the present. Their chemical structures and biological activities were introduced. This review provided references for further research on active natural products of alga-derived marine fungi.
marine fungi; alga; natural products; activities
2096-1383(2016)05-0457-05
2016-04-22;最后
2016-05-16
国家自然科学基金项目(21272031);中央高校基本科研业务费专项资金资助项目(DC201501020302,DC201502020201)。
金黎明(1979-),女,朝鲜族,黑龙江牡丹江人,副教授,博士,主要从事海洋微生物研究。
Q949.321
A
