几种保鲜处理对红阳猕猴桃活性氧代谢的影响
2016-09-26何靖柳段钰杜小琴刘继李玉李杰张清李素清董赟秦文
何靖柳,段钰,杜小琴,刘继,李玉,李杰,张清,李素清,董赟,秦文*
1(四川农业大学 食品学院,四川 雅安,625014) 2(雅安职业技术学院,四川 雅安,625000) 3(成都市农林科学院 农产品研究所,四川 成都,611130)
几种保鲜处理对红阳猕猴桃活性氧代谢的影响
何靖柳1, 2,段钰1,杜小琴1,刘继3,李玉1,李杰1,张清1,李素清1,董赟2,秦文1*
1(四川农业大学 食品学院,四川 雅安,625014) 2(雅安职业技术学院,四川 雅安,625000) 3(成都市农林科学院 农产品研究所,四川 成都,611130)

红阳猕猴桃;复合保鲜;活性氧代谢;主成分分析法
红阳猕猴桃(Actinidia chinensis Planch.var.rufopulpa LiangetFerguson)属中华(Actinidia chinensis)系品种,是四川省苍溪县选育出的世界首个红肉型新品种,于1997年被列为“国家级品种保护资源”[1]。研究发现,猕猴桃具有重要的营养成分和功能性物质,含丰富的抗氧化物质及抗氧化酶,以上物质可通过清除植物体内产生的自由基发挥其抗氧化能力[2];同时,该物质极不稳定、易分解,在贮藏期间会不断下降,而贮藏条件对其抗氧化活性影响很大;因此,保持较高活性氧代谢的贮藏条件均有助于维持鲜果的抗氧化能力,延长其贮藏寿命[3]。
1-MCP、臭氧处理及植物精油处理是近年来果蔬贮藏保鲜的研究热点[4]。1-MCP处理可较好地抑制贮藏期间果实的抗氧化物质及抗氧化酶的降低,使其保持较高的还原状态和抗氧化能力,延缓果实衰老并提高其抗性,其中,最佳处理浓度为0.9mg/L[5-8]。一定浓度的臭氧处理能明显延缓红阳果实抗氧化物质的下降,维持其较高的抗氧化酶活性,最适处理条件为200mg/h处理0.5h[9]。肉桂精油是从干燥的树皮中提取而得的挥发油,该物质对清除O2-·和·OH有显著效果;研究发现,红阳猕猴桃经400μL/L肉桂精油处理后,其保鲜效果较好,同时,能有效维持果实优良的抗氧化作用[10-12]。复合保鲜结合各种单一保鲜方式的优点,通过抑制果实内相关抗氧化酶的活力和其他生命活动,以维持其较高的活性氧代谢能力,其效果优于单一处理[13]。
目前,从事猕猴桃贮藏保鲜技术的研究主要集中于单一保鲜处理,对复合式保鲜技术及具体实施方法的研究鲜有报道;同时,对红阳猕猴桃活性氧代谢过程的研究报道很少。本试验以红阳猕猴桃为材料,研究单一保鲜处理(1-MCP、臭氧和肉桂精油)和复合处理(1-MCP分别与臭氧和肉桂精油结合)对红阳果实活性氧代谢的影响,通过主成分分析法,比较不同处理间的差异,从而进一步了解复合保鲜技术的优势。
1 材料和方法
1.1材料与设备
1.1.1材料
红阳猕猴桃(Actinidia chinensis Planch.var.rufopulpa LiangetFerguson),采自雅安市中里镇中里村种植专业合作社果园;肉桂精油,购于吉安盛大香料油有限公司(质量浓度大于99.0%)。
1.1.2试验仪器
BS210S型电子天平,塞多利斯北京天平有限公司;OZ-3G型臭氧发生器,BNPOZONETECHNOLOGYCO.LTD;可见分光光度计、紫外分光光度计,上海尤尼柯仪器有限公司;冷冻高速离心机,美国Thermo公司;DHG-9245A型电热恒温鼓风干燥箱,上海一恒科技有限公司;低温冷藏柜,天津市森罗科技发展有限责任公司;HWS24型电热恒温水浴锅,上海一恒科技有限公司。
1.2实验方法
1.2.1试验设计
选择大小均匀(60~70g/个)、成熟度(7~8成)基本一致、外表光滑、无机械伤、无病虫害的红阳猕猴桃果实,采后迅速运至四川农业大学食品学院园艺产品采后生理实验室低温冷库,8 ℃预冷30h后于(4±1)℃贮藏备用。
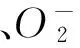
1.2.2测定项目
(1)VC:参照郑京平[14]紫外分光光度快速测定法。
(2)总酚:参照Dewanto等[15]方法,略加修改。
(3)花色苷:参照熊庆娥[16]的方法。
(4)SOD:参照氮蓝四唑(NBT)法[17],略加修改。
(5)POD:参照愈创木酚比色法[18],并略加修改。
(6)CAT:参照紫外吸收法[17]。
(7)总抗氧化能力:参照Pan等[19]方法,略加修改。
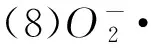
(9)·OH清除率:参照Yang和顾海峰等[21-22]方法,略加修改。
(10)DPPH· 清除率:参照Brand-Williams等[23]方法,略加修改。
1.2.3数据处理
所有试验数据计算标准误差,均用Origin8.0制图;采用SPSS19.0统计软件对数据进行方差分析(One-wayANOVA),利用邓肯式多重比较对差异显著性进行比较分析,P<0.05表示差异显著;采用SPSS19.0进行主成分分析。
2 结果与分析
2.1保鲜处理对果实抗氧化物质的影响
2.1.1对VC含量的影响
VC是一种重要的营养物质,其含量决定了果实贮藏品质的好坏。VC极不稳定,易分解;而在酸性条件下,稳定性较好,因此,贮藏期间,VC含量的变化趋势与可滴定酸一致,均随贮藏时间的推移,含量不断下降[10];如图1所示,复合处理组D和E组下降最缓慢,其次是单一处理组和CK组;贮藏至末期,复合处理组与相应的单一组对比,其差异性均显著(P<0.05)。由此可知,复合处理能有效地抑制红阳鲜果VC含量的降低。
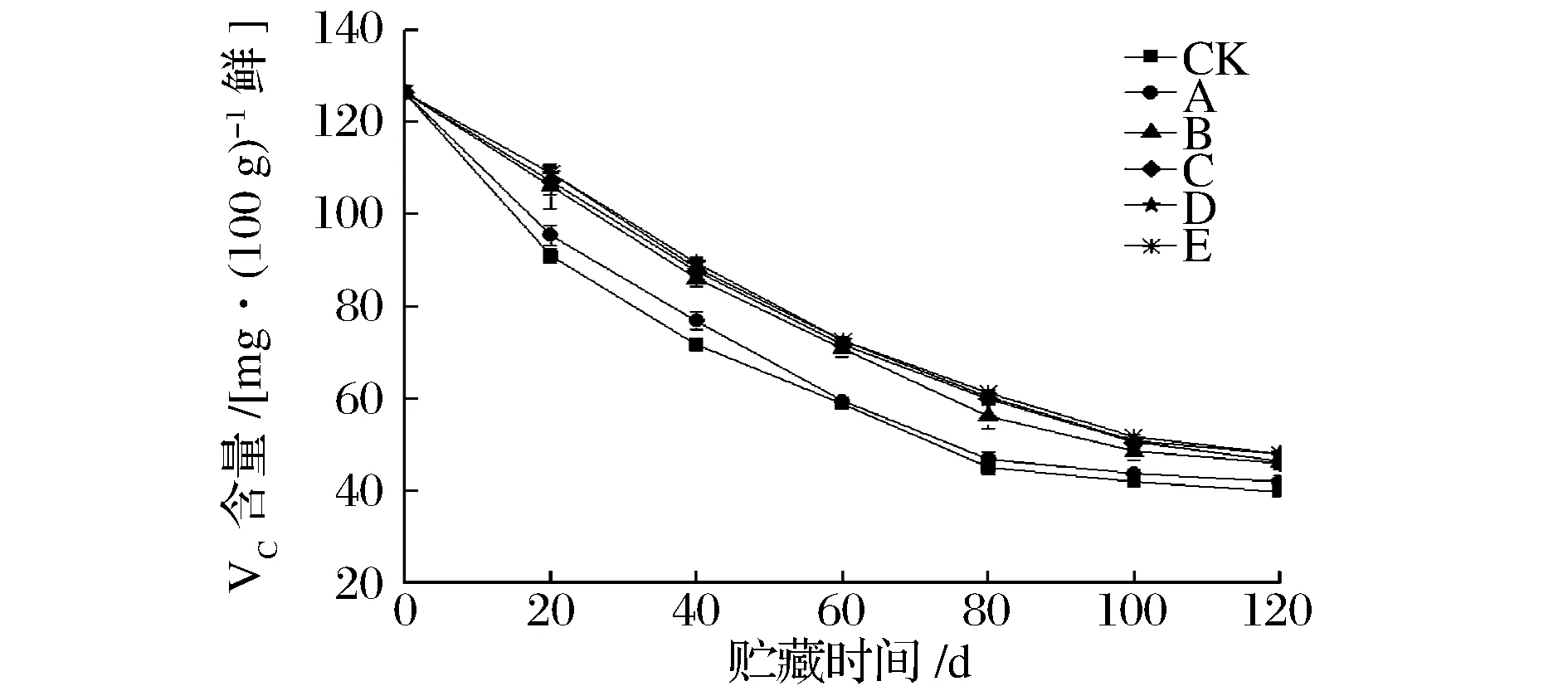
图1 不同处理对果实中VC含量的影响Fig.1 Effects of different treatments on VC content during storage
2.1.2对果实花色苷含量的影响
如图2所示,所有猕猴桃果实在整个贮藏过程中,其花色苷含量均不断减少;其中,复合处理组的下降趋势最缓慢,接着依次是单一处理组,CK处理下降最急促;贮藏至120d,E组的花色苷含量为15.4nmol/g鲜重,是A处理的1.32倍(P<0.01),是C处理的1.07倍(P<0.05),D组的花色苷含量为14.7nmol/g鲜重,分别是对应单一处理组A、B的1.27倍(P,0.05)和1.08倍(P<0.05),其两两之间的差异性均显著,由此说明果实经复合处理后对保持其花色苷含量效果很好。
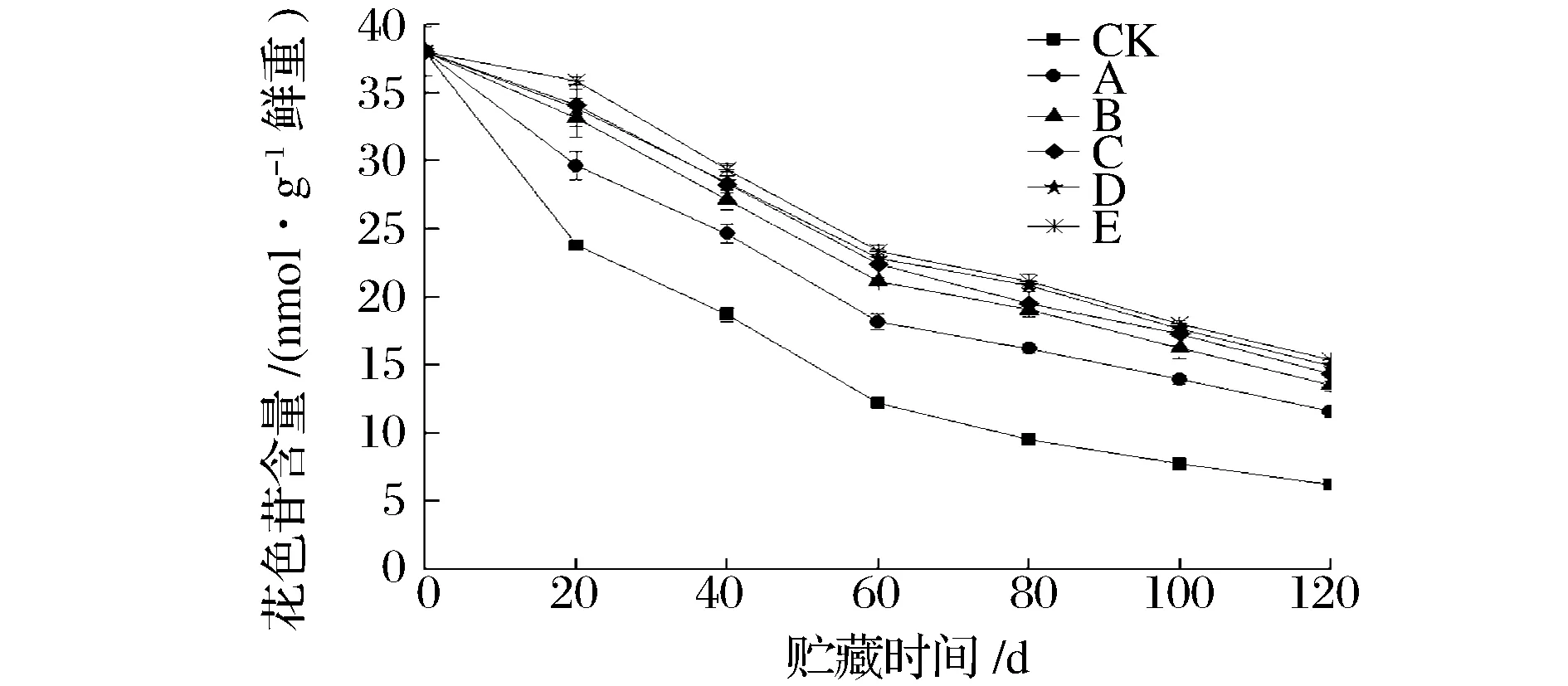
图2 不同处理对果实花色苷含量的影响Fig.2 Effects of different treatments on anthocyanins content of kiwifruit during storage
2.1.3对果肉总酚含量的影响
猕猴桃果肉中的总酚含量在贮藏期间整体呈先升后降的趋势;鲜果经不同处理后,其酚类含量变化趋势均存在一定差异,其中,复合处理组变化最缓慢,接着依次是单一处理组,CK组变化最急促;同时,CK组果实总酚含量贮藏至第60天即达到331.2mg/100g的峰值,而经单一和复合处理后的果实,总酚峰值均被推迟20d出现,且E组值最高,C组次之,接着是D组、B组、A组;贮至末期,复合处理组总酚含量均高于相应的单一处理组(见图3)。结果表明,与单一处理相比,鲜果经复合处理后能不同程度影响果实中总酚含量的变化,增强其抗氧化性。

图3 不同处理对果肉总酚含量的影响Fig.3 Effects of different treatments on phenols content of kiwifruit during storage
2.2保鲜处理对果实抗氧化酶的影响
2.2.1对果实SOD活性的影响
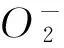

图4 不同处理对果实SOD活性的影响Fig.4 Effects of different treatments on SOD activity of kiwifruit during storage
2.2.2对果实POD活性的影响
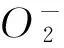
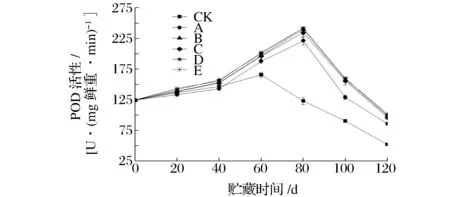
图5 不同处理对果实POD活性的影响Fig.5 Effects of different treatments on POD activity of kiwifruit during storage
2.2.3对果实CAT活性的影响
CAT是植物体内以H2O2为底物的酶,通过分解H2O2,降低因该自由基的积累对细胞膜造成的损伤,以此发挥其抗氧化作用。由图6可知,CAT的活性变化趋势与SOD完全一致,这与冯武[27]研究结论一致。图6还可以看出,所有组果实在贮藏过程中,CAT活性整体呈先升后降的趋势;CK组CAT活性在贮藏至第40天便达到峰值,而其他处理组活性峰值均被延迟20d才出现,且峰值高低顺序依次为:E>D>B>C>A;E组的CAT活性峰值高达22.7U/(g鲜重·min),比A处理高22.1%(P<0.01),比C高11.1%(P<0.05);D组的CAT活性峰值为22.5U/(g鲜重·min),比A高21.0%(P<0.01),比B处理高7.67%(P<0.05)。
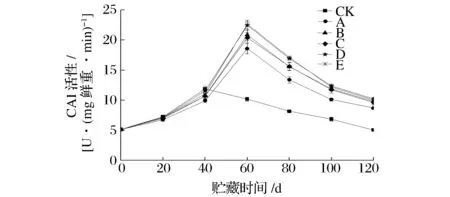
图6 不同处理对果实CAT活性的影响Fig.6 Effects of different treatments on CAT activity of kiwifruit during storage
2.3保鲜处理对总抗氧化能力的影响
2.3.1果肉总抗氧化活性的变化
在酸性条件下,Mo6+被提取液还原成Mo5+,形成的绿色磷酸钼在波长695nm处有最大吸收,吸光度越大说明被还原的Mo6+越多,待测样液总抗氧化能力越强[28]。由图7可知,猕猴桃果实在贮藏过程中,其总抗氧化能力呈先增后降的变化趋势;与单一处理相比,果实经复合处理后,能有效增强其总抗氧化能力,且复合处理与对应单一处理之间,差异性显著(P<0.05)。

图7 猕猴桃贮藏过程中总抗氧化能力的变化Fig.7 Total antioxidant activities from ‘Red Sun’ kiwifruit during storage
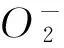

图8 保鲜处理对果实中超氧阴离子自由基清除能力的影响Fig.8 Effects of treatment with different preservations on superoxide anion radical scavenging activity during storage
2.3.3果肉·OH清除能力的变化
图9可知,猕猴桃果肉对·OH具有较强的清除能力,贮藏初期,其清除率高达60.0%;随着时间的推移,该清除率整体呈先升后降的变化趋势;果实经不同处理后,该清除率峰值出现时间较空白组被推迟20d,且两种复合处理均优于单一处理,两两间差异显著(P<0.05);贮至末期,D、E组清除能力分别高达71.2%、72.7%,均比单一处理高,且差异性显著(P<0.05)。

图9 保鲜处理对果实中羟基自由基清除能力的影响Fig.9 Effects of treatment with different preservations on hydroxyl radical scavenging activityduring storage
2.3.4果肉DPPH·清除能力的变化
由图10可知,猕猴桃果肉对DPPH·有一定的清除能力,且在贮藏期间,其清除率均先升后降;贮至60d,CK组果实中含抗氧化能力物质的DPPH·清除率稳居首位;贮至60~80d,CK组抗氧化能力急速下降,其活性均低于所有处理组;贮至80d以后,CK组果实中含抗氧化活性物质的DPPH·清除能力最弱,复合处理均较高;贮至120d,D和E组清除率仍高达71.0%,比A组高7.90%(P<0.01),比B组高2.16%(P<0.05),比C组高2.45%(P<0.05)。以上结果表明,果实经复合保鲜处理后,较单一保鲜处理均能有效提高其贮藏期间抗氧化能力,延缓DPPH·清除率峰值的出现,从而提高果实的营养及商品价值。

图10 不同处理对果实中DPPH·清除能力的影响Fig.10 Effects of different treatments on DPPH· scavenging activity during storage
2.4不同保鲜处理后对果实抗氧化代谢进行主成分分析
通过主成分分析得到前2个主成分的累计贡献率为90%,因此设定这2个主成分即能够代表整体数据的信息特征。图11是各个抗氧化指标的主成分在不同贮藏时间、不同处理下得分散点和载荷的双标图。
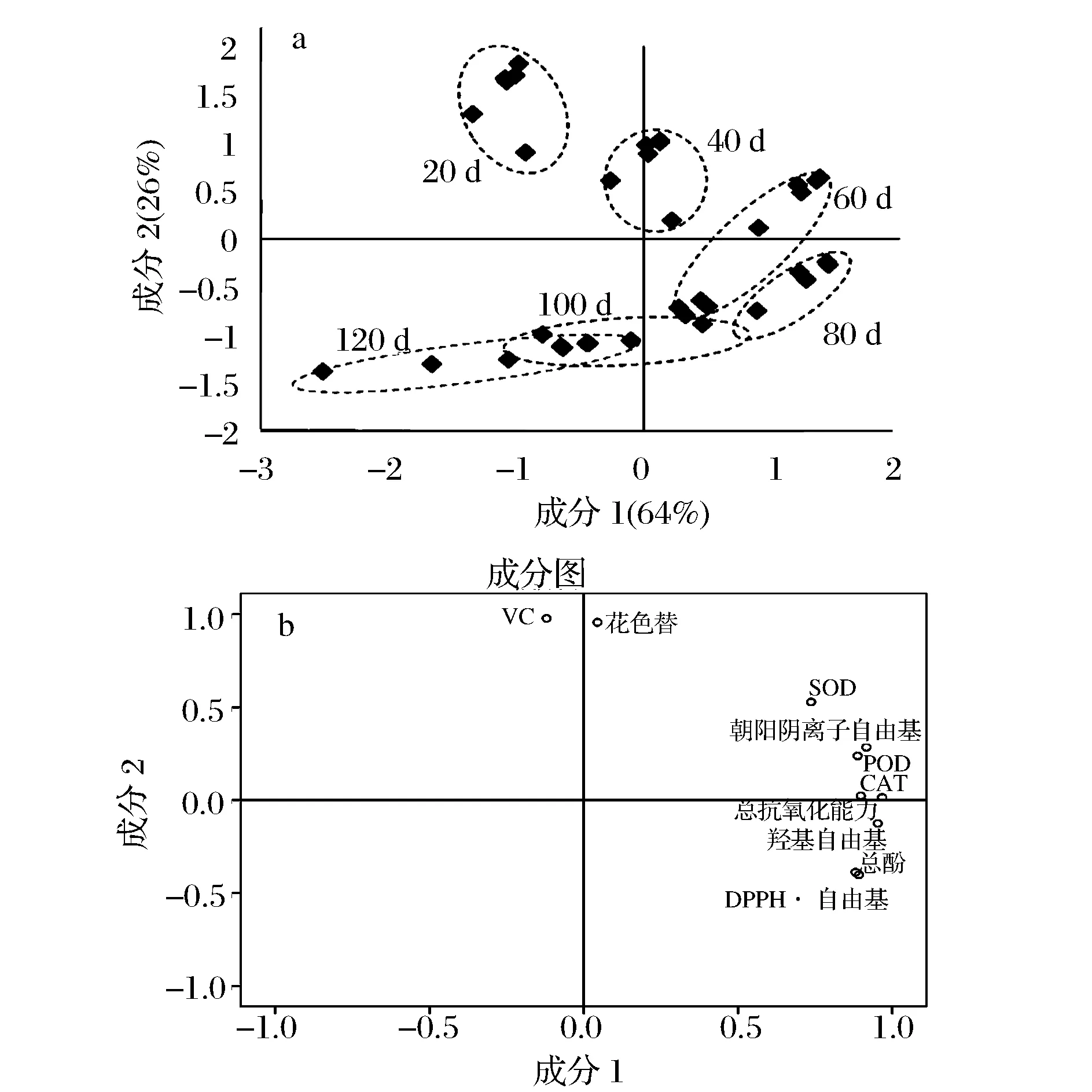
图11 红阳猕猴桃果实抗氧化代谢主成分因子得分(A)与载荷(B)的双标图Fig.11 Scores (A) and loadings (B) of antioxidant metabolism from PCA of ‘Red Sun’ kiwifruit
3 讨论与结论
3.1讨论
(1)采后果实在贮藏期间仍进行着新陈代谢活动,不断地消耗着果实内合成VC的有机物,从而影响VC含量;加之,VC自身不稳定,易分解,因此造成果实中VC含量逐渐下降。花色苷属多酚类物质,自身稳定性差,易分解,在弱酸性、低温下稳定性较好。肉桂醛为肉桂精油的主要成分,该物质在空气中,易被氧化生成酸性物质,因此红阳猕猴桃经肉桂精油处理后置于低温下贮藏,其VC及多酚类物质均被保持在较高水平[29-31]。
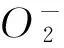
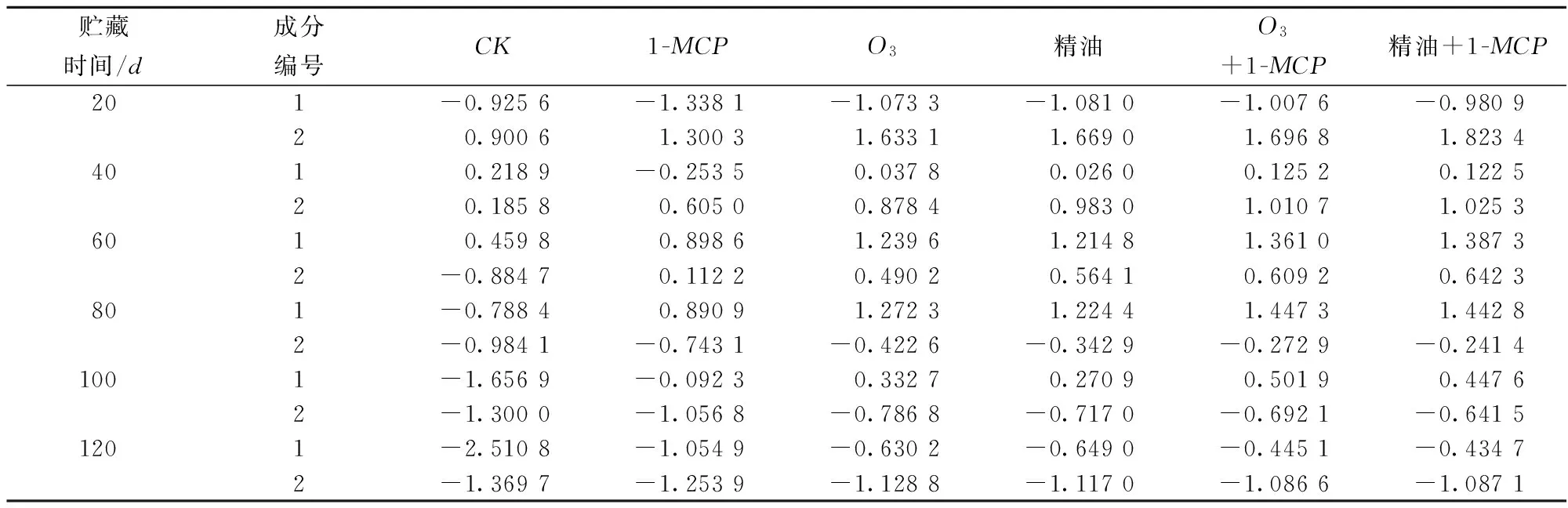
表1 红阳猕猴桃果实抗氧化代谢主成分得分表
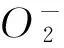
(4)1-MCP可通过提高果实活性氧清除酶(SOD、POD和CAT)活性和内源抗氧化物质(VC和花色苷、总酚)含量,从而更好地清除活性氧,减少因活性氧在体内的积累对膜造成的损伤,有效降低膜脂过氧化作用,最终延缓果实后熟衰老,延长其保鲜期。臭氧和精油处理的抗氧化作用与1-MCP有类似的反应机制,因此当它们复合使用时,具有协同效应,经试验发现,试验结果与以上分析一致。
3.2结论
臭氧、肉桂精油、1-MCP均对果实细胞抗氧化还原水平有重要的影响。果实分别经臭氧+1-MCP、精油+1-MCP处理后置于低温下贮藏,果肉的抗氧化活性明显得到保持,且优于单一保鲜,以上两种复合处理方式在应用于猕猴桃采后保鲜方面具有一定的先进性,但两者之间差异不显著,基于成本及操作性综合考虑,首选精油与1-MCP复合作为最佳处理方式。
[1]王瑞玲. 红阳猕猴桃采后病害生理及臭氧保鲜技术研究[D]. 雅安: 四川农业大学, 2010.
[2]DUGR,LIMJ,MAFW,etal.AntioxidantcapacityandtherelationshipwithpolyphenolandvitaminCinActinidiafruits[J].FoodChemistry, 2009, 113(2): 557-562.
[3]郭润姿, 白阳, 郭文岚, 等. 减压贮藏对番茄果实抗氧化物质和抗氧化酶的影响[J]. 食品工业科技, 2013(8): 338-341.
[4]ZHUZ,ZHANGZQ,QINGZ,etal.Effectsofbrassinosteroidsonpostharvestdiseaseandsenescenceofjujubefruitinstorage[J].PostharvestBiologyandTechnology, 2010, 56(1): 50-55.
[5]ABLEAJ,WONGLS,PRASADA. 1-MCPismoreeffectiveonafloralbrassica(Brassica oleracevar.italicaL.)thanaleafybrassica(Brassica rapavar.Chinensis) [J].PostharvestBiologyandTechnology, 2002,26(2): 147-155.
[6]FOYERCH,NOCTORG.Oxidantandantioxidantsignallinginplants:are-evaluationoftheconceptofoxidativestressinaphysiologicalcontext[J].Plant,CellandEnvironment, 2005,28(8): 1 056-1 071.
[7]千春录, 陶蓓佩, 陈方霞, 等. 1-MCP对猕猴桃果实品质和细胞氧化还原水平的影响 [J]. 保鲜与加工, 2012(2): 9-13.
[8]唐燕, 杜光源, 马书尚, 等. 1-MCP对室温贮藏下不同成熟度猕猴桃的生理效应 [J]. 西北植物学报, 2010, 30(3): 564-568.
[9]曹彬彬, 董明, 赵晓佳, 等. 不同浓度臭氧对皖翠猕猴桃冷藏过程中品质和生理的影响[J]. 保鲜与加工, 2012, 12(2): 5-8, 13.
[10]何靖柳, 刘继, 杜小琴, 等. 植物精油对‘红阳’猕猴桃低温贮藏保鲜效果的影响[J]. 食品工业科技, 2015, 36(9): 320-326.
[11]李荣, 路冠茹, 姜子涛. 肉桂精油抗氧化性能及清除自由基能力的研究 [J]. 食品科技, 2010(2): 166-171.
[12]SREEJITHR,VIVEKANANDANP,NehaC. In vitroevaluationofantioxidantdefensemechanismandhemocompatibilityofmauran[J].CarbohydratePolymers, 2013, 98(1): 108-115.
[13]阎瑞香, 王仁才, 李丽秀. 亚精胺处理对猕猴桃呼吸强度及PG活性的影响[J]. 食品科技, 2004(1): 83-85.
[14]郑京平. 水果、蔬菜中维生素C含量的测定-紫外分光光度快速测定方法探讨[J]. 光谱实验室, 2006, 23(4): 731-735.
[15]DEWANTOV,WUX,ADOMKK,etal.Thermalprocessingenhancesthenutritionalvalueoftomatoesbyincreasingtotalantioxidantactivity[J].JournalofAgricultureFoodChemistry, 2002, 50(10): 3 010-3 014.
[16]熊庆娥. 植物生理学实验教程[M]. 成都: 四川科学技术出版社, 2003: 146.
[17]王晶英,等. 植物生理生化实验技术与原理[M]. 哈尔滨: 东北林业大学出版社, 2003: 200.
[18]萧浪涛, 王三根. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2005: 262.
[19]PANYM,HECH,WANGHS,etal.Antioxidantactivityofmicrowave-assistedextractofBuddleiaofficinalisanditsmajoractivecomponent[J].FoodChemistry, 2010, 121(2): 497-502.
[20]DUANXW,JIANGYM,SUXG,etal.Antioxidantpropertiesofanthocyaninsextractedfromlitchi(Litchi chinenesisSonn.)fruitpericarptissuesinrelationtotheirroleinthepericarpbrowning[J].FoodChemistry, 2007, 101(4): 1 365-1 371.
[21]YANGGM,WANGD,TANGW,etal.Anti-inflammatoryandantioxidantactivitiesofoxytropisfalcatafractionsanditspossibleanti-inflammatorymechanism[J].ChineseJournalofNaturalMedicines, 2010, 8(4): 285-292.
[22]顾海峰, 李春美, 徐玉娟, 等. 柿子单宁的制备及其抗氧化活性研究[J]. 农业工程学报, 2007(5): 241-245.
[23]BRAND-WILLIAMSW,CUVELIERME,BersetC.Useofafreeradicalmethodtoevaluateantioxidantactivity[J].LWT-FoodScienceandTechnology, 1995, 28(1): 25-30.
[24]王毅, 陈蕤坤, 朱勋路, 等. 不同热激处理对菊花抗氧化相关酶活性的影响[J]. 北方园艺, 2010(9): 98-101.
[25]吴雪辉, 黄永芳, 高强, 等. 肉桂精油的抗氧化作用研究[J]. 食品科技, 2007(4): 85-88.
[26]LINDe-rong,HULi-jiang,YOUHong,etal.Initialscreeningstudiesonpotentialofhighphenolic-linkedplantclonalsystemsfornitrateremovalincoldlatitudes[J].JournalofSoilsandSediments, 2010, 10(5): 923-932.
[27]冯武. 植物精油对果蔬采后病害的防治及其防治机理的研究[D]. 杭州: 浙江大学, 2006.
[28]JIANGSH,WANGCL,CHENZQ,etal.AntioxidantpropertiesoftheextractandsubfractionsfromoldleavesofToonasinensis,Roem(Meliaceae) [J].JournalofFoodBiochemistry, 2009, 33(3): 425-441.
[29]KURITAN,MIYAJIM,KURANER,etal.Antifungalactivityandmolecularoritalenergiesofaldehydecompoundsfromoilsofhigherplants[J].JournalofAgricultureFoodChemistry, 1979, 43(11): 2 365-2 371.
[30]赵丹, 孙旸, 陈光. 肉桂精油的抑菌作用[J]. 吉林农业大学学报, 2013, 35(4): 402-405.
[31]刘颖, 赵长竹, 吴丰魁, 等. 红肉猕猴桃花色苷组成及浸提研究[J]. 果树学报, 2012(3): 493-497.
[32]金春燕, 孙锦, 郭世荣. 外源亚精胺对Ca(NO3)2胁迫下黄瓜幼苗生长和活性氧代谢的影响[J]. 西北植物学报, 2010(8): 1 627-1 633.
[33]耶兴元, 张燕. 精胺对高温胁迫下猕猴桃叶中抗氧化物质的影响[J]. 湖北农业科学, 2013(9): 2 090-2 093.
Influenceofdifferentpreservationsonantioxidationin‘RedSun’kiwifruit
HEJing-liu1, 2,DUANYu1,DUXiao-qin1,LIUJi3,LIYu1,LIJie1,ZHANGQing1,LISu-qing1,DONGYun2,QINWen1*
1(CollegeofFoodScience,SichuanAgriculturalUniversity,Ya’an625014,China) 2(YaanPolytechnicCollege,Ya’an625000,China) 3(AgricultureProductsResearchInstitute,ChengduAcademyofAgricultureandForestrySciences,Chengdu611130,China)
‘RedSun’kiwifruit;compoundpreservation;reactiveoxygenspecies;principalcomponentanalysis
10.13995/j.cnki.11-1802/ts.201601041
博士研究生(秦文教授为通讯作者,E-mail:qinwen1967@aliyun.com)。
2015-06-25,改回日期:2015-08-31
