不同温度贮藏鲜切生菜腐败细菌的分离及鉴定
2016-09-26徐晓霞陈安均桑伟娜邓雯瑾赵江欣李家欣刘兴艳
徐晓霞,陈安均,桑伟娜,邓雯瑾,赵江欣,李家欣,刘兴艳
(四川农业大学 食品学院,四川 雅安,625014)
不同温度贮藏鲜切生菜腐败细菌的分离及鉴定
徐晓霞,陈安均*,桑伟娜,邓雯瑾,赵江欣,李家欣,刘兴艳
(四川农业大学 食品学院,四川 雅安,625014)
以鲜切生菜为材料,对不同贮藏温度(0,4,10,25 ℃)货架期终点腐败细菌进行分离纯化,通过回接试验验证其腐败性。从接种并发病的鲜切生菜中分离纯化微生物,判断是否与接种菌株一致,确定鲜切生菜的腐败细菌。从不同温度贮藏条件下共筛选出菌落形态差别比较明显的菌株32株。通过16S rDNA序列进行分类研究,确定该菌的分类地位,结合形态和生理生化特性进行鉴定,确定各细菌所属种。结果表明,不同温度贮藏条件下鲜切生菜菌相较为复杂,其中革兰氏阴性菌占优势地位,主要包括假单胞菌(Pseudomonasspp.)、欧文氏菌(Erwiniaspp.)、泛菌(Pantoeaspp.)、气单胞菌(Aeromonasspp.)、水拉恩菌(Rahnellaspp.)等革兰氏阴性菌,此外还存在革兰氏阳性菌芽孢杆菌(Bacillusspp.)。不同温度贮藏条件下微生物菌相变化分析表明,荧光假单胞菌为鲜切生菜贮藏过程中的共有腐败细菌。
鲜切生菜;贮藏温度;腐败细菌;分离;鉴定
鲜切生菜是指以新鲜生菜为原料,经筛选、清洗、切割、杀菌、包装等加工过程,再经冷藏运输进入超市、冷柜销售或快餐食品企业的即食产品[1]。其不但符合消费者对新鲜、卫生、方便、环保及健康食品的需要,而且还可以满足食品快餐业、团体饮食业、军事后勤供给的特殊需要,拓宽生菜原料的应用范围,实现生菜的综合利用。近年来鲜切生菜的消费量持续增加,具有巨大的市场前景和经济效益[2-4]。
鲜切生菜在流通过程中极易发生品质变化,且微生物侵染是造成其在贮藏期腐败变质并限制产品流通和货架期最主要的原因[5]。鲜切生菜腐败变质不仅导致其在冷藏条件下的货架期很短、不便长途运输,同时造成了大量的经济损失,还存在一定的食品安全隐患,国外已有因食用鲜切制品致病的相关案例[6],因此微生物引起的腐败变质的问题已成为鲜切生菜进一步发展的瓶颈。国内外对鲜切生菜的研究主要集中在保鲜技术、生理生化及品质变化、清洗剂抑菌、清洗方式及微生物生长模型等领域[7-9],对微生物的研究主要集中在引起食源性疾病的致病菌上[10-11],对腐败菌的研究较少,同时仅对鲜切生菜初始微生物及某一特定贮藏温度的腐败微生物进行了研究[12],鲜切生菜不同温度贮藏过程腐败菌的研究较少。由于贮藏条件的不同鲜切生菜中的微生物存在一定变化,因此所采取的保质、保鲜方法具有较大的盲目性,对其货架期的控制也难以达到预期的效果。所以对不同贮藏温度下鲜切生菜腐败细菌进行研究能够为进一步有针对性的杀菌处理提供理论基础和技术借鉴,并为鲜切生菜加工过程进行有效控制提供参考。
1 材料与方法
1.1材料与设备
1.1.1材料
生菜购买于雅安市农贸市场,选择新鲜、健壮、无机械伤、清洁、成熟度基本一致且无病虫害的生菜作为供试材料,迅速运回实验室后置于4 ℃冰箱中备用。
1.1.2供试培养基及试剂
营养琼脂,乳酸菌琼脂培养基,假单胞菌选择培养基,麦康凯琼脂培养基,锰盐营养琼脂,微球菌选择培养基。用于PCR扩增的试剂和扩增引物购自天根生化科技(北京)有限公司和英潍捷基(上海)贸易有限公司。细菌基因组DNA提取试剂盒购自北京索莱宝生物科技有限公司。
1.1.3主要仪器设备
冷冻离心机(Sorvall ST 16R),美国Thermo Fisher Scientific公司;人工气候箱(GZ-380-GSI),韶关市广智科技设备有限公司;PCR仪(PTC-200),BIO-RAD公司;电泳仪(DY-A),上海康达仪器厂;凝胶成像仪,Gel Doc XRBIO-RAD公司;生物安全柜(HR20-ⅡA2),青岛海尔特种电器有限公司;生化培养箱(BPC-250 F),上海一恒科科学仪器有限公司;电热手提式压力蒸汽灭菌锅(SYQ-DSX-280B),上海申安医疗器械厂;超纯水机(Milli-Q Gradient)美国Millipore公司。
1.2试验方法
1.2.1鲜切生菜的处理方法
新鲜生菜去除表面叶片经流动自来水冲洗,于无菌超净工作台中用75%的酒精灭菌的锋利的不锈钢刀去除中心杆茎并切分成长宽各3 cm左右的块,切分好的生菜立即在250 IU/mL nisin+0.15%柠檬酸+0.05%双乙酸钠复合抑菌剂中浸泡2 min[10],用4 ℃无菌蒸馏水清洗3次,用手动果蔬甩干机去掉多余的水分,取200 g为1组,分为若干组,用0.02 mm聚乙烯保鲜袋包装。当天对第1组进行微生物菌相分析,并记为0 d,其余组分别置于乐扣箱中,以保持鲜切生菜贮藏环境中的相对湿度,分别置于0,4,10,25 ℃下贮藏,在感官拒绝时分别取样进行微生物菌相分析。
1.2.2菌株的分离与纯化
对不同贮藏温度货架期终点的鲜切生菜的细菌进行培养,采用选择性培养基对菌落总数、芽孢杆菌、肠杆菌科、假单胞菌属、乳酸菌和微球菌进行选择性培养,培养条件见表1。
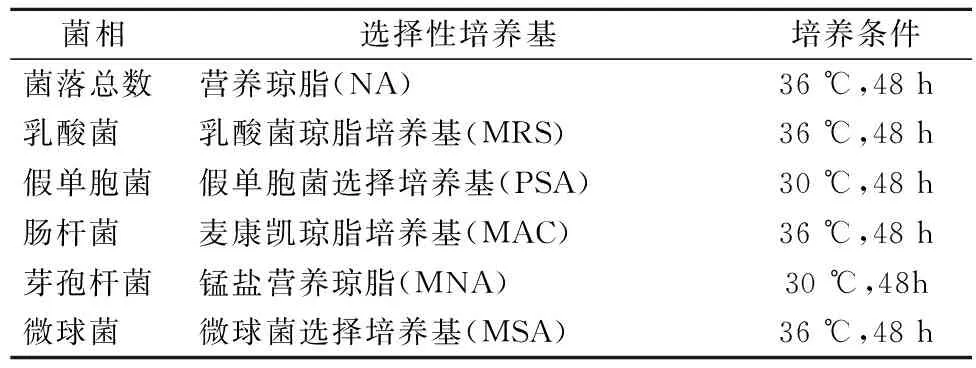
表1 不同微生物菌相培养条件
在无菌条件下准确称取样品25 g,剪碎、混匀,放入225 mL无菌生理盐水(质量浓度8.5 g/L)中,充分摇匀之后用1 mL移液枪加入含有9 mL的生理盐水试管中进行10倍递增稀释,稀释成所需浓度梯度,充分摇匀。选取合适梯度的稀释液0.1 mL涂布在不同菌相的选择性培养基上,每个稀释度做3个平行,同时分别吸取0.1 mL空白稀释液加入无菌平皿中作空白对照。
从不同贮藏温度货架期终点中的选择培养基上挑取典型生长的形态不同的菌落,平板划线法反复分离、纯化,直至菌落的生长状态和形态特征表现一致时得到纯的菌落,纯菌落斜面接种,培养后于4 ℃保存。
1.2.3菌株致病性试验
将活化后的菌株在适宜培养温度下摇床培养。吸取5 mL 8.5 g/L的生理盐水对样品离心洗脱,重复3次,最后加入5 mL生理水重悬菌液,生理盐水作空白对照。根据菌液浑浊程度2倍稀释至合适浓度,600 nm波长下比色,记录OD值,每个稀释浓度用倾注平板法进行计数,根据菌落数和OD值绘制标准曲线。 将腐败菌按上述方法制备成菌悬液后,根据OD值稀释至所需浓度,使用前用倾注平板法计数。以浓度约为105CFU/mL左右的菌悬液进行鲜切生菜的致病性试验。
分离纯化的菌株不一定为腐败菌,通过回接试验验证其腐败性。根据1.2.1切分处理好生菜后,利用微型喷雾器对鲜切生菜喷雾接种,以无菌水作对照处理,用手动果蔬甩干机去掉多余的水分,取200 g为1组,用0.02 mm聚乙烯保鲜袋包装,分别置于0,4,10和25 ℃条件下贮藏,每处理分3组,试验重复3次,特定时间取样,观察感病鲜切生菜外观发病症状、发病速度与发病程度,确定它们在不同贮藏条件下的致病性,从而初步选择出腐败菌。根据柯赫氏法则,从接种并发病的鲜切生菜中分离纯化微生物,将分离出的菌株与所接种菌株的菌落形态及菌丝形态进行比较,判断是否与接种菌株一致,确定鲜切生菜的腐败细菌。
1.2.4鲜切生菜腐败细菌的鉴定
1.2.4.1腐败细菌的形态特征和生理生化特征
对腐败细菌进行菌落形态观察,观察菌落的形状、大小、透明度、表面状态、边缘结构、隆起形状、菌落颜色等,有些情况还应注意菌落的黏度和气味。挑取已分离、纯化好的细菌单菌落进行革兰氏染色,在显微镜下对其进行形态特征观察,描述细胞的形状、颜色、有无芽孢并进行显微照相。 参考《伯杰细菌鉴定手册》[13]、《常见细菌系统鉴定手册》[14]对细菌菌株进行菌种的鉴定,各项生理生化试验每一处理均设3次重复。
1.2.4.2分子生物学鉴定
活化从不同温度贮藏条件下鲜切生菜中已经分离纯化得到的细菌纯菌株,按照细菌基因组DNA提取试剂盒的说明书进行单菌落DNA的提取。以提取的基因组DNA为模板,利用细菌16S rDNA通用引物,正向引物27f:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物为1495r:5′-ACGGCTACCTTGTTACGACTT-3′。PCR扩增在PCR仪上进行。PCR 反应体系(30 μL):上下游引物各1 μL,模板DNA1 μL, 2×PCR Master Mix 15 μL,超纯水12 μL。PCR 扩增程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃终延伸5 min。取5 μL PCR扩增产物于1.0%琼脂糖凝胶电泳检测,采用凝胶成像系统拍照。PCR产物由擎科生物有限公司进行测序。将得到的基因序列在NCBI数据库进行BLAST同源性检索和比对分析,获得与其同源性较高的相似序列,使用MEGA5.1进行序列比对,比对结果构建系统发育树。
2 结果与分析
2.1腐败细菌的形态特征和生理生化特征
鲜切生菜0,4,10和25 ℃贮藏至感官拒绝点时,利用纯培养的方法,从不同选择性培养基中共筛选出菌落形态差别比较明显的菌株79株,其中革兰氏阴性菌为优势菌。根据菌落形态和镜检结果去除重复菌株,通过回接实验,观察感病鲜切生菜外观发病症状、 发病速度与发病程度,确定它们在不同贮藏条件下的致病性,从而初步选择出不同温度条件鲜切生菜的腐败细菌。于0,4,10和25 ℃分别筛选出8,8,10,8株腐败细菌。0 ℃腐败细菌为PSA4、MNA2、MSA5、PSA5、MAC3、PSA2、MAC1、NA2,4 ℃腐败细菌为PSA2、NA2、NA9、PSA3、MNA1、NA5、MNA4,10 ℃腐败细菌为NA1+、MRS0、MSA7、NA3、NA6、NA6、MAC4、MAC5、PSA3,25 ℃腐败细菌为PSA1+、PSA2、NA9、PSA1、MAC4、NA6、MAC1、MNA1。部分微生物形态学照片见图1,菌株形态学特征见表2,生理生化特征见表3。
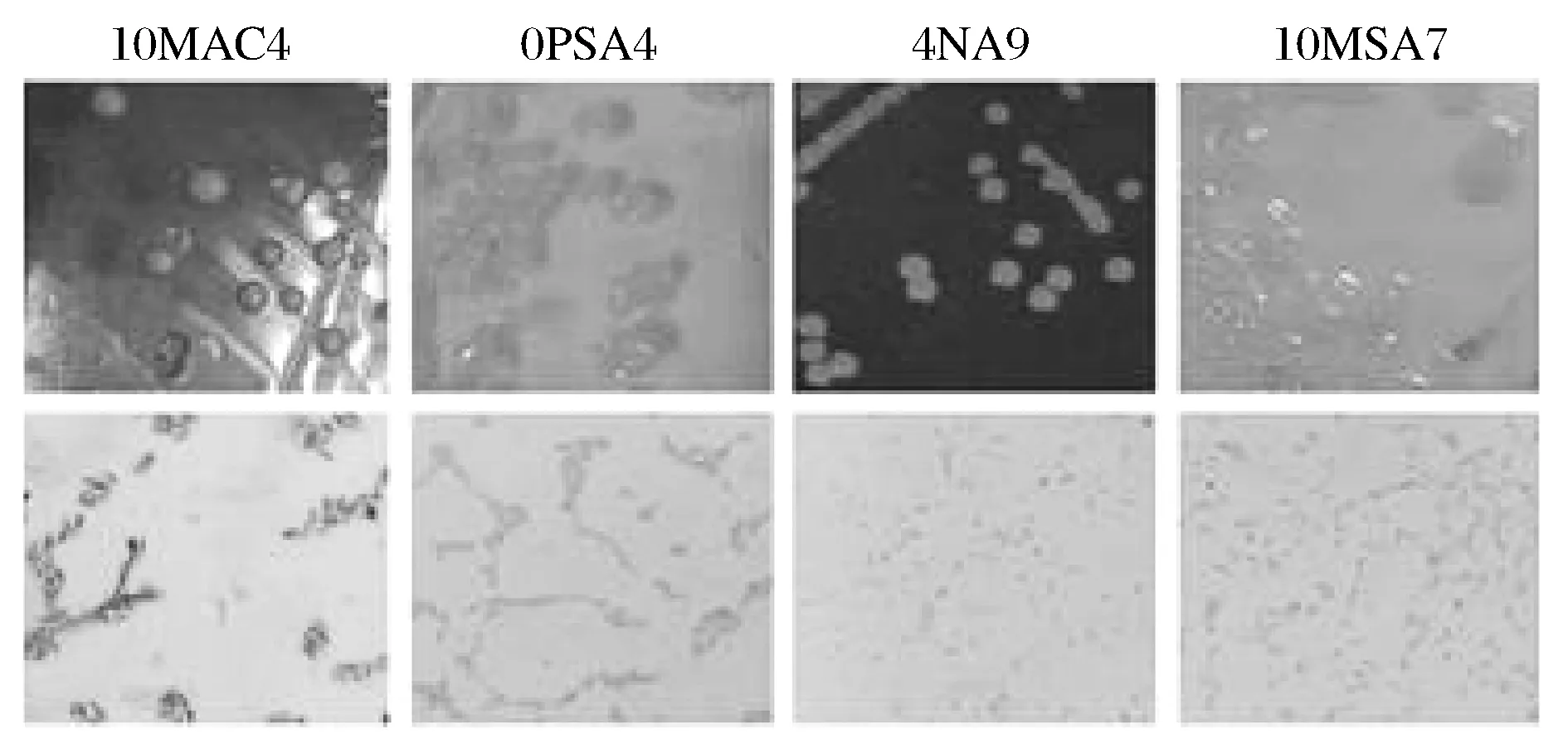
图1 部分分离微生物的形态学表征Fig.1 The separation of microbial morphology characterization
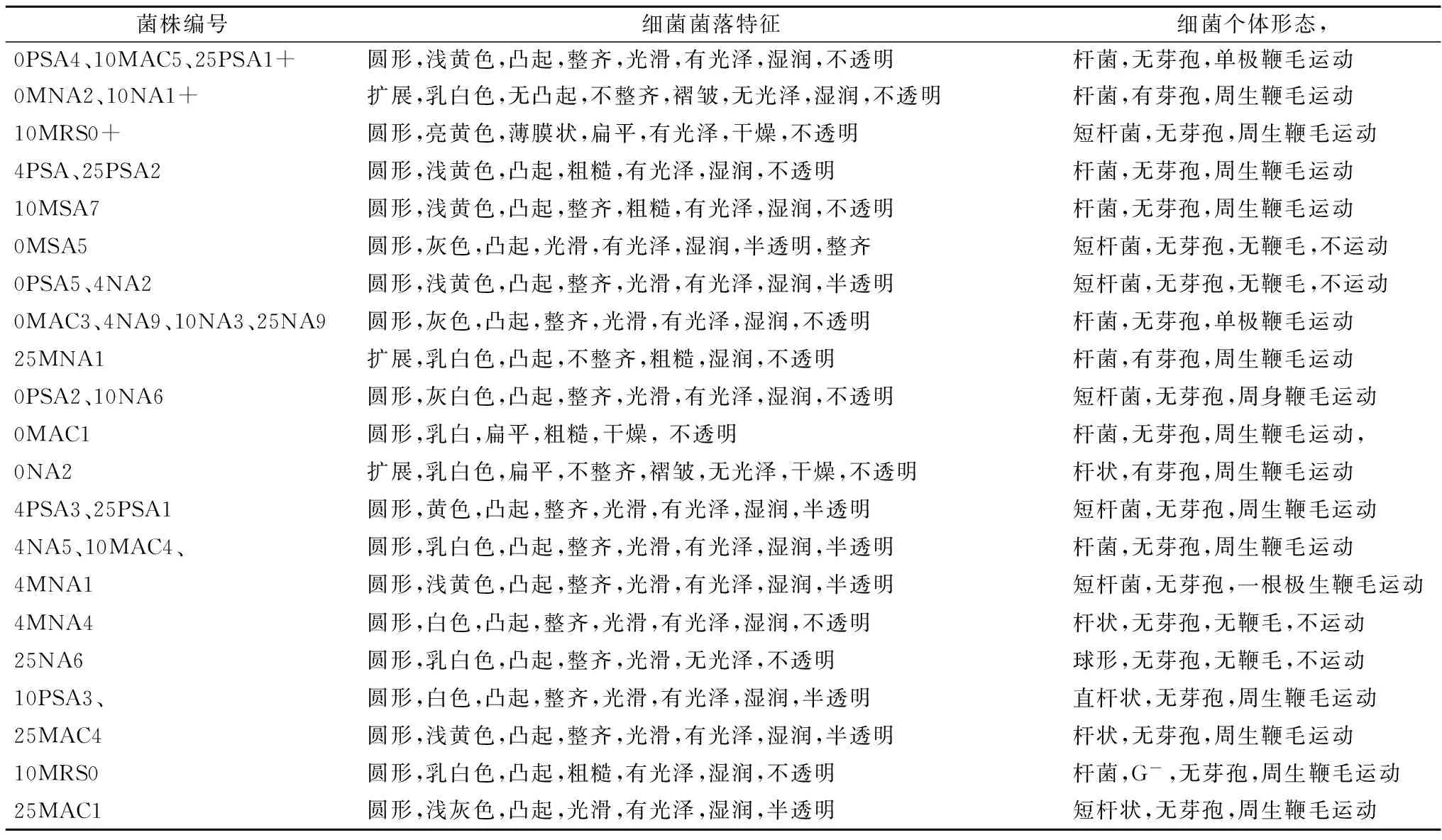
菌株编号细菌菌落特征细菌个体形态,0PSA4、10MAC5、25PSA1+圆形,浅黄色,凸起,整齐,光滑,有光泽,湿润,不透明杆菌,无芽孢,单极鞭毛运动0MNA2、10NA1+扩展,乳白色,无凸起,不整齐,褶皱,无光泽,湿润,不透明杆菌,有芽孢,周生鞭毛运动10MRS0+圆形,亮黄色,薄膜状,扁平,有光泽,干燥,不透明短杆菌,无芽孢,周生鞭毛运动4PSA、25PSA2圆形,浅黄色,凸起,粗糙,有光泽,湿润,不透明杆菌,无芽孢,周生鞭毛运动10MSA7圆形,浅黄色,凸起,整齐,粗糙,有光泽,湿润,不透明杆菌,无芽孢,周生鞭毛运动0MSA5圆形,灰色,凸起,光滑,有光泽,湿润,半透明,整齐短杆菌,无芽孢,无鞭毛,不运动0PSA5、4NA2圆形,浅黄色,凸起,整齐,光滑,有光泽,湿润,半透明短杆菌,无芽孢,无鞭毛,不运动0MAC3、4NA9、10NA3、25NA9圆形,灰色,凸起,整齐,光滑,有光泽,湿润,不透明杆菌,无芽孢,单极鞭毛运动25MNA1扩展,乳白色,凸起,不整齐,粗糙,湿润,不透明杆菌,有芽孢,周生鞭毛运动0PSA2、10NA6圆形,灰白色,凸起,整齐,光滑,有光泽,湿润,不透明短杆菌,无芽孢,周身鞭毛运动0MAC1圆形,乳白,扁平,粗糙,干燥,不透明杆菌,无芽孢,周生鞭毛运动,0NA2扩展,乳白色,扁平,不整齐,褶皱,无光泽,干燥,不透明杆状,有芽孢,周生鞭毛运动4PSA3、25PSA1圆形,黄色,凸起,整齐,光滑,有光泽,湿润,半透明短杆菌,无芽孢,周生鞭毛运动4NA5、10MAC4、圆形,乳白色,凸起,整齐,光滑,有光泽,湿润,半透明杆菌,无芽孢,周生鞭毛运动4MNA1圆形,浅黄色,凸起,整齐,光滑,有光泽,湿润,半透明短杆菌,无芽孢,一根极生鞭毛运动4MNA4圆形,白色,凸起,整齐,光滑,有光泽,湿润,不透明杆状,无芽孢,无鞭毛,不运动25NA6圆形,乳白色,凸起,整齐,光滑,无光泽,不透明球形,无芽孢,无鞭毛,不运动10PSA3、圆形,白色,凸起,整齐,光滑,有光泽,湿润,半透明直杆状,无芽孢,周生鞭毛运动25MAC4圆形,浅黄色,凸起,整齐,光滑,有光泽,湿润,半透明杆状,无芽孢,周生鞭毛运动10MRS0圆形,乳白色,凸起,粗糙,有光泽,湿润,不透明杆菌,G-,无芽孢,周生鞭毛运动25MAC1圆形,浅灰色,凸起,光滑,有光泽,湿润,半透明短杆状,无芽孢,周生鞭毛运动
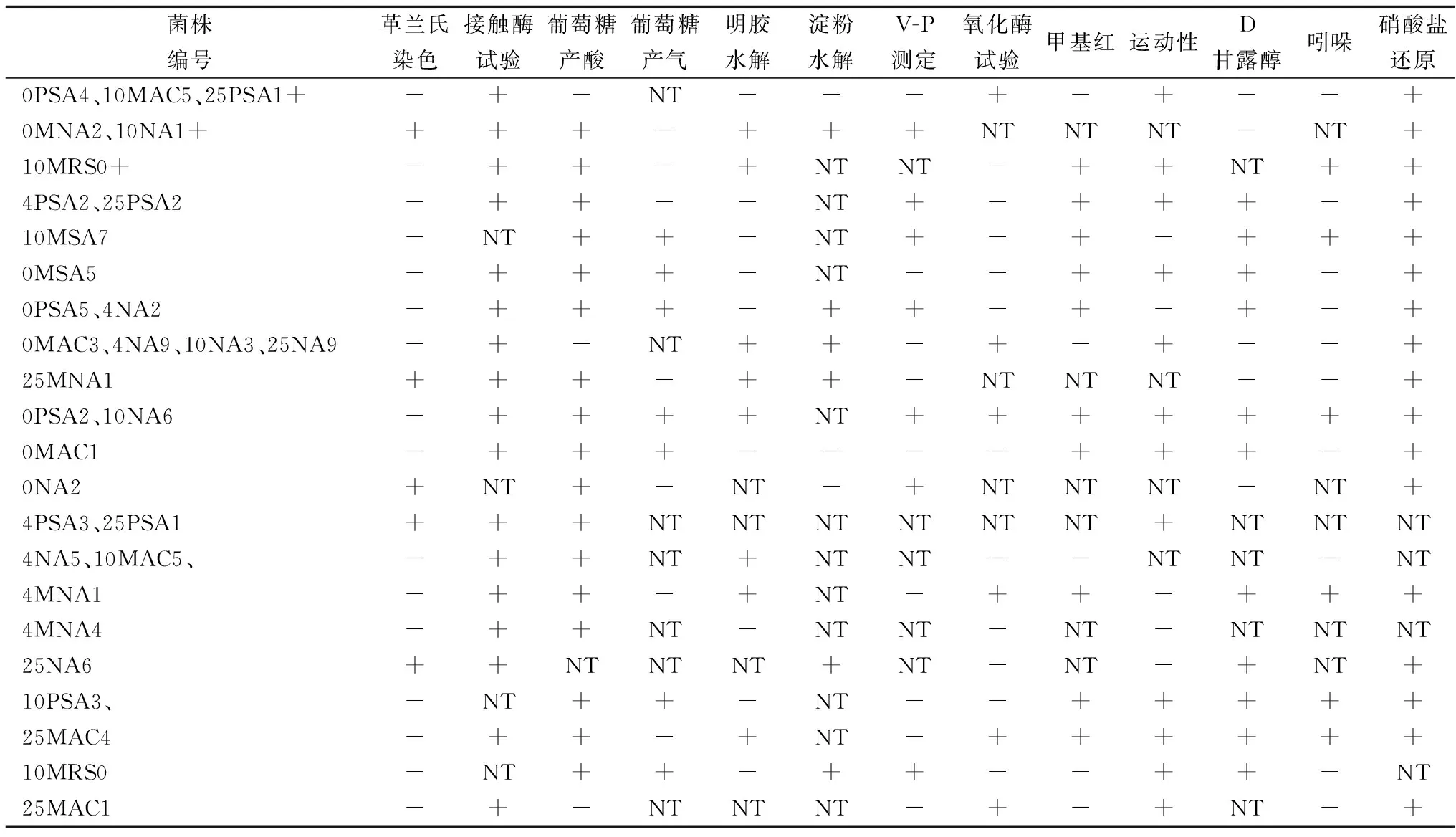
表3 腐败细菌菌株的部分生理生化实验
注:+,大多数(≥90%)菌株为阳性;-,大多数(≥90%)菌株为阴性;NT,未试验。
2.2腐败细菌的分子生物学鉴定
所提取的鲜切生菜腐败细菌的DNA,PCR扩增后经琼脂糖凝胶电泳,均得到重复性好且稳定、清晰的特异条带,片段大约1 500 bp左右。图2为鲜切生菜0 ℃下腐败细菌PCR产物电泳图。PCR产物由擎科生物有限公司进行测序。将得到的基因序列在NCBI数据库进行BLAST同源性检索和比对分析,获得与其同源性较高的相似序列,使用MEGA5.1进行序列比对,比对结果构建系统发育树,结果见图3、图4、图5和图6。
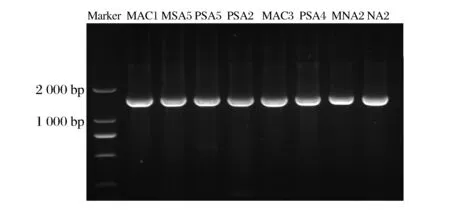
图2 鲜切生菜0 ℃下腐败细菌PCR产物电泳图Fig.2 Electrophoresis profiles of PCR produces of dominant spoilage bacteria at 0 ℃
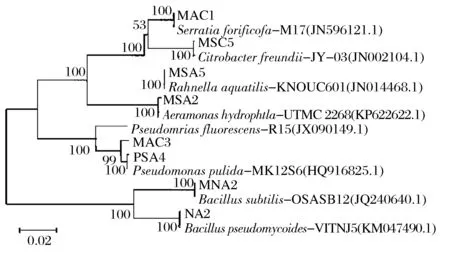
图3 基于0 ℃腐败细菌16S rDNA序列构建的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA gene sequences of spoilage bacteria at 0℃
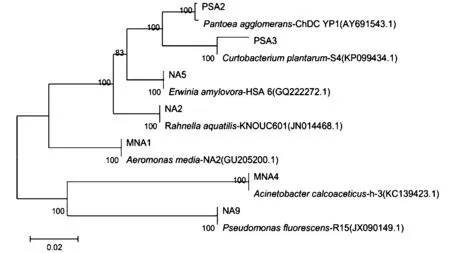
图4 基于4 ℃腐败细菌16S rDNA序列构建的系统发育树Fig.4 Phylogenetic tree based on 16S rDNA gene sequences of spoilage bacteria at 4 ℃

图5 基于10 ℃腐败细菌16S rDNA序列构建的系统发育树Fig.5 Phylogenetic tree based on 16S rDNA gene sequences of spoilage bacteria at 10℃

图6 基于25 ℃腐败细菌16S rDNA序列构建的系统发育树Fig.6 Phylogenetic tree based on 16S rDNA gene sequences of spoilage bacteria at 25 ℃
由形态学鉴定和分子生物学鉴定最终确定鲜切生菜0 ℃贮藏条件下的腐败细菌PSA4、MNA2、MSA5、PSA5、MAC3、PSA2、MAC1、NA2分别为恶臭假单胞菌(Pseudomonasputida)、枯草芽孢杆菌(Bacillussubtilis)、费氏柠檬酸杆菌(Citrobacterfreundii)、水拉恩菌(Rahnellaaquatilis)、荧光假单胞菌(Pseudomonasfulva)、嗜水气单胞菌(Aeromonashydrophila)、居泉沙雷菌(Serratiafonticola)和假蕈状芽孢杆菌(Bacilluspseudomycoides);鲜切生菜4 ℃贮藏条件下的腐败细菌PSA2、NA2、NA9、PSA3、MNA1、NA5、MNA4分别为为成团泛菌(Pantoeaagglomerans)、水拉恩菌(Rahnellaaquatilis)、荧光假单胞菌(Pseudomonasfulva)、植物短小杆菌(Curtobacteriumplantarum)、中间气单胞菌(Aeromonasmedia)、解淀粉欧文氏菌(Erwiniaamylovora)和乙酸钙不动杆菌(Acinetobactercalcoaceticus);鲜切生菜10 ℃贮藏条件下的腐败细菌NA1+、MRS0、MSA7、NA3、NA6、MRS0+、MAC4、MAC5、PSA3分别为枯草芽孢杆菌(Bacillussubtilis)、阴沟肠杆菌(Enterobactercloacea)、产酸克雷伯菌(Klebsiellaoxytoca)、荧光假单胞菌(Pseudomonasfulva)、嗜水气单胞菌(Aeromonashydrophila)、菠萝泛菌(Pantoeaananatis)、解淀粉欧文氏菌(Erwiniaamylovora)、恶臭假单胞菌(Pseudomonasputida)和赫氏埃希菌(Escherichiahermannii);鲜切生菜25 ℃贮藏条件下的腐败细菌NA1+、MRS0、MSA7、NA3、NA6、MRS0+、MAC4、MAC5、MRS7、PSA3分别为枯草芽孢杆菌(Bacillussubtilis)、阴沟肠杆菌(Enterobactercloacea)贮藏条件下的腐败细菌PSA1+、PSA2、NA9、PSA1、MAC4、NA6、MAC1、MNA1分别为恶臭假单胞菌(Pseudomonasputida)、成团泛菌(Pantoeaagglomerans)、荧光假单胞菌(Pseudomonasfulva)、植物短小杆菌(Curtobacteriumplantarum)、豚鼠气单胞菌(Aeromonascaviae)、沃氏葡萄球菌(Staphylococcuswarneri)木糖氧化无色杆菌(Achromobacterxylosoxidans)和枯草芽孢杆菌(Bacillussubtilis)。
3 结论与讨论
不同温度贮藏条件下微生物菌相变化分析表明,水拉恩菌、泛菌、气单胞菌、欧文氏菌、荧光假单胞菌等均为鲜切生菜贮藏过程中的腐败菌,但不同温度贮藏条件下的鲜切生菜共有的腐败细菌为荧光假单胞菌。RANDAZZO等[15]研究报道了鲜切生菜优势腐败细菌为荧光假单胞菌、成团泛菌和水拉恩菌,这与本实验的研究结果一致。但可能由于贮存条件及操作环境的不同,RANDAZZO等并没有发现本实验检测到的鲜切果蔬中比较常见的欧文氏菌,同时本研究未能发现其他研究者检测到的微小杆菌和微球菌[13]。鲜切生菜在25 ℃贮藏时分离到常存在于肉及肉制品中的葡萄球菌,这也许与试验操作过程中交叉感染有关。本文对不同温度贮藏条件下鲜切生菜腐败细菌的确定可以强化鲜切生菜的质量控制,帮助企业采取有效的加工工艺,为以后鲜切生菜的保鲜研究提供了一定的理论依据,同时也为鲜切生菜货架期的研究奠定了基础。
[1]张雪杰,叶志华.鲜切生菜质量安全研究进展[J].食品科学,2010,31(19):399-404.
[2]周会玲,唐爱均,罗佳.超声波清洗对鲜切豆角贮藏品质的影响[J].食品研究与开发,2010, 31(9):191-194.
[3]REKHY R,MCCONCHIE R. Promoting consumption of fruit and vegetables for better health. Have campaigns delivered on the goals[J].Appetite,2014,79:113-123.
[5]SALTVEIT M E.Effect of methylcyclopropene on phenylpropanoid metabolism the accumulation of phenolic compounds and browning of whole and fresh-cut iceberg lettuce[J].Postharvest Biology and Technology,2004,34(1):75-80.
[6]SASCHA B,RALPH K,HUA W,et al.Effect of temperature and chlorination of pre-washing water on shelf-life and physiological properties of ready-to-use iceberg lettuce[J].Innovative Food Science and Emerging Technologies,2005,6(2):171-182.
[7]ALLENDE A,MARIA V S,FRANCISCO L,et al.Role of commercial sanitizers and washing systems on epiphytic microorganisms and sensory quality of fresh-cut escarole and lettuce[J]. Postharvest Biology and Technology,2008,49(1): 155-163.
[8]罗婵.Nisin、柠檬酸及双乙酸钠在鲜切生菜清洗过程中的应用研究[D].雅安:四川农业大学, 2014.
[9]ALTUNKAYA A,GÖKMEN V.Effect of various anti-browning agents on phenolic compounds profile of fresh lettuce [J].Food Chemistry,2009,117(1):122-126.
[10]GUIOMAR D,POSADA-IZQUIERDO,FERNANDO Pérez-Rodríguez,et al.Modelling growth ofEscherichiacoliO157: H7 in fresh-cut lettuce submitted to commercial process conditions: Chlorine washing and modified atmosphere packaging[J].Food Microbiology,2013,33(2): 131-138.
[11]OZTURK I.Application of non-linear models to predict inhibition effects of various plant hydrosols onListeriamonocytogenesinoculated on fresh-cut apples[J].Foodborne Pathogens and Disease,2012,9(7):607-616.
[12]崔慧玲,陈安均,罗婵,等.鲜切生菜贮藏过程中优势腐败细菌的多样性分析[J].食品与发酵工业,2014, 40(7): 223-229.
[13]布坎南,吉本斯(中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译)伯杰细菌鉴定手册[M].北京:科学出版社,1984.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15]RANDAZZO C L,SCIFG O,TOMASELLI F,et al.Polyphasic characterization of bacterial community in fresh cut salads[J].International Journal of Food Microbiology,2009,128(3): 484-490.
Isolation and identification of spoilage bacteria of fresh-cut lettuce at different temperatures
XU Xiao-xia,CHEN An-jun*,SANG Wei-na,DENG Wen-jin,ZHAO Jiang-xin,LI Jia-xin,LIU Xing-yan
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
With fresh-cut lettuce as experimental material, the spoilage bacteria under different storage temperature (0 ℃, 4 ℃, 10 ℃, 25 ℃) were isolated and purified at the end of shelf life, and then their corruptibility were verified by tie-back experiment. The species of the spoilage bacteria were determined by comparing the homogeneities between the isolated and purified strains and the incubated ones. By comparing the differences of colony morphology, thirty-two strains were isolated. The taxonomic status of the bacteria was confirmed by 16S rDNA sequences classification study and the species of the spoilage bacteria were identified through morphological, physiological and biochemical characteristics. The results showed that the microbial flora of fresh-cut lettuce stored at different temperatures was complicated. Compared with gram-positive bacterium such asBacillusspp., gram-negative bacteria were at the dominant position, includingPseudomonasspp.,Erwiniaspp.,Pantoeaspp.,Aeromonasspp.,Rahnellaspp., etc. The microbial flora analysis at different storage temperatures showed that Pseudomonas fluorescens was the common spoilage bacteria during the storage of fresh-cut lettuce.
fresh-cut lettuce; storage temperature; dominant spoilage bacteria; isolation; identification
10.13995/j.cnki.11-1802/ts.201601010
硕士研究生(陈安均副教授为通讯作者,E-mail:591919465@qq.com)。
国家高技术研究发展计划(“863”计划):鲜切果蔬的病原菌安全控制技术(2012AA101606-03)
2015-09-08,改回日期:2015-10-13
