基于约氏不动杆菌的萘生物降解特性
2016-09-26姜岩张晓华杨颖张贤明
姜岩,张晓华,杨颖,张贤明
基于约氏不动杆菌的萘生物降解特性
姜岩,张晓华,杨颖,张贤明
(重庆工商大学废油资源化技术与装备教育部工程研究中心,重庆 400067)
萘是典型的多环芳烃,毒害大、难降解,既是重要的环境污染物,又是代表性的石油烃成分,成为各类油污染场地生物修复的难点。碍于其水溶性差而制约了相关研究。利用一株从废油中分离得到的兼具石油烃降解能力和润湿反转无机杂质能力的约氏不动杆菌开展了萘的生物降解特性研究。通过研究降解因素优化出基础的降解条件;在此基础上,在50~2000 mg·L-1范围内研究了该菌对萘的生物降解特性;并利用Monod模型和Haldane模型对比研究了该菌降解萘的动力学行为。结果表明,该菌在以2000 mg·L-1萘为唯一碳源的特定条件下,以5%的接种量可以在146 h左右实现萘的全降解;Haldane模型适合于描述菌株的生长和底物降解行为,而Monod模型只适合于描述低浓度下萘的生物降解特性。
萘;降解;石油;环境;约氏不动杆菌;动力学;底物抑制
引 言
萘是典型的多环芳烃(polycyclic aromatic hydrocarbons,PAHs),广泛分布于大气、水体、土壤、作物和食品中,也是各类油品中重要的石油烃成分,进入环境后成为难降解有毒害污染物[1-3]。美国环保署早在20世纪80年代初就已经将其列为环境中优先检测污染物[4]。
PAHs有多种迁移、转化途径,其中微生物降解是去除PAHs的最主要途径[5]。目前,已经证实有近20个属种的微生物能够降解萘,研究成果涵盖了菌种的筛选、降解特性研究、代谢途径分析等[6-8]。其中,假单胞菌属(sp.)作为最重要的代表性环境微生物能够降解包括萘等在内的多种污染物,得到最为广泛的研究[9-11]。Pathak等[12]曾发现一株sp. HOB1在特定条件下能够快速降解高达2000 mg·L-1以上的萘。不动杆菌属(sp.)也广泛存在于各类污染环境中,已经证实该菌属亦可利用部分PAHs作碳源实现生物降解[13-14];不仅如此,其中的部分菌种还具有在油水两相间润湿反转油相固体粒子的特性[15-16];近年来该菌属受到越来越多的关注。除上述常见菌属外,其他的部分菌属也得到了越来越多的认识,如链霉菌属(sp.)中的一些菌可以在12 h内降解超过80%的低浓度萘[13]。
本文即是利用从废油中分离得到的一株约氏不动杆菌[15-17],以萘为典型PAHs污染物,研究萘的生物降解条件、降解特性、动力学行为,为进一步研究PAHs的环境污染治理以及废油的生物处理奠定实验基础。
1 实验材料和方法
1.1 实验菌株
约氏不动杆菌是本实验室以废油为分离材料,经分离、纯化和16S rRNA鉴定得到,并已证实该菌具有良好的石油烃降解特性[17]。
1.2 培养基
富集培养基(LB培养基):牛肉膏5 g,蛋白胨10 g,氯化钠5 g,蒸馏水1 L,pH7.0~7.2。
无机盐培养基:硝酸铵1 g,磷酸二氢钾0.4 g,磷酸氢二钾0.8 g,氯化钙0.05 g,硫酸镁0.05 g,硫酸亚铁0.05 g,氯化钠0.8 g,蒸馏水1 L;pH7.0~7.2。以萘作唯一碳源,将萘溶解于丙酮中制备成储备液;再将萘丙酮溶液分装在30 ml预热至37℃的无机盐培养基中;最后在37℃恒温水浴中挥发丙酮;根据丙酮用量的不同,其挥发时间在0.5~8 h左右。无机盐培养基中初始萘浓度以接种前色谱检测结果为准。
1.3 实验方法
保藏在斜面的菌种接种至10 ml的LB培养基中,经过夜培养后,以1%~2%的接种量继续富集培养1代,严格控制种子液的OD6001.20±0.02;萘的生物降解以接种种子液至30 ml无机盐选择培养基中开始,萘的浓度根据具体实验目的而定;以不接种细胞的样品作空白对照,用以监测生物降解过程中萘的挥发;在160 r·min-1下摇床培养,定期检测残留于溶液中的萘浓度。
基于上述基本实验方法,在条件优化实验中,温度、接种量、pH根据实验设定水平,其他实验研究均采用优化的参数条件;在动力学研究中,以降解实验所得数据为基础,分别利用Monod和Haldane模型对比研究约氏不动杆菌降解萘的细胞生长和底物降解动力学行为。
1.4 分析方法
细胞浓度采用紫外分光光度法测定,在600 nm波长下测定发酵液的吸光度[18];细胞干重采用重量法测定,将吸光度值转化为细胞干重[19]。
底物浓度采用SHIMADZU LC-20A高效液相色谱仪测定。检测条件为:SPD-M20A紫外检测器、CTO-20A柱温箱、LC-20AD泵、色谱柱为C18反相柱(150 mm×4.6 mm,50 μm),LC-Solution色谱工作站,检测波长为254 nm,流动相为甲醇:水85:15,流速为1 ml·min-1,柱温为25℃,进样量20 μl,出峰时间3.86 min。
样品和相应空白均做3个平行样,初始萘浓度均为色谱实测结果,考虑到实验条件下萘的挥发性,因此被细胞利用的萘(mg·L-1)按照下式计算:细胞降解的萘(样品初始萘样品中残留萘)(空白初始萘空白中残留萘)。
2 实验结果与讨论
2.1 温度对约氏不动杆菌降解萘特性的影响
温度通过影响细胞内代谢酶系的活力而影响细胞对底物的降解能力。本文对比研究了温度在30、35、37、40和43℃下,以10%的接种量,1000 mg·L-1的萘生物降解72 h后细胞生长与底物降解情况(图1)。在该反应时间内,所有反应体系内的萘均不能实现全降解,该实验设计有利于对比研究反应条件的影响。可以看出,在各温度条件下,细胞生长与底物降解呈现出一致的规律。温度增加,萘的生物降解作用加强,更多的底物消耗用以合成新细胞,表现为细胞浓度增加;在35~40℃范围内,约氏不动杆菌表现出旺盛的代谢活力,在37℃时接近降解高峰,此时,萘的去除率接近77%,相应的细胞干重达到402.8 mg·L-1,表明这株约氏不动杆菌在1000 mg·L-1萘的反应体系中表现出优良的生长和降解特性。由于该菌株在前期分离、驯化等过程中均是在中温环境中进行的,而鉴于可能存在的温度波动,本文也考察了其耐热性。从图1可见,当温度超过40℃时,萘的生物降解作用明显下降,特别是在温度达到43℃时,细胞的生长和代谢受到显著抑制。这一现象与王春明等[20]在高温环境中由于萘的大量挥发造成底物限制作用不同,在本实验体系中,尚有大量底物残留,表明生物降解作用的下降是由于细胞在特定反应体系中不能耐受高温环境而造成活力下降所致。与高温环境相比,随着温度的下降,细胞活力也受到抑制,但在考察的温度范围内下降趋势较为平缓。在35~40℃保持较高的生物降解活性足以保障该菌的应用研究。

图1 约氏不动杆菌在不同温度下的细胞生长与萘降解
2.2 接种量对约氏不动杆菌降解萘特性的影响
将约氏不动杆菌经两次LB培养基活化后,采用不同的接种量转接到含萘选择培养基中。图2为约氏不动杆菌在2%、5%、8%、10%、15%的接种量条件下,分别降解1000.7 mg·L-1萘的细胞生长与底物降解情况。不同的接种量会导致在反应体系中初始细胞浓度的差异,细胞浓度越高微生物越容易存活,越有利于摆脱延滞期而进入对数生长期,实现对萘的降解;反之,微生物则需要经过较长时间进行物质和能源的储备后才能实现对底物的快速降解。因此,在72 h的生物降解周期内,细胞浓度和萘的去除率均随接种量增加而增大。此外,接种量越高,接种体细胞在进入新环境后耐受有机毒性保持相对高活力的能力越强,也是导致最终获得了相对较高的萘去除率和生物量的重要原因。
不过,细胞浓度的差异随着生物降解作用的继续而逐渐减小。从图中可以看出,当菌株历经不同的生物降解周期实现对萘的全降解后,在各反应体系中最终的细胞浓度差别不大,毕竟各反应体系中的初始碳源是完全相同的,这决定了最终生物量的多少;从细胞生长曲线上反馈出的最终细胞浓度差异也仅在20 mg·L-1左右。此外,一个现象值得关注,以2%的接种量进行1000 mg·L-1萘的生物降解时,当反应时间超过4 d后,反应体系中残留的萘在消除挥发干扰后浓度基本保持不变,萘的去除率从生物降解72 h的58%提高到最大89%左右。这一实验经多次验证,均得到非常相近的实验结果,即生物降解能够进行,但该菌株在特定体系中无法实现对萘的全降解,其原因有待深入的实验分析。综合考虑降解效果和处理成本,5%的接种量被用于后续实验研究中。
2.3 初始pH对约氏不动杆菌降解萘特性的影响
无机盐培养基的初始酸碱环境对菌株降解萘产生较大影响。图3指出,当初始pH降低到6.6以下时,细胞的活力快速下降;当达到5.5时,1000 mg·L-1萘的去除率在消除其挥发干扰后仅为38%左右。稳定的生物降解作用发生在pH为6.6至偏碱性范围内,表现为细胞生长稳定,在经过72 h的生物降解后,萘的去除率均保持在70%左右,说明该菌株至少在近中性范围内能够保持较高的活力。实验还发现,当初始pH超过7.3时出现一个严重问题,无机盐培养基的溶解度下降,即便在39℃的温度环境下进行溶解也会出现明显的沉淀现象,因此,本文主要研究了在初始pH低于7.3时萘的生物降解特性。
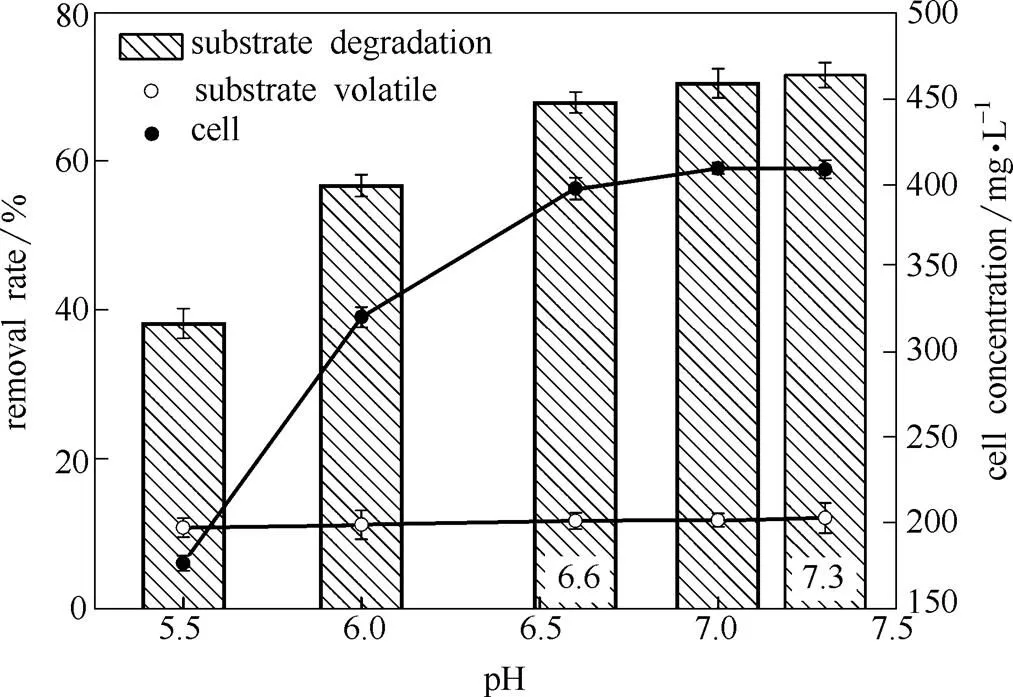
图3 约氏不动杆菌在不同初始pH下的细胞生长与萘降解
2.4 约氏不动杆菌对萘的最大耐受浓度
图4是菌株在初始萘浓度为1600、1800、2000 mg·L-1的选择培养基中萘的挥发以及细胞生长和底物降解情况。萘的挥发性除了受温度影响很大以外,也受到萘浓度的影响,特别是对于高浓度萘溶液,萘的挥发尤为明显,随着萘浓度从1600 mg·L-1增加至2000 mg·L-1,其挥发率提高了5%左右。消除萘的挥发干扰后,从细胞生长和底物降解曲线清晰可见,在极限浓度中,随着底物增加,细胞克服底物抑制作用经历了更长的生长延滞期,为底物的快速降解和新细胞的合成贮备能源和物质基础。以2000 mg·L-1的最大耐受浓度为例,在反应前70 h细胞一直处于生长延滞期,萘的快速降解发生在整个反应的后半阶段,在70 h以后,细胞逐渐进入旺盛代谢阶段,浓度迅速增加,因此实现了萘的快速降解,表现为降解曲线陡降。另外,底物浓度越高,最终的生物量越大。不过,随着底物浓度的不断增加,细胞得率减小,从1600~1800 mg·L-1细胞浓度增加了71 mg·L-1,而从1800~2000 mg·L-1细胞浓度仅增加了57 mg·L-1,其差值是由于消耗的萘用以克服高浓度反应体系中更加强烈的底物抑制作用,以维持自身的生长,最终导致细胞得率降低。2000 mg·L-1即为约氏不动杆菌在特定培养条件下的最大耐受浓度;当底物浓度继续以50 mg·L-1增加时,生物降解作用停止。
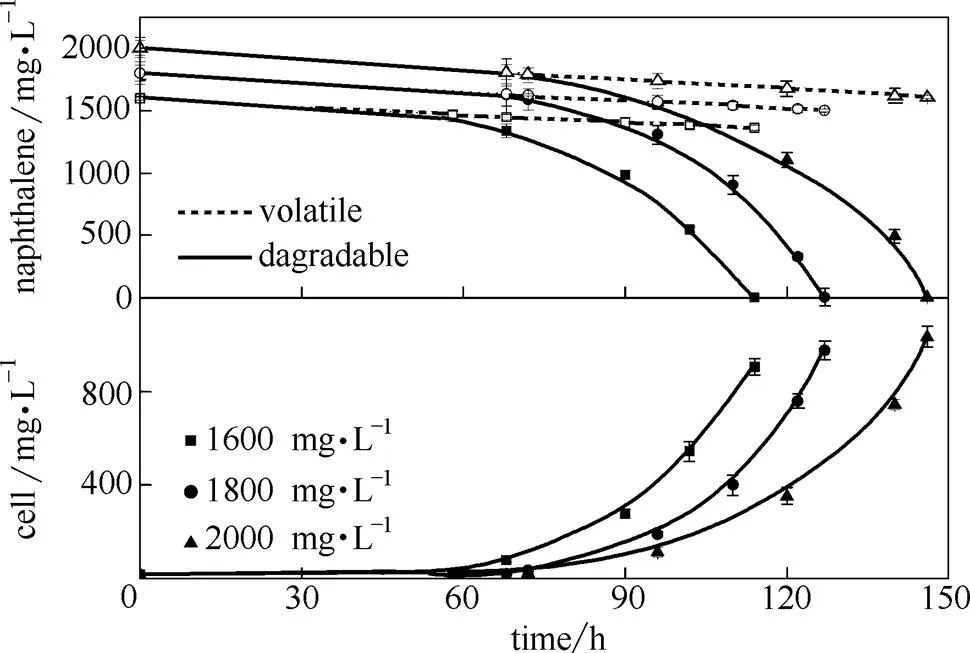
图4 约氏不动杆菌在高浓度含萘培养基中的细胞生长与萘降解
2.5 约氏不动杆菌降解萘动力学研究
在50~2000 mg·L-1范围内研究了约氏不动杆菌降解萘的细胞生长与底物降解特性。
2.5.1 约氏不动杆菌降解萘的细胞生长动力学
(1)Monod方程
采用Monod方程模拟不同初始浓度萘生物降解动力学,为求得Monod方程参数max及S,采用Lineweaver-Burk双倒数作图法求解。各初始底物浓度下的Monod方程结果如表1所示。

表1 约氏不动杆菌降解不同初始浓度萘的细胞生长动力学
Note: “—” indicates negative value.
由表1可见,当萘的浓度为50 mg·L-1时,采用双倒数作图法拟合的直线20.995,1/max与1/具有良好的线性关系,Monod方程适合描述该菌在特定环境中的细胞生长行为。但是,当萘浓度增大到100 mg·L-1后,相关系数减小到0.950,且随着初始萘浓度的增加而逐渐减小,直至底物浓度增大到400 mg·L-1时,斜率S为负值,此时,1/max与1/之间已不存在线性关系。当初始萘含量较低时,底物对菌株的抑制作用小,此时,反应体系主要表现为底物限制作用,反应体系中的萘总体表现为对微生物生长的促进作用,细胞只需经过短暂的调整期即可进入旺盛生长阶段,表现为快速增长的细胞比生长速率和底物比降解速率;反之,当初始底物浓度较高时,由于有机毒性对细胞产生抑制作用,而这种抑制在Monod模型中并未通过在Haldane模型中的底物抑制常数得以体现,因此,在底物增加到一定浓度后再以1/max对1/作图时,斜率出现负值。不过,在任一特定高浓度底物的生物降解体系中,随着底物消耗与细胞累积,底物对微生物的抑制作用逐渐减小,细胞比生长速率逐渐提高。上述研究表明,当反应体系中初始底物浓度较低、有机毒性较小时,Monod方程能够描述细胞的生长过程;反之,则不适合。不过,对于不同的生物降解体系,Monod方程有其不同的底物浓度适用范围。
(2)Haldane方程
采用Haldane方程对不同初始浓度的萘生物降解过程中细胞生长行为进行动力学模拟[18,21],将所得实验数据运用MATLAB软件使用非线性最小二乘法进行回归,得到约氏不动杆菌降解萘的细胞生长动力学方程
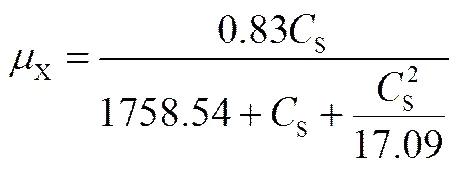
回归过程中得到的残差是1.52×10-3。图5是不同初始萘浓度下约氏不动杆菌比生长速率的实验值与理论值对照。由图可知,回归曲线与实验数据点吻合良好,表明Haldane方程适合描述约氏不动杆菌降解萘的动力学行为。其中,细胞的最大比生长速率发生在初始萘浓度为174 mg·L-1,在曲线左侧部分,反应体系中主要表现为底物限制作用,即碳源的不足限制了细胞生长;而在最高点右侧则是底物抑制作用占主导,有机毒性抑制了细胞生长;同其他相关动力学研究体系相比,萘对该菌株表现出抑制作用的浓度相对较高[22-24]。这一结果也再次证实,Monod模型不适用于高浓度底物的实验体系(表1)。

图5 不同初始萘浓度下的细胞生长动力学模型预测值与实验数据点的对照
2.5.2 约氏不动杆菌降解萘的底物降解动力学
将回归得到的细胞比生长速率与萘比降解速率进行线性拟合,得到约氏不动杆菌降解萘的动力学方程

图6是在不同初始萘浓度下,利用实验数据得到的萘比降解速率与用MATLAB回归出的比降解速率的对照。可以看出利用Haldane模型回归出的方程曲线与实验数据点吻合良好,表明Haldane方程能够用来表征约氏不动杆菌降解萘的动力学行为。当底物浓度从174 mg·L-1增加至1000 mg·L-1时,细胞从底物饱和状态进入到底物抑制环境中,有机毒性对细胞的抑制作用迅速增加,因此,底物比降解速率下降较快;而在高浓度有机环境中,细胞处于相对稳定的状态,在不同初始浓度的底物环境中,无论是细胞比生长速率还是底物比降解速率差别并不明显,综合细胞降解曲线分析(图4),此时能否实现生物降解主要取决于细胞能否克服底物抑制作用而摆脱生长延滞期。

图6 不同初始萘浓度下的萘降解动力学模型预测值与实验数据点的对照
3 结 论
(1)实验用约氏不动杆菌在35~40℃的中温环境中保持了相对稳定的降解能力,特别在37 ℃下表现出最佳的降解能力;接种量对该菌的降解特性也产生较大影响,过低的接种量会导致该菌在特定的萘浓度中不能实现对底物的全降解,综合考量处理成本选择5%的接种量。
(2)从废油中分离得到的约氏不动杆菌具有较强的降解萘能力:该菌能够以萘作准一碳源实现代谢;在低于174 mg·L-1的初始底物浓度中,反应体系主要表现为底物限制作用,相比于其他生物降解体系,这一极限值较高,体现出该菌对于萘的耐受性较强;在优化条件下,该菌株对萘的最大耐受浓度可以达到2000 mg·L-1,并能实现全降解。
(3)动力学对比研究发现,在本实验体系中,Haldane模型适合于描述在不同初始萘浓度下的细胞生长和底物降解行为;而Monad模型只适合于描述低浓度下萘的生物降解特性,当生物降解体系表现为底物抑制作用占主导时,该模型不再适用。
符 号 说 明

CS——底物浓度 KS——半饱和常数 R2——线性相关系数 μ——细胞比生长速率 μmax——最大比生长速率
References
[1] 齐义彬, 李红, 曹美娜, 等. 一株多环芳烃降解菌吉2及其降解能力 [J]. 化工学报, 2015, 66 (3): 1072-1079.
QI Y B, LI H, CAO M N,. A PAH-degrading strain JI 2 and its biodegradation potential ability [J]. CIESC Journal, 2015, 66 (3): 1072-1079.
[2] BALACHANDRAN C, DURAIPANDIYAN V, BALAKRISHNA K,. Petroleum and polycyclic aromatic hydrocarbons (PAHs) degradation and naphthalene metabolism insp. (ERI-CPDA-1) isolated from oil contaminated soil [J]. Bioresource Technology,2012, 112 (5): 83-90.
[3] FERRADJI F Z, MNIF S, BADIS A,. Naphthalene and crude oil degradation by biosurfactant producingspp. isolated from Mitidja plain soil (North of Algeria) [J]. International Biodeterioration & Biodegradation, 2014, 86 (1): 300-308.
[4] 宋立超, 刘灵芝, 李培军, 等. 盐碱土壤多环芳烃降解菌群筛选及其降解特性 [J]. 石油学报(石油加工), 2012, 28 (1): 161-166.
SONG L C, LIU L Z, LI P J,. Screening and biodegradation characteristics of polycyclic aromatic hydrocarbons-degrading consortium from saline-alkali soil [J]. Acta Petrolei Sinica (Petroleum Processing Section), 2012, 28 (1): 161-166.
[5] HARITASH A K, KAUSHIK C P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review [J]. Journal of Hazardous Materials, 2009, 169 (1/2/3): 1-15.
[6] 李晓斌, 孙寓姣, 王红旗, 等. 焦化厂污染土壤中多环芳烃降解菌群解析 [J]. 化工学报, 2010, 61 (2): 477-483.
LI X B, SUN Y J, WANG H Q,. Analysis of PAH-degrading bacteria from contaminated soil at a coking plant [J]. CIESC Journal, 2010, 61 (2): 477-483.
[7] 高配科, 王燕森, 张宏祚, 等. 两株嗜热解烃菌对原油的降黏机制 [J]. 化工学报, 2013, 64 (11): 4240-4245.
GAO P K, WANG Y S, ZHANG H Z,. Mechanism of crude oil viscosity reduction by two thermophilic hydrocarbon-degrading bacteria [J]. CIESC Journal, 2013, 64 (11): 4240-4245.
[8] 胡艳军, 管志超, 郑小艳. 污水污泥裂解油中多环芳烃的分析 [J]. 化工学报, 2013, 64 (6): 2227-2231.
HU Y J, GUAN Z C, ZHENG X Y. Analysis on polycyclic aromatic hydrocarbons in pyrolysis oil from municipal wastewater sewage sludge [J]. CIESC Journal, 2013, 64 (6): 2227-2231.
[9] 姜岩, 杨颖, 张贤明. 典型多环芳烃生物降解及转化机制的研究进展 [J]. 石油学报(石油加工), 2014, 30 (6): 1108-1121.
JIANG Y, YANG Y, ZHANG X M. Review on the biodegradation and conversion mechanisms of typical polycyclic aromatic hydrocarbons [J].Acta Petrolei Sinica (Petroleum Processing Section), 2014, 30 (6): 1108-1121.
[10] LI S S, LI X, ZHAO H B,. Physiological role of the novel salicylaldehyde dehydrogenase NahV in mineralization of naphthalene byND6 [J]. Microbiological Research, 2011, 166 (12): 643-653.
[11] IZMALKOVA T Y, SAZONOVA O I, NAGORNIH M O,. The organization of naphthalene degradation genes instrain AK5 [J]. Research in Microbiology, 2013, 164 (4): 244-253.
[12] PATHAK H, KANTHARIA D, MALPANI A,. Naphthalene degradation bysp. HOB1:studies and assessment of naphthalene degradation efficiency in simulated microcosms [J]. Journal of Hazardous Materials, 2009, 166 (2/3): 1466-1473.
[13] GAO Y, YU X Z, WU S C,. Interactions of rice (L.) and PAH-degrading bacteria (sp.) on enhanced dissipation of spiked phenanthrene and pyrene in waterlogged soil [J]. Science of the Total Environment, 2006, 372 (12): 1-11.
[14] SEO H, KIM J, JUNG J,. Complexity of cell-cell interactions betweensp. AS1 andDR1: metabolic commensalism, biofilm formation and quorum quenching [J]. Research in Microbiology, 2012, 163 (4): 173-181.
[15] JIANG Y, QI H, ZHANG X M,. Inorganic impurity removal from waste oil and wash-down water by[J]. Journal of Hazardous Materials, 2012, 239-240 (15): 289-293.
[16] JIANG Y, ZHANG X M, CHEN G X,. The pilot study for waster oil removal from oilfields byusing a specialized batch bioreactor [J]. Biotechnology and Bioprocess Engineering, 2012, 17 (6): 1300-1305.
[17] JIANG Y, QI H, ZHANG X M,. Cleansing of waste oil in oilfield by pure-culture microorganisms [J]. Energy Sources, Part A: Recovery, Utilization, and Environmental Effects, 2015, 37 (23): 2567-2574.
[18] JIANG Y, WEN J P, LI H M. The biodegradation of phenol at high initial concentration by the yeast[J]. Biochemical Engineering Journal, 2005, 24 (3): 243-247.
[19] JIANG Y, REN N Q, CAI X,. Biodegradation of phenol and 4-chlorophenol by the mutant strain CTM 2 [J]. Chinese Journal of Chemical Engineering, 2008, 16 (5): 796-800.
[20] 王春明, 李大平, 王春莲. 微杆菌3-28对萘、菲、蒽、芘的降解 [J]. 应用与环境生物学报, 2009, 15 (3): 361-366.
WANG C M, LI D P, WANG C L. Biodegradation of naphthalene, phenanthrene, anthracene and pyrene bysp. 3-28 [J]. Chinese Journal of Applied & Environmental Biology, 2009, 15 (3): 361-366.
[21] JIANG Y, WEN J P, BAI J,. Biodegradation of phenol at high initial concentration by[J]. Journal of Hazardous Materials, 2007, 147 (1/2): 672-676.
[22] JIANG Y, WEN J P, BAI J,. Phenol biodegradation by the yeastin the presence of-cresol [J]. Biochemical Engineering Journal, 2006, 29 (3): 227-234.
[23] JIANG Y, WEN J P, CAIYIN Q G L,. Mutant AFM 2 offor phenol biodegradation using He-Ne laser irradiation [J]. Chemosphere, 2006, 65 (7): 1236-1241.
[24] JIANG Y, CAI X, WU D,. Biodegradation of phenol and-cresol by mutated[J]. Journal of Environmental Sciences, 2010, 22 (4): 621-626.
Naphthalene biodegradation by
JIANG Yan, ZHANG Xiaohua, YANG Ying, ZHANG Xianming
(Engineering Research Center for Waste Oil Recovery Technology and Equipment of Ministry of Education,Chongqing Technology and Business University, Chongqing 400067, China)
Naphthalene, typical of polycyclic aromatic hydrocarbons, is highly poisonous and hardly degradable. As the typical petroleum hydrocarbon composition, it is a severe environmental pollutant, and therefore there exists great difficulty in the bioremediation of oil-contaminated sites. Due to its poor water solubility, researches on naphthalene degradation are hindered seriously. In this paper, the strain ofisolated from waste oil is employed to study naphthalene biodegradation with the ability both to degrade petroleum hydrocarbon and to wet inorganic impurities. The reaction conditions are optimized based on the researches on degradation factors and the biodegradation characteristics of naphthalene are manifested in the range of 50 to 2000 mg·L-1. The dynamics behavior of.is studied on the degradation of naphthalene through the comparison of the Monod model and the Haldane model. The results indicated that the strain could utilize naphthalene as sole carbon and energy source to metabolize and 2000 mg·L-1naphthalene could be entirely degraded within about 146 h at 5% inoculum volume and 37℃. The Haldane model is suitable to describe cell growth and the substrate degradation behaviors while the Monod model is appropriate to depict naphthalene biodegradation with low initial concentration.
naphthalene; degradation; petroleum; environment;; kinetics; substrate inhibition
supported by the National Natural Science Foundation of China (21376285), the Natural Science Foundation of Chongqing (CSTC2013jcyjA20014), Chongqing Key Project of Applied Technology Development (cstc2014yykfB90002), Chongqing Board of Education Key Project of Science and Technology (KJZH14210) and the Scientific Platform Project, Ministry of Education (FYKF201506).
date: 2016-01-03.
Dr. JIANG Yan, jiangyan@ctbu.edu.cn
X 592;X 172
A
0438—1157(2016)09—3981—07
10.11949/j.issn.0438-1157.20151992
国家自然科学基金项目(21376285);重庆市自然科学基金项目(CSTC2013jcyjA20014);重庆市应用技术开发重点项目(cstc2014yykfB90002);重庆市教委科技资助重点项目(KJZH14210);教育部平台科技资助项目(FYKF201506)。
2016-01-03收到初稿,2016-05-06收到修改稿。
联系人及第一作者:姜岩(1971—),男,博士,教授。
