重组短链脱氢酶LcSDR催化(R)-1-苯基乙醇不对称合成的工艺开发
2016-09-26王亚军柳志强郑裕国
陈 敏,王亚军,柳志强,罗 希,郑裕国
浙江工业大学生物工程学院 浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014
重组短链脱氢酶LcSDR催化(R)-1-苯基乙醇不对称合成的工艺开发
陈 敏,王亚军,柳志强,罗 希,郑裕国
浙江工业大学生物工程学院 浙江省生物有机合成技术研究重点实验室,浙江 杭州 310014
采用基因挖掘技术从Lactobacillus composti基因组中筛选到一条编码短链脱氢酶(LcSDR)的序列,该LcSDR能不对称还原苯乙酮(1a)合成(R)-1-苯基乙醇[(R)-1b]。构建了LcSDR和葡萄糖脱氢酶(EsGDH)双酶偶联催化合成体系,优化了LcSDR不对称还原1a合成(R)-1b的催化工艺参数。在较佳催化条件下,50 g/L 1a转化反应2h,产物(R)-1b得率93.8 %,产物对映体过量值(eep)高于99%,该手性生物合成催化过程的时空产率达到562.8 g/(L.d)。
短链脱氢酶 (R)-1-苯基乙醇 不对称还原 辅酶再生
手性醇在精细化学品制备、医药、农药和材料等领域有着重要的应用[1,2]。光学纯(R)-1-苯基乙醇[(R)-1b]及其衍生物是重要的手性合成砌块,广泛应用于精细化学品、天然产品和医药产品等的合成中[3,4]。(R)-1b是香料的合成原料,应用于化妆品行业,在眼药水防腐剂、染料和肠道胆固醇吸收抑制剂合成方面也有应用[5,6]。目前,苯基乙醇(1b)单一对映体的制备方法主要采用拆分和不对称合成技术[7]。生物不对称合成因其具有立体选择性高、反应条件温和、环境友好、原子利用率高和理论产率100%等优点而备受关注[8,9]。Li等[9]从Empedobacter brevis克隆得到一个短链脱氢酶EbSDR8,该酶能催化苯乙酮(1a)不对称合成光学纯(R)-1b,当1a浓度为100 mmol/L时,得率为91.2%,当1a浓度为150 mmol/L时,得率仅为76.4%。
生物不对称还原通常使用还原型辅酶NAD(P)H作为氢载体[10],由于还原型辅酶价格昂贵,会增加生产成本,因此,辅酶再生对于生物还原技术开发也非常重要。本研究采用基因探矿的方法挖掘到一条短链脱氢酶序列 lcsdr(GenBank:NZ_AZGA01000087),结合葡萄糖脱氢酶(EsGDH)催化辅酶NADP+再生技术的引入,构建短链脱氢酶(LcSDR)与EsGDH双酶偶联催化1a不对称生物还原体系(图1),详细研究LcSDR催化1a生成(R)-1b的生物催化工艺。

图1 双酶耦联不对称还原1a制备(R)-1bFig.1 LcSDR-catalyzed 1a asymmetric reduction to (R)-1b coupled with EsGDH
1 材料与方法
1.1实验材料
1.1.1菌株
菌株E coli BL21(DE3)/pET28b-lcsdr和EsGDH产生菌E coli BL21/pET28a-esgdh,由浙江工业大学生物工程研究所构建、保藏。
1.1.2主要药品及试剂
胰蛋白胨和酵母粉购自英国Oxoid公司;NADPH-Na4(大于95.0%),NADP-Na(大于95.0%),1a,(R)-1b和(S)-1-苯基乙醇[(S)-1b]购自百灵威科技有限公司(中国,北京);辅酶NAD(P)H购自Roche公司;卡那霉素来源于Solarbio公司;其他培养基原料为市售生化试剂,其他化学试剂均为市售分析纯试剂。
1.1.3培养基
肉汤培养基(LB)培养基组成(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0。固体LB培养基组成(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0,琼脂粉20.0,pH值自然。
发酵培养基成分(g/L):蛋白胨10.0,酵母粉5.0,NaCl 10.0,(NH4)2SO45.0,K2HPO4.5H2O 2.28,KH2PO41.36,MgSO40.18,甘油2.0 mL/L。
1.2实验方法
1.2.1菌体培养
取一接种环E coli BL21(DE3)/pET28b-lcsdr斜面种子接种至50 mL(250 mL锥形瓶)卡那霉素终浓度为50 μg/mL的LB培养基中,37℃,160 r/min,摇床培养7h。种子液按照2.0%(体积分数)接种量接种装有100 mL发酵培养基的摇瓶,摇瓶37℃,发酵培养时间3h(发酵液光密度值OD600为1.0),降温至28℃后添加诱导剂乳糖(终浓度9.0 g/L),继续诱导培养10h。发酵液4℃,8 000 r/min下离心10min,收集菌体。菌泥采用0.85%(体积分数)生理盐水洗涤两次,收集菌体于-20℃保存、备用。
采用类似的流程,制备E coli BL21/pET28a-esgdh菌体[11]。
1.2.2粗酶液制备
LcSDR和EsGDH均为胞内酶。E coli BL21(DE3)/pET28b-lcsdr和E coli BL21/pET28a-esgdh解冻后采用超声波破碎仪(上海生析超声仪器有限公司)破碎细胞。称取 1 g湿菌体,用 4℃预冷过的pH 值为6.5的 KH2PO4-K2HPO4缓冲液(200 mmol/L)重悬菌体,在冰浴条件下破碎。采用超声破碎法破碎E coli BL21(DE3)/pET28b-lcsdr细胞,超声功率40 W,工作时间1 s,间隙时间1 s,超声破碎12min;采用类似的操作条件破碎E coli BL21/pET28a-esgdh细胞,破碎时间20min。细胞破碎液在4℃,12 000 r/min条件下离心5min,上清液即为粗酶液。
1.2.31a生物不对称还原
反应体系采用pH值为6.5的KH2PO4-K2HPO4缓冲液(200 mmol/L)20 mL,1a浓度为50 g/L,葡萄糖质量浓度82.5 g/L,6.0 g/L E coli BL21(DE3)/pET28b-lcsdr和6.0 g/L E coli BL21/pET28a-esgdh细胞制备的粗酶液,水浴加热维持反应温度在30℃,转速200 r/min,反应过程中采用pH stat法和1.0 mol/L Na2CO3维持转化液pH值在6.5±0.5,每隔30min定时取样1 mL,转化液用等体积的乙酸乙酯萃取,离心后吸取有机层,再用乙酸乙酯稀释适当的倍数,测定1a,(R)-1b和(S)-1b的浓度,计算得率(y)和产物对映体过量值(eep)等指标。
1.2.4分析方法
采用岛津GC-14C气相色谱检测1a,(R)-1b和(S)-1b的浓度。色谱柱Agilent J&W Cyclodex-B(∅30m×0.250mm×0.25 μm);载气氦气;柱温,60℃保温5min后按3℃/min升温至175℃;进样器温度250℃;分流体积比1:50;检测器采用氢火焰离子化检测器(FID),检测器温度250℃。乙酸乙酯作为溶剂配制10 g/L 1a,(R)-1b和(S)-1b的储备液,稀释后得到浓度分别为0.5,1.0,2.5,5.0 和7.0 g/L的稀释液,按照如下气相色谱条件外标法定量。
产物得率根据方程(1)计算:

式中:C0为底物1a的起始浓度,g/L;Cp为反应终止时产物1b的浓度,g/L。
时空产率(pi)为单位体积单位时间产生产物的质量,g/(L.d),采用公式(2)计算[12]:

式中:Ci p为反应终止时产物i的浓度,g/L;t为反应时间,d。
产物对映体过量值采用公式(3)计算:

式中:C(R)-1b和C(S)-1b分别为(R)-1b和(S)-1b的浓度,mol/L。
2 结果与讨论
2.1助溶剂浓度的影响
固定E coli BL21(DE3)/pET28b-lcsdr和E coli BL21/pET28a-esgdh浓度5.0 g/L,底物1a浓度50 g/L,葡萄糖浓度 70 g/L,考察添加助溶剂二甲基亚砜(DMSO)对1a不对称还原效率的影响,结果示于图2。由图可知,当DMSO的体积浓度为5%时,添加DMSO显著促进1a不对称还原。当DMSO浓度增大至20%时,在初始15min内(R)-1b的合成与其它实验组之间的差异较小,但随着反应时间的延长,(R)-1b的合成速率显著下降,这可能与高浓度DMSO引起的酶失活有关[13,14]。因此,在底物浓度为50 g/L的条件下,最适宜DMSO浓度为5%。
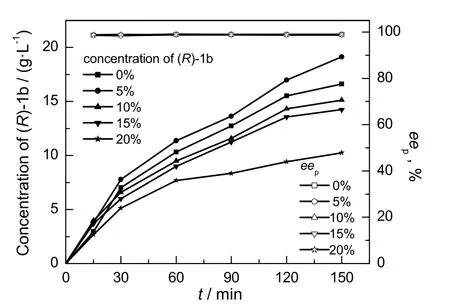
图2 不同DMSO浓度时1a不对称还原效率Fig.2 1a asymmetric reduction efficiency under different DMSO concentrations
2.2LcSDR菌体用量的影响
在反应体系中加入50 g/L 1a,70 g/L葡萄糖,5% DMSO,E coli BL21(DE3)/pET28b-lcsdr与E coli BL21/pET28a-esgdh菌体质量比为1:1条件下,考察E coli BL21(DE3)/pET28b-lcsdr菌体用量对1a不对称生物还原效率的影响,结果如图3所示。由图可知,E coli BL21(DE3)/pET28b-lcsdr菌体用量为3.5~6.0 g/L时,随着菌体用量的增加,反应速率和转化效率都相应地增大。进一步增大菌体用量,对(R)-1b得率和eep没有显著的影响。因此,E coli BL21(DE3)/pET28b-lcsdr的菌体用量选择6.0 g/L。

图3 不同LcSDR菌体用量时1a不对称还原效率Fig.3 1a asymmetric reduction efficiency under different LcSDR loading sizes
2.3EsGDH菌体用量的影响
在葡萄糖-GDH辅酶再生体系中,反应过程中辅酶的再生效率影响1a还原。在1a为50 g/L,葡萄糖70 g/L,DMSO 5%,E coli BL21(DE3)/pET28b-lcsdr 6.0 g/L条件下,E coli BL21/pET28a-esgdh菌体用量对1a不对称还原效率的影响如图4所示。由图可知,当E coli BL21/pET28a-esgdh的用量从2.0 g/L增大到6.0 g/L时,反应速率逐渐增加;进一步增大E coli BL21/pET28a-esgdh用量对反应效率没有显著的影响,转化3h后,累积(R)-1b均在47.0 g/L左右。因此,E coli BL21/pET28a-esgdh菌体用量选择6.0 g/L。

图4 不同EsGDH菌体用量时1a不对称还原效率Fig.4 1a asymmetric reduction efficiency under different EsGDH loading sizes
2.4共底物葡萄糖浓度的影响
在E coli BL21(DE3)/pET28b-lcsdr为6.0 g/ L,E coli BL21/pET28a-esgdh为6.0 g/L,1a为50 g/L,DMSO为5%的条件下,考察共底物葡萄糖浓度对反应效率的影响,结果如图5所示。由图可知,当1a与葡萄糖物质的量比为1.00∶0.59时,反应速率较慢,反应3h后(R)-1b的积累浓度为46.17 g/L;当1a与葡萄糖的物质的量比为1∶1 和1.0∶1.5时,反应2.5h后(R)-1b的积累浓度分别为47.2 g/L和47.85 g/L;进一步提高葡萄糖的浓度,反应速率明显降低,反应达到平衡时(R)-1b的积累浓度仅有44.85g/L,表明继续过量的葡萄糖的浓度对1a生物还原效率没有促进作用。因此,优选的葡萄糖浓度为82.5 g/L。
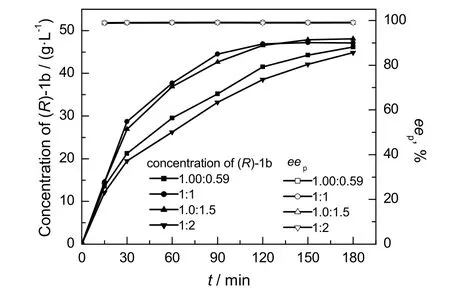
图5 不同共底物葡萄糖浓度时1a不对称还原效率Fig.5 1a asymmetric efficiency under different cosubstrate glucose concentrations
2.5外源性辅酶添加量的影响
LcSDR是NADPH依赖型还原酶,外源辅酶添加量对1a生物还原的影响如图6所示。由图可知,与不添加外源性辅酶的对照组相比,添加辅酶的实验组无论产物累积浓度还是eep均无明显的促进作用,这表明菌体自身含有的内源性NADP+足够满足1a还原的要求。

图6 不同外源性辅酶添加量时1a不对称还原效率Fig.6 1a asymmetric efficiency under different exogenous NADP+dosages
2.6不同底物浓度的反应进程
经过优化,5% DMSO,E coli BL21(DE3)/pET28b-lcsdr和E coli BL21/pET28a-esgdh投料质量比1:1(菌体干重,DCW),按照1a浓度、菌体总浓度和葡萄糖浓度为50∶12∶82.5(质量浓度比)投料,不同起始底物浓度条件下的1a生物还原反应进程示于图7。在50 g/L的底物浓度条件下,转化2h后,体系中产物累计浓度基本保持不变,得率为93.8%以上,eep不低于99%,时空产率为562.8 g/(L.d)。当1a浓度增大至100 g/L时,反应3.5h达到平衡,最终产物得率为78.3%,eep不低于99%,时空产率为536.8 g/(L.d)。底物浓度进一步增大至150 g/L和200 g/L,1a转化程度显著下降,如图7(c)和图7(d),这可能与高浓度底物和产物带来的抑制作用有关。
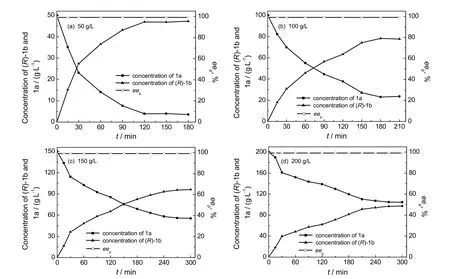
图7 不同浓度1a条件下的转化进程曲线Fig.7 Profiles of 1a conversion at various initial substrate concentrations
表1所列是利用不同生物催化剂制备(R)-1b的比较。本研究发掘到的短链脱氢酶LcSDR在(R)-1b不对称生物催化合成中具有显著的优势,在相关生物法制备(R)-1b的报道中,具有较大的时空产率。
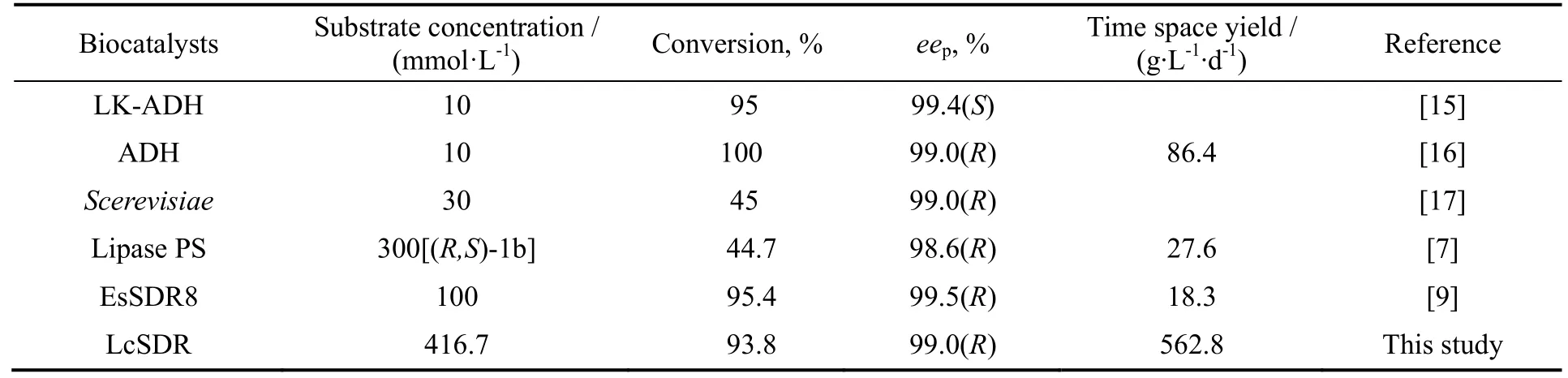
表1 不同生物催化剂制备(R)-1b比较Table 1 Comparison of LcSDR-catalyzed (R)-1b synthesis with other reports available
3 结 论
构建了 LcSDR和 EsGDH双酶耦联体系用于不对称还原苯乙酮生成(R)-苯乙醇。较优条件下,50 g/L 1a在2h内可被转化成(R)-1b,得率为93.8%,产物eep不低于99%,时空产率为562.8 g/(L.d)。本研究发掘的LcSDR是一个对映选择性强和酶活力高的生物催化剂,建立的手性生物催化技术具有反应速率快,产物光学纯度高等优势,而且该生物催化工艺不需要额外添加外源性辅酶,进一步降低了生产成本,重组短链脱氢酶LcSDR催化合成(R)-1b技术具有广阔的应用前景。
[1]Rodrigues J R, Moran P J, Conceição G J, et al. Recent advances in the biocatalytic asymmetric reduction of acetophenones andα,β-unsaturated carbonyl compounds[J]. Food Technol Biotechnol, 2004, 42(4):295-303.
[2]Inoue K, Makino Y, Itoh N. Production of (R)-chiral alcohols by a hydrogen-transfer bioreduction with NADH-dependent Leifsonia alcohol dehydrogenase (LSADH)[J]. Tetrahedron:Asymmetry, 2005, 16(15):2539-2549.
[3]Fessner W D, Anthonsen T. Modern biocatalysis:stereoselective and environmentally friendly reactions[M]. Weinheim:Wiley-VCH, 2009:124-127.
[4]Shan H, Lu Y, Li Z, et al. Resolution of (R,S)-1-phenylethanol catalyzed by lipase in novel 1,3-dibutylimidazolium ionic liquid[J]. Acta Chim Sinica, 2010, 68(10):1010-1016.
[5]Chua L S, Sarmidi M R. Immobilised lipase-catalysed resolution of (R,S)-1-phenylethanol in recirculated packed bed reactor[J]. J Mol Catal B:Enzym, 2004, 28(2):111-119.
[6]Shah S, Gupta M N. Kinetic resolution of (±)-1-phenylethanol in [Bmim][PF6]using high activity preparations of lipases[J]. Bioorg Med Chemistry Lett, 2007, 17(4):921-924.
[7]秦丽娜, 喻晓蔚, 徐 岩. 非水相中微生物脂肪酶催化转酯化拆分(R,S)-α-苯乙醇[J]. 催化学报, 2011, 32(10):1639-1644. Qin Lina, Yu Xiaowei, Xu Yan. Asymmetric transesterification resolution of (R,S)-α-phenylethanol in a non-aqueous medium by microbial lipase[J]. Chinese Journal of Catalysis, 2011, 32(10):1639-1644.
[8]Heinsman N, Franssen M, Van Der Padt A, et al. Lipase-mediated resolution of branched chain fatty acids[J]. Biocatal Biotransform,2002, 20(5):297-309.
[9]Li A, Ye L, Wu H, et al. Characterization of an excellent anti-Prelog short-chain dehydrogenase/reductase EbSDR8 from empedobacter brevis ZJUY-1401[J]. J Mol Catal B:Enzym, 2015, 122:179-187.
[10]Huisman G W, Jack L, Anke K. Practical chiral alcohol manufacture using ketoreductases[J]. Curr Opin Chem Biol, 2010, 14(2):122-129.
[11]曹 政, 王亚军, 肖 黎, 等. 羰基还原酶不对称还原(R)-6-氰基-5-羟基-3-羰基己酸叔丁酯[J]. 生物加工过程, 2013, 11(1):17-22. Cao Zheng, Wang Yajun, Xiao Li, et al. Asymmetric reduction of t-butyl 6-cyano-(5R)-hydroxy-3-carbonyl hexanoate by carbonyl reductase[J]. Chinese Journal of Bioprocess Engineering, 2013, 11(1):17-22.
[12]Shen N D, Ni Y, Ma H M, et al. Efficient synthesis of a chiral precursor for angiotensin-converting enzyme (ACE) inhibitors in high space-time yield by a new reductase without external cofactors[J]. Org Lett, 2012, 14(8):1982-1985.
[13]Olofsson L, Nicholls I A, Wikman S. TBADH activity in water-miscible organic solvents:correlations between enzyme performance,enantioselectivity and protein structure through spectroscopic studies[J]. Org Biomol Chem, 2005, 3(5):750-755.
[14]Alsafadi D, Paradisi F. Effect of organic solvents on the activity and stability of halophilic alcohol dehydrogenase (ADH2) from Haloferax volcanii[J]. Extremophiles, 2013, 17(1):115-122.
[15]Chen Q, Hu Y, Zhao W, et al. Cloning, expression, and characterization of a novel (S)-specific alcohol dehydrogenase from Lactobacillus kefir[J]. Appl Biochem Biotechnol, 2010, 160(1):19-29.
[16]Weckbecker A, Hummel W. Cloning, expression, and characterization of an (R)-specific alcohol dehydrogenase from Lactobacillus kefir[J]. Biocatal Biotransform, 2006, 24(5):380-389.
[17]杨忠华, 曾 嵘, 吴高明, 等. 水-有机溶剂两相体系中面包酵母不对称还原苯乙酮合成手性苯乙醇的研究[J]. 高校化学工程学报,2009, 23(3):450-454. Yang Zhonghua, Zeng Rong, Wu Gaoming, et al. Asymmetric reduction of acetophenone to chiral phenylethyl alcohol cataiyzed by saccharomyces cerevisiae in aqueous-organic solvent biphasic system[J]. Journal of Chemical Engineering of Chinese Universities, 2009,23(3):450-454.
The Process Development of (R)-1-Phenylethanol Asymmetric Reduction Catalyzed by A Recombinant Short-Chain Dehydrogenase and Reductase LcSDR
Chen Min, Wang Yajun, Liu Zhiqiang, Luo Xi, Zheng Yuguo
Key Laboratory of Bioorganic Synthesis of Zhejiang Province, College of Biotechnology and Bioengineering,Zhejiang University of Technology, Hangzhou 310014, China
A short-chain dehydrogenases and reductases (LcSDR) coding sequence lcsdr was screened out from Lactobacillus composti genome via gene mining technology. It was found that LcSDR was able to asymmetrically reduce acetophenone(1a) to (R)-1-phenylethanol [(R)-1b]. The LcSDR and glucose dehydrogenase (EsGDH) double-enzyme conjugate catalytic synthesis system was constructed, and the process parameters were optimized for catalytic reduction of 1a to (R)-1b in this study. Under the appropriate conditions, 50 g/L 1a was converted to (R)-1b in 2h with yield of 93.8%, the enantiomeric excess (eep)above 99% and the space time yield of 562.8 g/(L.d).
short-chain dehydrogenase/reductase; (R)-1-phenylethanol; asymmetric bioreduction; coenzyme regeneration
O621.3+4;Q814.9
A
1001—7631 ( 2016 ) 04—0320—06
2016-04-21;
2016-05-26。
陈 敏(1990—),男,硕士研究生;郑裕国(1961—),男,教授,通讯联系人。E-mail:zhengyg@zjut.edu.cn。
国家自然科学基金(21476209)。
