猪ifitm基因克隆及其序列和组织表达分析
2016-09-26张玉娟李超燕郑文明
张玉娟,赵 婷,徐 朝,于 琨,马 倩,李超燕,郑文明,许 君
(河南农业大学生命科学学院,河南 郑州 450002)
猪ifitm基因克隆及其序列和组织表达分析
张玉娟,赵 婷,徐 朝,于 琨,马 倩,李超燕,郑文明,许 君
(河南农业大学生命科学学院,河南 郑州 450002)
为了研究ifitm基因的功能,本研究从猪肾PK15细胞中克隆了猪的3个ifitmcDNA序列,分析了猪ifitm1、ifitm2和ifitm3基因的染色体定位及其与其他物种基因序列的同源关系,并对不同ifitm在不同组织的表达进行分析和检测。结果显示,猪ifitm和人、鼠ifitm具有相同的基因和蛋白结构,进化上与牛ifitm高度同源,ifitm1和ifitm3在脾、肾、心、肝等组织中大量表达,而ifitm2只在脾和肾中检测到表达,在其他组织中的表达量相对较小。猪ifitm基因的克隆、生物信息学及组织表达分析为进一步研究其在猪细胞中的功能奠定了基础。
干扰素刺激基因;猪干扰素诱导的跨膜蛋白;基因克隆;基因序列;组织表达差异
干扰素(interferon,IFN) 是一种由单核细胞和淋巴细胞产生的细胞因子,具有抗病毒、影响细胞生长、调节免疫功能等多种生物活性。IFN抗病毒生物学功能的发挥主要依赖于干扰素信号通路激活后众多下游干扰素刺激基因(interferon stimulate gene,ISG)的表达。干扰素诱导的跨膜蛋白 (interferon induced transmembrane protein,ifitm)是ISG中最引人注目的家族之一[1-3],受干扰素刺激后可大量表达,在调控细胞增殖、抵抗病原感染等一系列细胞生物学活动中发挥着重要作用。目前,ifitm在进化上比较保守,已在许多物种中被发现[4]。人类基因组中,有5个ifitm基因,其中对ifitm1、ifitm2、ifitm3和ifitm5的功能性研究较多,对ifitm10的研究鲜见报道[5]。这些基因都位于人11号染色体上,以ifitm5、ifitm2、ifitm1、ifitm3、ifitm10的顺序依次排列[6-7]。其中,fitm1具有调节细胞增殖和细胞分化的功能,它在淋巴细胞、髓样细胞、成纤维细胞核上皮细胞中均有表达。此外,研究发现ifitm1在抑制大肠癌、结肠癌、胃癌等肿瘤的形成过程中具有不同程度的表现[8-10]。ifitm2可抑制细胞的生长和诱导细胞凋亡[1]。近年研究发现,ifitm1、ifitm2、ifitm3能抗击甲型流感病毒 (IAV),线状病毒(filovirus)、黄病毒(flavivirus)、SARS冠状病毒等多种病毒的入侵[5,11-12]。且ifitm3的抗病毒活性与其S-棕榈酰化修饰有关[13]。ifitm5主要表达于骨组织,对骨基质的成熟和骨钙化起着重要作用[14]。
鼠的ifitm基因主要定位于7号染色体,有ifitm1、ifitm2、ifitm3、ifitm5、ifitm6和ifitm10。这些基因与人ifitm有很强的同源性,ifitm7是定位于16号染色体上的一个拟基因[5]。也有报道鼠基因组中存在ifitm4[15]。鼠ifitm1和ifitm3在原生殖细胞(primordial germ cells,PGCs)中有表达,在原肠胚形成时期参与PGCs的定位和移动,在生殖细胞的发育中起重要作用。 DNA微阵列分析技术确认ifitm5在鼠基因组中也是一个成骨细胞标记分子[4,6,16-17]。研究结果显示,猪中也有ifitm基因的存在,并且对口蹄疫病毒和流感病毒具有抑制作用[19-20]。本研究,我们克隆了猪的3个ifitmcDNA序列,并对基因和蛋白结构进行了分析,对3个基因的组织表达差异性进行了定量分析,对基因序列及其同源关系进行了对比分析。
1 材料与方法
1.1试剂
康为世纪超纯RNA提取试剂盒(Ultrapure RNA Kit);百泰克2×Power PCR MasterMix。
1.2样品处理
猪肾细胞PK15,来自河南农业大学细胞生物学实验室。猪心脏、肝脏、胃、脾脏、十二指肠、肾脏、肌肉、肺等8个组织样品采集自3只成年大约克夏猪(Yoykshire)。用4 ℃预冷的PBS清洗后,放入含有组织储存液的EP管,-80 ℃保存。
1.3试验方法
1.3.1 DNA和RNA的提取 PK15细胞总DNA的提取按照动物组织细胞基因组DNA提取的一般方法进行提取。PK15细胞和猪的不同组织的总RNA的提取分别按康为世纪超纯RNA提取试剂盒(Ultrapure RNA Kit)的说明书进行操作。所得的RNA用1%的琼脂糖凝胶电泳进行完整性检测。
1.3.2 cDNA合成、CDS区及全长基因克隆 以总RNA为模板,Oligo(dT)为引物,按逆转录说明书反转录合成cDNA第1链。按照GeneBank 报道的人和鼠的ifitm1、ifitm2、ifitm3基因为参考序列,设计特异性引物对,引物序列如表1。
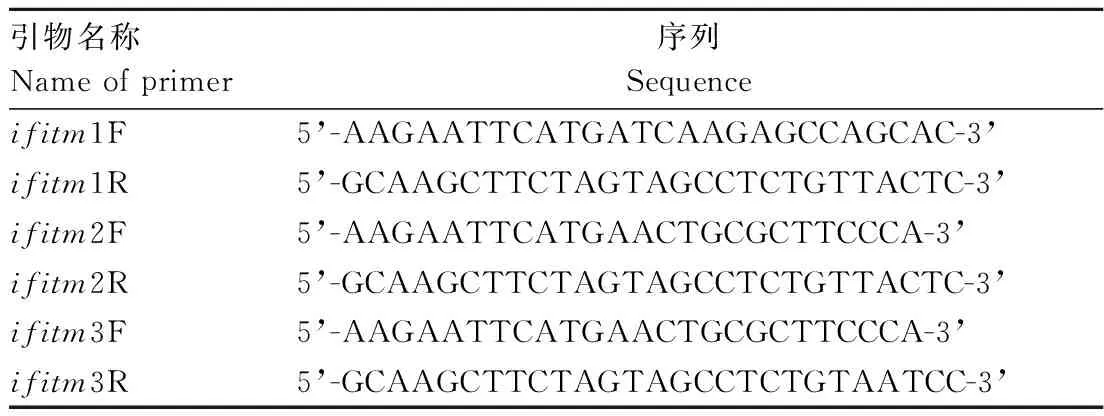
表1 克隆ifitm CDS 区的引物序列Table 1 Primer sequences for ifitm CDS cloning
PCR反应体系,Mix 10 μL,模板cDNA (或总DNA)2 μL,上、下游引物各1 μL(20 μmol·L-1),加6 μL去离子水至总体积20 μL。 同时设置空白对照。扩增条件:95 ℃预变性1 mim;95 ℃变性30 s,退火30 s(ifitm1 54 ℃,ifitm2 47 ℃,ifitm3 58 ℃),72 ℃延伸30 s,共30个循环。反应结束后,取扩增产物5 μL,2%琼脂糖凝胶进行电泳,胶回收 PCR 产物,T4 DNA ligase 链接 T-Vector,转化Ecoli.感受态细胞,Amp 抗性筛选阳性克隆,挑取白色菌落,PCR验证阳性克隆子,测序验证基因序列。将克隆的 3 个ifitm的 cDNA序列分别提交至NCBI。
1.3.3 序列对比 通过NCBI查找人类、鼠、猪、尤金袋鼠及猩猩的ifitm蛋白序列,利用DNAMAN软件进行对比。用CSS-Palm 3.0分析ifitm蛋白的棕榈酰化位点。
1.3.4 基因的染色体定位 利用NCBI的Blast功能将克隆的猪ifitm1(序列号JQ315414.1)、ifitm2(序列号JQ3154145.1)和ifitm3(序列号JQ315416.1)置于猪的基因组上进行对比,将对比结果做图显示。
1.3.5 组织表达分析 将采集的猪心、肝、胃、脾脏、十二指肠、肾、肌肉、肺等8个组织,分别提取RNA 反转录合成 cDNA,每个样品3次重复,以β-肌动蛋白(β-actin )表达量为参照标准,PCR测定3个基因在8个组织中的表达,以 Image J 软件对扩增条带进行定量分析。
2 结果与分析
2.1基因克隆
分别以PK15逆转录得到的cDNA和总DNA为模板,ifitm1F/1R、ifitm2F/2R和ifitm3F/3R 3对引物PCR扩增相对应的ifitm1、ifitm2和ifitm3的CDS区和全长基因序列,扩增产物取5 μL上样于2%琼脂糖凝胶,电泳得到与预期片段相符的产物(图1-A)。
将3个PCR产物回收,进行T载体克隆,挑取阳性克隆子进行测序验证。测序结果显示:ifitm1、ifitm2和ifitm3的CDS区片段长度分别为375、435 bp和438 bp,将3条基因序列测定结果提交至NCBI GeneBank,经审核后,获得3个 CDS序列号:ifitm1(JQ315414)、ifitm2(JQ315415)和ifitm3(JQ315416)。猪全长基因组序列比对可知ifitm1长度为 998 bp,序列已存在于全基因组,但ifitm2和ifitm3却位于未测定序列的GAP中,我们对其进行了克隆,测序结果显示ifitm2和ifitm3的全长序列大小分别为1 048、1 075 bp(图1-B)。
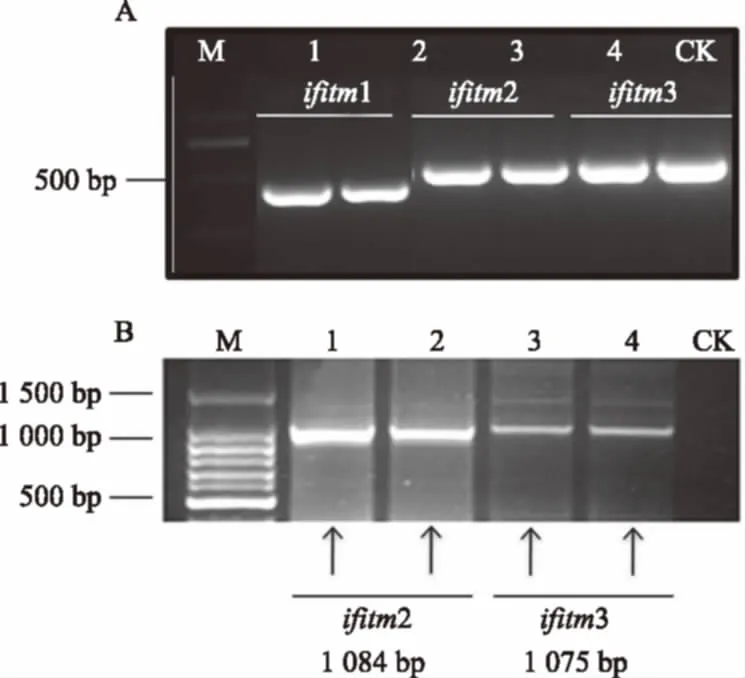
M:DNA分子量标记;bp:DNA分子量;泳道编号代表不同的克隆子;CK:对照。M:DNA marker;bp:DNA molecular weight.Lane number represent different clones.CK:Control check
2.2猪ifitm基因结构与基因定位
利用NCBI的Blast功能,将猪的ifitm1、ifitm2和ifitm3与猪的全基因组进行对比。结果显示(图2-A),猪ifitm具有与人、鼠的ifitm相似的基因结构,ifitm1具有186 bp 和189 bp 2个外显子和位于2个外显子之间的长度为623 bp的1个内含子;ifitm2具有247 bp 和188 bp 2个外显子和长度为613 bp的1个内含子;ifitm3具有194 bp 和244 bp 2个外显子和位于2个外显子之间的长度为637 bp的1个内含子。
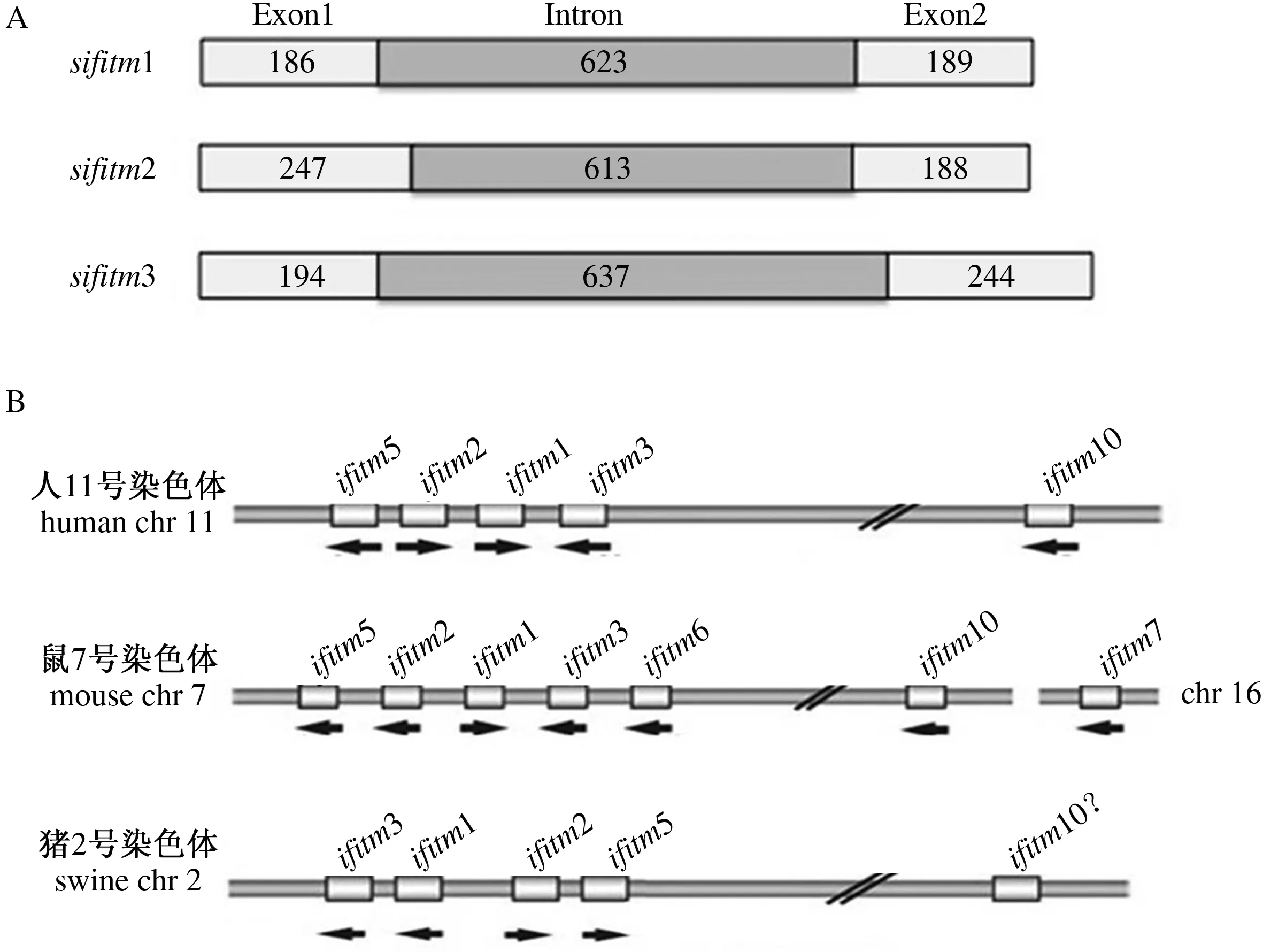
图A中sifitm代表猪ifitmsifitm means swine ifitm in Fig.A
经过比对,发现猪的ifitm1、2、3和5均位于2号染色体上,以ifitm3、1、2、5的顺序排列(图2-B)。与人基因组和鼠基因组中ifitm基因的染色体定位相似,但排列有所不同,并未在猪基因组中发现ifitm10的同源基因,只有1个类似于ifitm10拟基因,或许该基因并不存在于猪基因组中。
2.3ifitm的蛋白结构分析与翻译后修饰位点预测
由于ifitm蛋白是一种典型的跨膜蛋白,采用TMHMMT软件对猪的ifitm1、ifitm2和ifitm3蛋白进行跨膜域分析(图3)。分析结果显示,猪ifitm1、ifitm2和ifitm3都包含N段(NTD)、2个典型的跨膜区域(IMD)、位于2个跨膜区中间的胞质区(CTL)和C段(CTD),具有ifitm蛋白家族成员的典型结构。文献报道,ifitm有泛素化、甲基化、棕榈酰化等与蛋白的功能密切相关的翻译后修饰。我们采用CSS-Palm 3.0软件分析对人(Homo)、猩猩(Chimp)、鼠(Mus)和猪(Sus)的ifitm蛋白的氨基酸序列进行多序列对比,同时用CSS-Palm 3.0分析各个物种这3个ifitm基因上的棕榈酰化位点,发现猪的3个ifitm蛋白都具有保守的S-棕榈酰化位点、泛素化位点 、和甲基化位点(图3)。从图中可知,S-棕榈酰化位点非常保守,其保守性可能与ifitm序列本身在物种中的保守度高度有关,与其先天免疫中的功能相关。

NTD:N 端区域;IMD:跨膜区域;CTL:胞脂loop;CTD:C端区域;Ubiquitiylated sithe:泛素化位点; S-palmitoylation site:S-棕榈酰化位; Methylated site:甲基化位点.
2.4猪ifitm蛋白组织表达分析
以新鲜的猪组织(肉、骨、肝、脑、肠、心、脾和肾)提取的RNA经逆转录得到的cDNA为模板,分别用ifitm1F/1R、ifitm2F/2R和ifitm3F/3R3对引物PCR扩增ifitm1、ifitm2和ifitm3基因序列,同时扩增β-actin 做内参标准。扩增产物取5 μL上样于2 %琼脂糖凝胶(图4-A),用ImageJ生物学软件,以β-actin 扩增条带做内参标准,定量分析DNA电泳结果。从图4可知肌肉、骨和脑中表达量较低;ifitm3在各个组织中广泛表达;而ifitm2只在脾和肾中检测到明显条带。根据已经报道的物种,ifitm1/2/3在各组织中是遍在表达的,在猪的有些组织中却没有检测到条带的扩增,推测可能是其mRNA的表达量很低,普通PCR没有明显的可看到的条带,尤其是ifitm2仅在脾脏中检测出特异性条带,在其他组织中未检测到有表达,与其他物种ifitm2的表达特异性具有较大差异,推测猪ifitm2可能与其他物种有所不同,这有待于进一步研究。与人及鼠相似,猪的ifitm2和ifitm3在脾脏中高表达,可能与动物的免疫调节有关。
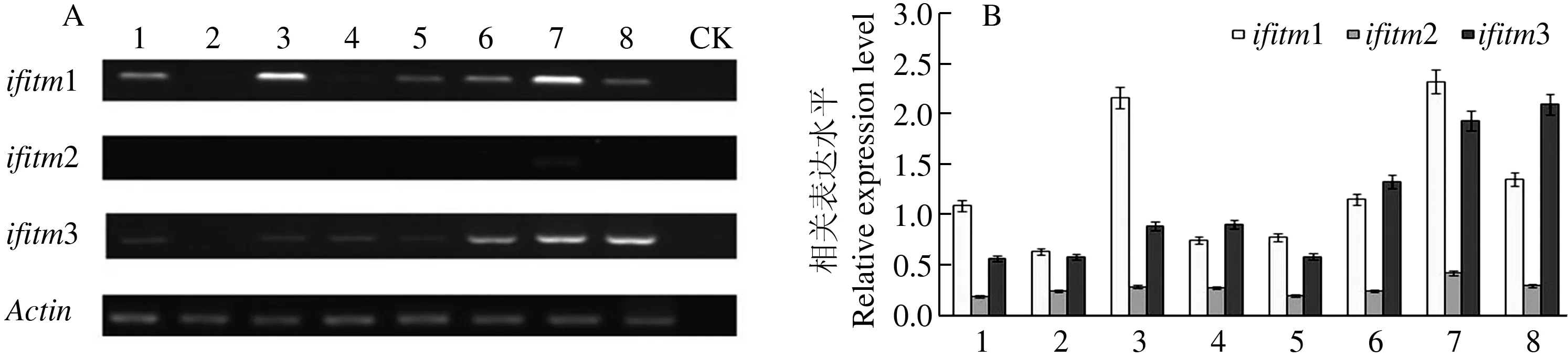
A.不同猪组织的RT-PCR 电泳结果;B.采用Image J 软件对RT-PCR 条带定量分析结果;1:肌肉;2:骨;3:肝;4:脑;5:小肠; 6:心脏;7:脾脏;8:肾脏;CK:对照A.Agrose electrophoresis analysis of RT-PCR; B.Quantitative analysis of RT-PCR bands using Image J soft ware.1:Muscle; 2:Bone; 3:Liver; 4:Brain; 5:Intestine; 6:Heart; 7:Spleen; 8:Kidney.CK:Control check
3 小结与讨论
目前,猪肉仍是中国消费最多的肉类。在生猪养殖过程中,常常容易引起流感病毒、口蹄疫病毒、乙型脑炎病毒、猪繁殖与呼吸综合症等多种病毒感染,特别是一些人兽共患病毒性疾病,不仅严重影响了家畜养殖业,也对人类的健康造成极大威胁。在病毒感染的早期,由干扰素调控的猪先天抗病毒免疫发挥着重要作用。BRASS等[11]首次报道了人ifitm是可抑制流感病毒(IAV)、西尼罗河病毒(WNV)和登革热病毒(DV)的跨膜蛋白。由此开始,在以后的几年中,研究人员开展了人和鼠的ifitm抵抗多种病毒的研究[18]。病毒感染细胞后,诱导细胞产生抗病毒功能的I型IFN,IFN与细胞表面的IFN受体结合后可激活JAK/STAT信号通路,从而导致一系列抗病毒基因的转录,抑制了病毒的复制和扩散。
本研究克隆了猪的3个ifitm基因,并将其序列与其他物种进行了比对,不仅其基因结构蛋白序列与人的ifitm具有很高的相似性和同源性,而且具有相似的翻译后修饰位点,提示猪的ifitm可能具有相类似的功能,如:S-棕榈酰化位点对ifitm的抗病毒效应起重要作用[13],但S-棕榈酰化位点是否与抗病毒效应有关有待近一步研究。XU等[19]的最新研究结果表明,猪ifitm蛋白具有抗甲型流感病毒和口蹄疫病毒的作用,是猪ifitm抗病毒功能的有力证据。本研究所获得的ifitm2与ifitm3序列与LANZ等[20]所报道的猪ifitm序列相同,而ifitm1 有所不同,本研究并没有克隆到ifitm1a 和ifitm1b 2个ifitm1-like序列[20]。猪ifitm的不同组织表达分析结果显示,在大约克夏猪中ifitm1、ifitm3在各个组织中都有表达,但在脾脏的高表达提示其与其他物种的ifitm一样,除和机体的先天免疫有关以外,也参与细胞的多种生命活动。猪ifitm的cDNA克隆和序列及组织表达分析为后续的抗原表达研究、抗病毒、代谢机制等多项研究奠定了基础。
[1] VERED DANIEL-CARMI V,MAKOVITZKI-AVRAHMA E,REUVEN E M,et al.The human 1-8D gene (ifitm2) is a novel p53 independent pro-apoptotic gene [J].International journal of cancer,2009,125 (12):2810-2819.
[2] FRIEDMAN R L,MANLY S P,MCMAHON M,et al.Transcriptional and posttranscriptional regulation of interferon-induced gene expression in human cells [J].Cell,1984,38(3):745-755.
[3] CUDDAPAH S,CUI K R,ZHAO K J.Transcriptional enhancer factor 1 (TEF-1/TEAD1) mediates activation ofifitm3 gene by BRGl [J].FEBS Letters,2008,582(2):391-397.
[4] HANAGATA N,LI X.Osteoblast-enriched membrane proteinifitm5 regulates the association of CD9 with an FKBP11-CD81-FPRP complex and stimulates expression of interferon-induced genes [J].Biochemical and Biophysical Research Communications,2011,409 (3):378-384.
[5] BAILEY C C,HUANG I C,KAM C,et al.ifitm3 limits the severity of acute influenza in mice [J].PLOS Pathogens,2012,8(9):e1002909.
[6] LANGE U C ADAMS D J,LEE C,et al.Normal germ line establishment in mice charring a detection of theifitm/fragilis gene family cluster[J].Molecular and Cellular Biology,2008,28(15):4688-4697.
[7] HICKFORD D,FRANKEBERG S,SHAW G,et al.Evolution of vertebrate interferon inducible transmembrane proteins[J].BMC Genomics,2012,13:155.
[8] 刘宇虎,钟东,张振书,等.大肠癌中干扰素诱导的跨膜蛋白1基因表达及其临床意义 [J].中华消化杂志,2006,26(4):276-277.
[9] 马娅梅,吴保平,夏欧东,等.干扰素诱导的跨膜蛋白Peutz-Jeghers 综合征的表达及意义 [J].南方医科大学学报,2009,29(3):541-547.
[10] 何敬东,张振书,肖冰,等.干扰素诱导跨膜蛋白1协同干扰素抑制结肠癌细胞增殖[J].肿瘤,2006,26(8):705-716.
[11] BRASS A L,HUANG I C,BENITA,et al.ifitmproteins mediate the innate immune iesponse to influenza A H1N1 virus,West Nile virus and Dengue virus[J].Cell,2009,139(7):1243-1254.
[12] CHAN Y K,HUANG I C,FARZAN.ifitmproteins restrict antibody-dependent enhancement of Dengue virus infection [J].PLoS ONE,2012,7(3):e34508.
[13] YOUNT J S,MILTEDO B,YANG Y Y,et al.Palmitoylome profiling reveals S-palmitoylation-dependent antiviral activity ofifitm3 [J].Natural chemical biology.2010,6(8):610-614.
[14] LU J,PAN Q,RONG L,et al.Theifitmproteins inhibit HIV-1 infection [J].Journal of virology,2011 (8):2126-2137.
[15] SALLMAN A M,BRINGELAND D,FREDRIKSSON R,et al.The dispanins:aNovel gene family of ancient origin that contains 14 human members [J].PLoS ONE,2012,7(2):e31961.
[16] TANANK S S,YAMAQUCHI Y L,TSOI B et al.ifitm/Mil/fragilis family proteinsifitm1 andifitm3 play distinct roles in mouse primordial germ cell homing and repulsion [J].Developmental cell,2005,9(6):745-756.
[17] TANAKA S S,MATSUI Y.Developmentally regulated expression ofmil-1 andmil-2,mouse interferon-induced transmembrane protein like genes,during formation and differentiation of primordial germ cells [J].Mechanisms of Development,2002,119S1:S261-267.
[18] BAILEY C C,ZHONG G,HUANG I C et al.ifitm-family protein:the cell’s first line of antiviral defense [J].Annual Review of Virology,2014,1:216-238.
[19] XU J,QIAN P,WU Q,et al.Swine interferon-induced transmembrane protein,sifitm3,inhibits foot-and-mouth disease virus infection in vitro and in vivo[J].Aiviral Research.2014,109:22-29.
[20] LANZ C,YANGUEZ E,ANDENMATTEN D,et al.Swine interferon-inducible transmembrane proteins potently inhibit influenza A virus replication[J].Journal of Virology.2015,89(1):863-869.
(责任编辑:朱秀英)
Cloningandanalysisofsequenceandtissueexpressionofswineifitmgene
ZHANG Yujuan,ZHAO Ting,XU Zhao,YU Kun,MA Qian,LI Chaoyan,ZHENG Wenming,XU Jun
(College of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China)
Interferon induced transmembrane protein (ifitm),the first defensive line of organism to resist to virus infection,including many members such asifitm1,ifitm2 andifitm3,belongs to Interferon-stimulated Genes(ISGs).It can abundantly express after interferon-stimulated.Ifitmcan regulate a series of cell biological activities include the control of cell proliferation and have anti-viral function and other important roles.To explore the functions of pigifitm,we cloned and reported three differentifitmcDNAs.Bioinformatics was employed to study the chromosome location of threeifitmgenes in pig,and the homologous relationship between pig and other species.For the first time,we analyzed the difference of their gene expression in various tissues of pig.The results show that swineifitmhas the similar genetic and protein structures withifitmfrom human,mouse and other species.Swineifitmare highly evolutionary homologous to cattle.Ifitm1 andifitm3 expressed in tissues such as spleen,kidney,heart and liver etc.however,ifitm2 is only found in spleen and kidney,and extremely slight expression is detected.Cloning and analysis of bioinformatics and tissue expression established the foundation for further studies on the functions in swine.
ISGs; Procine interferon-inducible transmembrane protein of pit; gene clone; gene sequence; expression variation of different tissue
S852.4
:A
2015-08-29
河南省科技厅基础与前沿研究项目(112300410088);河南省科技厅科技攻关重点项目(112102310324);河南省教育厅科技研究重点项目(12B230007)
张玉娟(1988-),女,河南新乡人,硕士研究生,主要从事细胞分子生物学研究。
许 君(1972-),女,河南开封人,副教授。
1000-2340(2016)03-0359-05
